黄连素通过调节miRNA-146a促进乳腺癌细胞凋亡*
2016-12-26孟昭杰巴雅尔
孟昭杰, 巴雅尔, 张 明, 陈 立
(1中山大学材料科学与工程学院, 广东 广州 510275; 2深圳市海普瑞药业股份有限公司, 广东 深圳 518057;3吉林大学基础医学院药理系, 吉林 长春 130021; 4包头市肿瘤医院综合内科, 内蒙古 包头 014030)
黄连素通过调节miRNA-146a促进乳腺癌细胞凋亡*
孟昭杰1, 2, 3, 巴雅尔4, 张 明3△, 陈 立3
(1中山大学材料科学与工程学院, 广东 广州 510275;2深圳市海普瑞药业股份有限公司, 广东 深圳 518057;3吉林大学基础医学院药理系, 吉林 长春 130021;4包头市肿瘤医院综合内科, 内蒙古 包头 014030)
目的: 探讨黄连素对乳腺癌MCF-7细胞凋亡的影响及其作用机制。方法:乳腺癌细胞MCF-7采用含10%小牛血清的1640培养基培养,实验分为对照组、黄连素低剂量组、黄连素中剂量组和黄连素高剂量组。给药处理24 h后,采用MTT法检测各组中MCF-7细胞的存活率;Hoechst 33258染色及流式细胞技术观察细胞的凋亡情况;采用Western blot法检测各组MCF-7细胞中NF-κB P65磷酸化水平及促凋亡蛋白Bax和抑凋亡蛋白Bcl-2的表达水平;RT-qPCR法检测细胞中microRNA-146a(miRNA-146a)的水平。为进一步探讨黄连素影响乳腺癌MCF-7细胞凋亡的作用机制,本实验还检测了转染miRNA-146a siRNA后黄连素对促凋亡蛋白Bax和抑凋亡蛋白Bcl-2的mRNA水平的影响。结果:MTT实验结果显示,与对照组相比,黄连素中、高剂量给药组MCF-7细胞的存活率明显降低,且呈一定的剂量依赖性(P<0.01);Hoechst 33258染色观察到给药组细胞核呈致密浓染,或呈碎块状致密浓染;流式细胞技术实验结果亦显示,黄连素给药组MCF-7细胞凋亡率显著增加(P<0.05);Western blot实验结果显示,与对照组比较,黄连素给药组的p-P65和Bcl-2表达水平明显降低,Bax表达水平明显升高,且呈一定的剂量依赖性(P<0.05);RT-qPCR实验结果显示,与对照组比较,黄连素给药组的miRNA-146a表达水平明显升高,且呈一定的剂量依赖性(P<0.05)。黄连素给药联合转染miRNA-146a siRNA后,与黄连素单独给药组相比,MCF-7细胞中Bax mRNA水平显著下降(P<0.05),Bcl-2 mRNA水平显著上调(P<0.05)。结论:黄连素能够促进乳腺癌MCF-7细胞凋亡,其机制可能有部分是通过miRNA-146a抑制NF-κB P65磷酸化,最终影响凋亡相关蛋白Bax/Bcl-2的表达。
黄连素; MicroRNA-146a; 乳腺癌; 细胞凋亡
乳腺癌已成为女性较为常见的恶性肿瘤之一,近年来其发生发展日趋年轻化,发病率和死亡率也逐年增高,预计到2021年将会达到百分之一[1-2]。因此,研究和开发具有高效的抗乳腺癌的药物是我们亟待解决的问题。
微小RNA(microRNA,miRNA,miR)是一类长约19~22个核苷酸的内源性的非编码小分子RNA,在细胞的生长、分化及凋亡等方面起到关键作用。近年来研究证实,miR-146a的表达与乳腺癌细胞的增殖、转移、凋亡等密切相关[3-4]。研究发现,在乳腺癌细胞MCF-7中过表达miR-146a可以抑制NF-κB信号通路,从而促进细胞凋亡,降低乳腺癌细胞的转移和侵袭能力[4]。
黄连素又名小檗碱(berberine,BBR),是从我国传统中药黄连中提取的一种重要的生物碱,具有显著的抑菌、抗炎、降糖、抗氧化、抗肿瘤等多种药理活性。近来研究显示,黄连素能够提高乳腺癌细胞MCF-7的药物敏感性,抑制乳腺癌细胞的转移,促进乳腺癌细胞的凋亡[5],亦有研究显示黄连素可抑制NF-κB的表达[6],但其是否能以miR-146a为靶点促进乳腺癌细胞的凋亡还有待进一步研究。
材 料 和 方 法
1 细胞、试剂和仪器
MCF-7细胞系购自上海复旦细胞库。黄连素(东北制药厂);RPMI-1640培养基、小牛血清和0.25%胰蛋白酶(Gibco);噻唑兰(MTT)(Sigma);Annexin V-FITC流式检测试剂盒(上海生物科技有限公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);抗NF-κB(P65)、p-P65、Bax、Bcl-2、GAPDH Ⅰ抗及相应的Ⅱ抗(Abcam);miRNA-146a siRNA(上海吉玛生物股份有限公司);RT-qPCR试剂盒(TaKaRa)。低温超速离心机(Thermo);Westen blot电泳系统(Bio-Rad);凝胶成像系统(Tanon);相差显微镜(Olympus);分析天平(Mettler Toledo);超净工作台(SIEMENS);细胞培养箱、酶标仪(Sanyo);流式细胞仪(Beckman)。
2 方法
2.1 细胞培养及分组 MCF-7细胞采用含双抗(100 mg/L链霉素和1×105U/L 青霉素)的RPMI-1640培养基加10%小牛血清培养,置于37 ℃、5% CO2的细胞培养箱中培养,每2~3 d换液,待细胞生长至对数生长期后进行实验,实验分为4组,分别为对照组(control组)、黄连素低剂量(low dose,L;2.5 μmol/L)组(BBR-L组)、黄连素中剂量(medium dose,M;5 μmol/L)组(BBR-M组)和黄连素高剂量(high dose,H;10 μmol/L)组(BBR-H组),给药处理24 h后收集细胞。
2.2 MTT实验检测细胞活力 将MCF-7细胞接种于96孔板中,每孔5×103个,细胞贴壁后给予黄连素处理24 h,每孔加入5 g/L MTT溶液,置于细胞培养箱中继续孵育2~4 h。孵育结束后弃去上清,每孔加入150 μL DMSO,置于酶标仪(490 nm)读取吸光度(A)值。细胞存活率(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.3 Hoechst 33258染色 将MCF-7细胞接种于铺有盖玻片的6孔板中,每孔2×105个,细胞贴壁后给予黄连素处理24 h, PBS洗涤细胞 1 min、3次,每孔加入中性多聚甲醛,室温下固定15 min, PBS洗涤1 min、3次,之后加入500 μL Hoechst 33258染色液(5 mg/L)避光染色10 min,PBS洗涤1 min、3次,之后取出盖玻片倒扣于滴加了抗荧光淬灭剂的载玻片上,封片,荧光显微镜下观察。
2.4 流式细胞术检测MCF-7细胞凋亡情况 MCF-7细胞培养24 h后,换含不同剂量黄连素的血清及对照血清继续培养24 h,胰酶消化,收集培养液;1 000 r/min 4℃离心10 min,弃上清;加入1 mL PBS重悬细胞,轻轻振荡使细胞悬浮,300目尼龙网过滤细胞;离心,弃上清;按Annexin V细胞凋亡试剂盒步骤操作,同时以不加Annexin V-FITC及PI的MCF-7细胞作为阴性对照。
2.5 Western blot法检测凋亡相关蛋白的表达 提取细胞总蛋白,用BCA蛋白浓度试剂盒测定样品蛋白含量,配制5%浓缩胶和15%分离胶,上样,电泳,之后将凝胶上的蛋白转移到PVDF膜上,并于5%脱脂奶粉或5% 牛血清白蛋白封闭液中室温下封闭2 h,洗膜,加 I 抗Bax(1∶1 000)、Bcl-2(1∶1 000)、NF-κB(1∶1 000)、p-P65(1∶1 000)、GAPDH(1∶5 000),室温孵育2 h,洗膜,加Ⅱ抗(1∶10 000)室温孵育2 h,洗膜,采用ECL化学发光法显色,使用Quantity One软件对结果进行处理分析。
2.6 mRNA水平检测 不同剂量黄连素对MCF-7细胞miR-146a影响的检测:MCF-7细胞使用不同剂量BBR处理24 h后提取RNA;转染miR-146a siRNA后相关mRNA检测:细胞以每孔2×104个接种于24孔板,转染6 h后去除转染试剂,给予5 μmol/L黄连素处理24 h,采用TRIzol法抽提MCF-7细胞总RNA,并按照逆转录试剂盒说明书进行逆转录。miR-146a的上游引物为5’-CCGATGTGTATCCTCAGC-TTTG-3’,下游引物为5’-GCTGAAGAACTGAATTT-CAGAGGTC-3’;U6的上游引物为5’-CTCGCTTCGGC-AGCACATA-3’,下游引物为5’-AACGCTTCACGAATTGCG-3’;Bcl-2的上游引物为5’-GGGGCTACGAGTGGGATGCTGGAGA-3’,下游引物为5’-TGCACA-GCGGGCATTGGGTT-3’;Bax的上游引物为5’-CA-GGGTTTCATCCAGGATCGAGCAGG-3’,下游引物为5’-CGGGGGGAGTCCGTGTCCACGTCAG-3’。扩增条件为:95 ℃ 10 min;95 ℃ 15 s、60 ℃ 1 min,40个循环;95 ℃ 15 s、60 ℃ 30 s、95 ℃ 15 s。检测结果以2-ΔΔCt法计算,并将对照组的表达水平归化为1后计算相对表达水平。
2.7 miR-146a siRNA转染效率检测 将对数期的MCF-7细胞接种于6孔板中,采用无双抗培养基培养。24 h后按照Lipo2000转染说明,采用瞬时转染法将1 μg miR-146a siRNA和阴性对照siRNA转染至乳腺癌细胞MCF-7中,转染6 h后去除转染试剂,荧光显微镜下观察转染效率。
3 统计学处理
使用SPSS 17.0软件进行数据统计。计量资料均以均数±标准误(mean±SEM)表示,多组间比较采用单因素方差(one-way ANOVA)分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 黄连素对MCF-7细胞存活率的影响
MTT实验结果如图1所示,BBR-L组的细胞存活率与control组比较未有显著性差异,而BBR-M和BBR-H组的细胞存活率与control组相比则显著降低(P<0.01)。
2 黄连素对MCF-7细胞细胞核的影响
Hoechst 33258染色实验结果可见,control组细胞的细胞核边缘光滑整齐,呈蓝色,均匀淡染;BBR给药组细胞的细胞核固缩,边缘不整齐,呈碎块状致密浓染,甚至可见裂解的细胞核;随给药浓度的增大,细胞核改变更为明显,见图2。
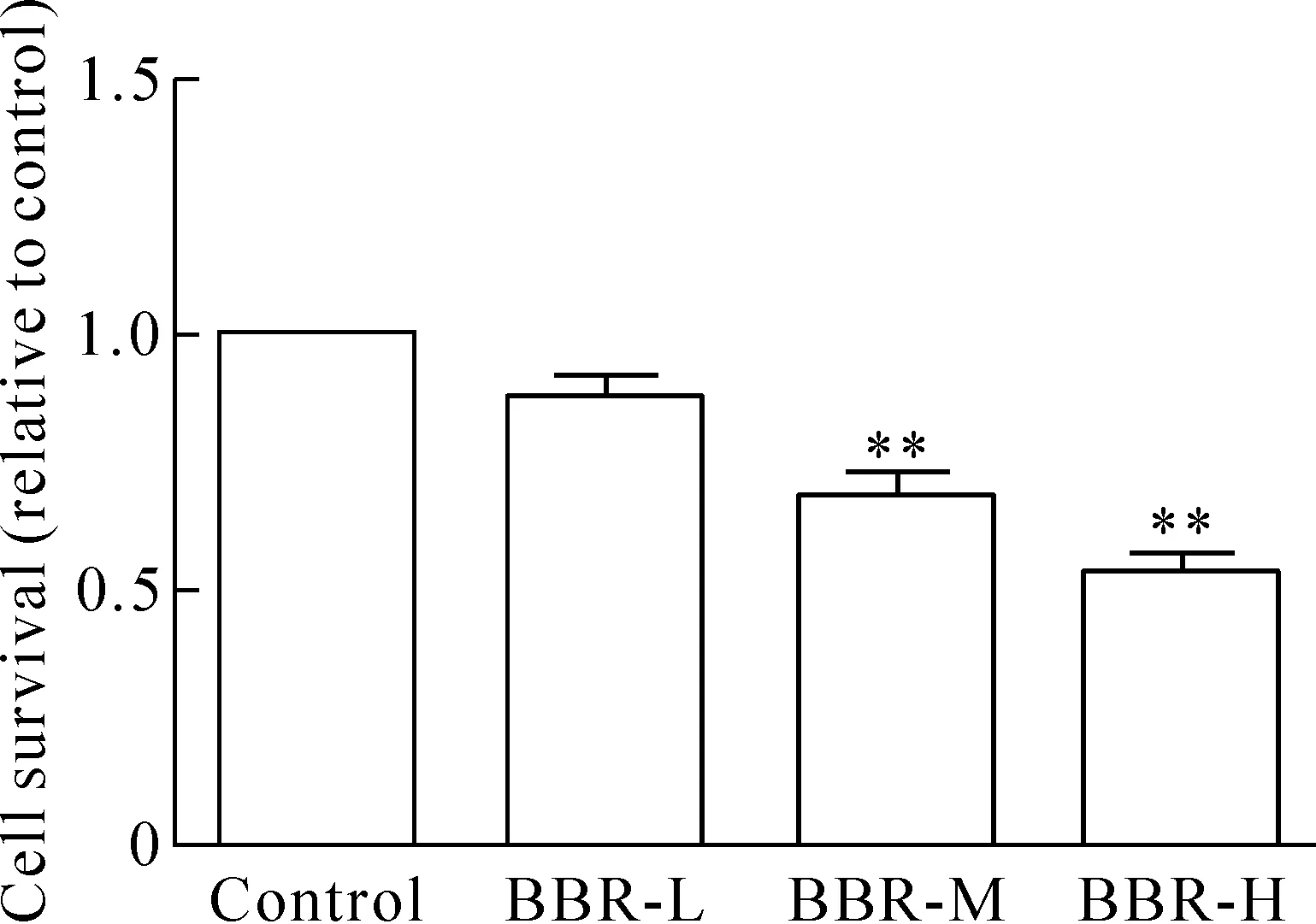
Figure 1.The viability of the MCF-7 cells in each group. Mean±SEM.n=6.**P<0.01vscontrol.
图1 黄连素对MCF-7细胞存活率的影响
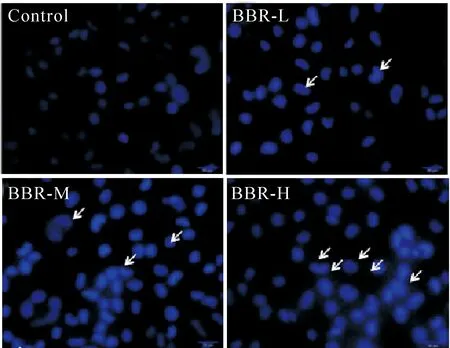
Figure 2.The effect of berberine on the morphological changes of the nucleus in the MCF-7 cells (×400).
图2 黄连素对MCF-7细胞细胞核形态的影响
3 黄连素对MCF-7细胞凋亡的影响
采用流式细胞技术检测结果显示, BBR-L组的细胞凋亡率为(9.15±1.31)%,与control组比较无显著性差异;BBR-M和BBR-H组细胞凋亡率分别为(15.77±1.20)%和(22.37±0.89)%,与对照组相比均显著升高(P<0.05),见图3。
4 黄连素对MCF-7相关蛋白表达的影响
与control组相比,黄连素给药组p-P65和Bcl-2表达水平降低,且呈一定的剂量依赖性。BBR-M和BBR-H组p-P65的表达与control组相比差异具有统计学意义(P<0.05)。与control组相比,黄连素给药后促凋亡蛋白Bax蛋白表达水平升高,且呈一定的剂量依赖性。BBR-M和BBR-H组Bax蛋白表达水平与control组相比差异有统计学意义(P<0.05),见图4。

Figure 3.The effect of berberine on apoptosis in the MCF-7 cells. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol.
图3 黄连素对MCF-7细胞凋亡的影响
5 黄连素对MCF-7细胞miR-146a表达水平的影响
与control组相比,黄连素给药后miRNA-146a的表达水平升高,呈一定的剂量依赖性。BBR-M组和BBR-H组的miRNA-146a表达水平与control组相比差异具有统计学意义(P<0.05),见图5。
6 MCF-7细胞中miR-146a siRNA转染效率的检测
采用瞬时转染法转染miR-146a siRNA于MCF-7细胞24 h后在荧光显微镜下观察miR-146a siRNA的转染效率,约有60%以上的细胞表达绿色荧光蛋白。与此同时,RT-qPCR实验结果也显示转染miR-146a siRNA 24 h后,MCF-7细胞中miR-146a的表达明显降低,说明可用于后续实验,见图6。
7 黄连素通过miR-146a调控对凋亡相关蛋白Bax、Bcl-2的mRNA水平的影响
与control组相比,转染miRNA-146a siRNA后24 h,MCF-7细胞中促凋亡蛋白Bax的mRNA表达水平明显降低,抑凋亡蛋白Bcl-2的mRNA表达水平明显升高;与BBR组相比,miRNA-146a siRNA与黄连素联合应用后,大大削弱了黄连素促进MCF-7细胞凋亡的效应,Bax的mRNA表达水平明显降低,抑凋亡蛋白Bcl-2的mRNA表达水平明显升高。说明黄连素能够促进乳腺癌细胞MCF-7的凋亡,至少部分是通过miRNA-146a实现的,见图7。

Figure 4.The effect of berberine on the protein expression of Bax, Bcl-2 and p-P65 in the MCF-7 cells. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group.
图4 黄连素对MCF-7细胞Bax、Bcl-2和p-P65蛋白表达的影响

Figure 5.The effect of berberine on the expression of miRNA-146a in the MCF-7 cells. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group.
图5 黄连素对MCF-7细胞miRNA-146a表达的影响
讨 论
乳腺癌是严重危害女性健康的恶性肿瘤,是全世界排名第二的肿瘤疾病,每年有近50万女性患者死于乳腺癌[7]。诸多因素参与了乳腺癌的形成、发展及转移,microRNA 是其重要的影响因素之一,并且可能用于乳腺癌的早期诊断[8]。miR-155和miR-21是具有促癌作用的microRNA。Zhang 等[9]证实,miR-155可直接与肿瘤蛋白53诱导核蛋白1(Tp53INP1,一种抑制细胞增殖、促进细胞凋亡的蛋白)3’-UTR区结合,使Tp53INP1表达减少,从而抑制癌细胞分化周期G1期的停滞,促进癌细胞增殖。
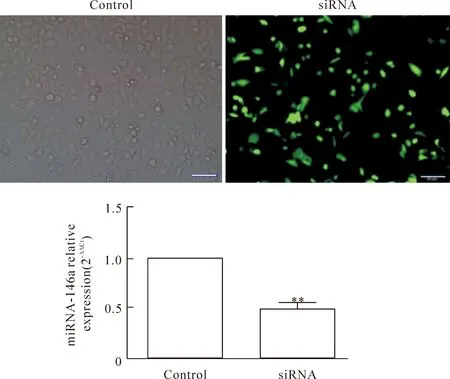
Figure 6.The efficiency of miR-146a siRNA transfection detected by RT-qPCR. siRNA: miR-146 siRNA. Mean±SEM.n=6.**P<0.01vscontrol group.
图6 MCF-7细胞中miR-146a siRNA转染效率的检测
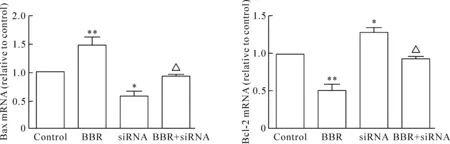
Figure 7.The effect of berberine and know-down of miR-146a on the mRNA expression of Bax and Bcl-2. siRNA: miR-146a siRNA. Mean±SEM.n=6.*P<0.05,**P<0.01vscontrol group;△P<0.05vsBBR group.
图7 黄连素通过miR-146a调节凋亡相关蛋白Bax、Bcl-2 mRNA的表达水平
Li 等[10]发现,转移率高的乳腺癌中miR-21 的表达明显高于转移率低的乳腺癌。近年来研究证实,miRNA-146a是一个典型的多功能microRNA,参与炎症、自身免疫性疾病和肿瘤等的发生发展。Kumar等[11]证实,与健康志愿者相比,乳腺癌患者血清中miR-146a水平显著升高,这一点可以用作乳腺癌的诊断指标。但乳腺癌患者血清中高水平的miR-146a是如何产生并进一步影响乳腺癌病程的发生和发展目前尚没有报道。另有大量研究报道,NF-κB是miR-146a的靶蛋白[12],miR-146a通过调节NF-κB的表达对炎症、免疫疾病、糖脂代谢异常及肿瘤等疾病进行调节。
近年来,黄连素作为传统的治疗腹泻药物,被广泛地证明具有抗炎、降糖、抗氧化、抗肿瘤等多种药理活性。黄连素抑制乳腺癌增殖作用亦被广泛报道。Li等[13]研究表明,黄连素可以下调乳腺癌MDA-MA-231细胞中NF-κB的表达,从而抑制乳腺癌细胞的增殖;Pazhang等[6]证实,黄连素可以通过调节NF-κB的表达,进而影响环氧合酶-2(cyclooxygenase-2,COX-2)的表达,达到促进人乳腺导管上皮肿瘤细胞凋亡的作用。然而,黄连素在乳腺癌细胞中是否对miR-146a具有调节作用,以及更进一步通过miR-146a调节NF-κB诱导乳腺癌细胞凋亡目前尚无报道。本实验结果显示黄连素处理细胞后,MCF-7细胞凋亡率显著增加,Bax表达明显升高、Bcl-2表达水平明显降低,呈剂量依赖性,且p-P65的表达水平随黄连素浓度的增加而降低,miRNA-146a表达水平明显增加。本实验研究也显示将miRNA-146a 沉默后,黄连素促进乳腺癌MCF-7细胞凋亡的水平明显降低。说明黄连素能够促进乳腺癌细胞的凋亡至少部分是通过miR-146a实现的。
[1] Levaggi A, Poggio F, Lambertini M. The burden of breast cancer from China to Italy[J]. J Thorac Dis, 2014, 6(6):591-594.
[2] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7):e279-e289.
[3] Liu Q, Wang W, Yang X, et al. MicroRNA-146a inhibits cell migration and invasion by targeting RhoA in breast cancer[J]. Oncol Rep, 2016, 36(1):189-196.
[4] Bhaumik D, Scott GK, Schokrpur S, et al. Expression of microRNA-146 suppresses NF-kappaB activity with reduction of metastatic potential in breast cancer cells[J]. Oncogene, 2008, 27(42):5643-5647.
[5] Barzegar E, Fouladdel S, Movahhed TK, et al. Effects of berberine on proliferation, cell cycle distribution and apoptosis of human breast cancer T47D and MCF7 cell lines[J]. Iran J Basic Med Sci, 2015, 18(4):334-342.
[6] Pazhang Y, Ahmadian S, Javadifar N, et al. COX-2 and survivin reduction may play a role in berberine-induced apoptosis in human ductal breast epithelial tumor cell line[J]. Tumour Biol, 2012, 33(1):207-214.
[7] 彭晓丹, 诸梦露, 高绿芬, 等. FK228和雷帕霉素协同促进人乳腺癌细胞凋亡和细胞周期阻滞[J]. 中国病理生理杂志, 2015, 31(4):577-584.
[8] 霍 晶, 吴夏阳, 李文睿, 等. MicroRNA与乳腺癌近期研究进展[J]. 中国临床药理学杂志, 2015, 31(16):1677-1680.
[9] Zhang CM, Zhao J, Deng HY. MiR-155 promotes proliferation of human breast cancer MCF-7 cells through targeting tumor protein 53-induced nuclear protein 1[J]. J Biomed Sci, 2013, 20:79.
[10]Li J, Zhang Y, Zhang W, et al. Genetic heterogeneity of breast cancer metastasis may be related to miR-21 regulation of TIMP-3 in translation[J]. Int J Surg Oncol, 2013, 2013:875078.
[11]Kumar S, Keerthana R, Pazhanimuthu A, et al. Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J]. Indian J Biochem Biophys, 2013, 50(3):210-214.
[12]Kamali K, Korjan ES, Eftekhar E, et al. The role of miR-146a on NF-kappaB expression level in human umbilical vein endothelial cells under hyperglycemic condition[J]. Bratisl Lek Listy, 2016, 117(7):376-380.
[13]Li X, Zhao SJ, Shi HL, et al. Berberine hydrochloride IL-8 dependently inhibits invasion and IL-8-independently promotes cell apoptosis in MDA-MB-231 cells[J]. Oncol Rep, 2014, 32(6):2777-2788.
(责任编辑: 林白霜, 余小慧)
Berberine promotes apoptosis of human breast cancer cells by regulating miRNA-146a
MENG Zhao-jie1, 2, 3, BA Ya-er4, ZHANG Ming3, CHEN Li3
(1SchoolofMaterialsScienceandEngineering,SunYat-senUniversity,Guangzhou510275,China;2ShenzhenHepalinkPharmaceuticalCo.,Ltd,Shenzhen518057,China;3DepartmentofPharmacology,CollegeofBasicMedicalScience,JilinUniversity,Changchun130021,China;4ComprehensiveMedicineDepartment,BaotouCancerHospital,Baotou014030,China.E-mail:zhangming_00@126.com)
AIM: To observe the effect of berberine on apoptosis of MCF-7 cells and its potential mechanism. METHODS: The MCF-7 cells were divided into control group and the groups with 3 different doses of berberine. The cell viability was detected by MTT assay, while the cell apoptosis was measured by Hoechst 33258 staining and flow cytometry assay. The protein levels of p-P65, Bax and Bcl-2 were Western blot. The levels of microRNA-146a(miRNA-146a) in the MCF-7 cells were detected by RT-qPCR. The miRNA-146a siRNA was transfected to the MCF-7 cells after an evaluation of transfection efficacy, which was co-incubated with berberine to observe its effects on the mRNA levels of Bax and Bcl-2. RESULTS: Compared with control group, the cell viabilities were decreased significantly in medium and high doses of berberine treatment groups with a dose-dependent manner (P<0.01). The cell apoptosis was increased significantly in medium and high doses of berberine treatment groups dose-dependently (P<0.05). The protein levels of Bax were up-regulated, while those of Bcl-2 and p-P65 were down-regulated significantly by the treatment of berberine (P<0.05). In addition, the miRNA-146a levels were increased significantly in medium and high doses of berberine treatment groups (P<0.05) and showed a dose-dependent manner. The mRNA levels of Bax were decreased, while the mRNA levels of Bcl-2 were increased after transfection with miRNA-146a siRNA and co-incubated with berberine. CONCLUSION: Berberine promotes apoptosis of MCF-7 cells. The mechanism may be related to inhibit the activity of NF-κB by incresing the levels of miRNA-146a.
Berberine; MicroRNA-146a; Breast cancer; Apoptosis
1000- 4718(2016)11- 1966- 06
2016- 09- 09
2016- 10- 13
吉林省科委基金(No. 20140203011YY; No. 20150311013YY)
R730.23
A
10.3969/j.issn.1000- 4718.2016.11.008
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0431-85619799; E-mail: zhangming_00@126.com
