稀硝酸体系中N,N-二甲基羟胺与亚硝酸反应的动力学
2016-11-11朱冬冬李传博郑卫芳晏太红谢书宝石四维
朱冬冬,李传博,郑卫芳,晏太红,谢书宝,左 臣,石四维
中国原子能科学研究院 放射化学研究所,北京 102413
稀硝酸体系中N,N-二甲基羟胺与亚硝酸反应的动力学
朱冬冬,李传博,郑卫芳*,晏太红,谢书宝,左臣,石四维
中国原子能科学研究院 放射化学研究所,北京102413
采用分光光度法研究了0.1~0.4 mol/L稀硝酸体系中N,N-二甲基羟胺(DMHAN)与亚硝酸的反应动力学,包括硝酸浓度、亚硝酸浓度、二甲基羟胺浓度、离子强度、温度等条件的影响。稀硝酸体系中二甲基羟胺与亚硝酸反应的动力学方程为:
二甲基羟胺;硝酸;亚硝酸;反应动力学;计量比
PUREX(plutonium uranium reduction extraction)流程广泛地应用于乏燃料后处理,该流程以硝酸溶液作为水相介质。由于硝酸会缓慢分解产生少量亚硝酸,而硝酸在辐照和乏燃料溶解等过程中也会生成亚硝酸,因此亚硝酸时刻伴随着硝酸存在于PUREX流程中,并对PUREX流程产生重要影响。一方面,亚硝酸的存在对流程有利,例如可以抑制对TBP萃取Pu不利的Pu(Ⅵ)的生成[1];但是另一方面,亚硝酸的存在会对还原剂的用量、产品去污因子、生产安全等诸多因素产生影响。因此亚硝酸浓度的控制在PUREX流程应用中具有重要的意义。
早期的PUREX流程中使用氨基磺酸亚铁作为亚硝酸的清扫剂,而现行改进的PUREX流程中使用无盐试剂如羟胺和肼作为钚的还原剂和亚硝酸的清扫剂[2-3]。中国原子能科学研究院提出了以N,N-二甲基羟胺(DMHAN)作为还原剂和以单甲基肼(MMH)作为支持还原剂的改进PUREX流程,命名为APOR(advance process based on organic reductants)流程。在此流程中,二甲基羟胺的行为与羟胺(HAN)类似[4-5]:一方面,二甲基羟胺会与体系中的亚硝酸反应,使体系中的亚硝酸浓度降低;另一方面,在一定条件下,二甲基羟胺会与硝酸反应生成亚硝酸,使亚硝酸的浓度增加。已有学者对二甲基羟胺进行了大量的研究,包括二甲基羟胺辐解行为和机理[6-7]、二甲基羟胺与各种金属离子反应的动力学研究[8-11]、二甲基羟胺的电化学研究[12]等。李高亮等[13]还对二甲基羟胺与亚硝酸的反应动力学进行了研究,二甲基羟胺与亚硝酸在高氯酸介质中的反应遵循式(1)。
-dc(HNO2)/dt=kc(DMHAN)c(HNO2)
(1)
该反应与酸度和高氯酸根浓度无关;硝酸中二甲基羟胺与亚硝酸的反应对亚硝酸为1级,对二甲基羟胺为0.54级,但未定量给出氢离子及离子强度的影响,没有全面反映二甲基羟胺在实际应用中与亚硝酸的反应过程,因此本工作结合实际需要,对稀硝酸体系中二甲基羟胺与亚硝酸的反应动力学进行了进一步研究,为二甲基羟胺在先进流程中安全合理的使用提供理论支持。
1 实验部分
1.1试剂和仪器
实验中所用的硝酸、硝酸钠、高氯酸钠、亚硝酸钠、硝酸铁、水合肼均为分析纯,国药集团药业股份有限公司;二甲基羟胺为中国原子能科学研究院自制,纯度大于98%。由于硝酸自身会分解出一定量的氮氧化物和HNO2,所以需定期煮沸,以尽量除去硝酸溶液中的氮氧化物和HNO2。其余试剂使用前未经纯化。硝酸、二甲基羟胺和水合肼的浓度使用酸碱滴定法确定,反应过程中的亚硝酸浓度使用分光光度法确定。
Lambda 950型紫外-可见分光光度计,美国 Perkin Elemer公司;G20型自动滴定仪、T50型自动滴定仪,德国梅特勒-托利多公司;智能恒温循环器,北京德天佑科技发展有限公司。
1.2实验方法
通过分光光度法研究硝酸体系中二甲基羟胺与亚硝酸的反应。在20 ℃下(温度实验除外),在1 cm比色皿内加入2 mL反应液在371 nm处监测比色皿内亚硝酸的吸光值变化,以监测反应过程中亚硝酸的浓度变化。
1.3动力学处理
(2)
式(2)中μ为离子强度。在实验中采用NaNO3溶液保持离子强度不变。式(2)取对数可得:
lg(-r)=algc(H+)+blgc(HNO2)+
(3)
令:
k′=algc(H+)+clgc(DMHAN)+
可得式(4)。
(4)

1.4亚硝酸和二甲基羟胺反应计量比的计算
在加入亚硝酸钠溶液引发反应后,当溶液吸光值下降至初始理论计算吸光值的一半左右时,加入一定体积的已知浓度的肼终止反应,分析溶液中剩余的二甲基羟胺的浓度[14],可得反应中消耗二甲基羟胺的量;根据加入肼前后吸光度值的变化计算未反应的亚硝酸的浓度,以确定参与反应的亚硝酸的量。
2 结果与讨论
2.1不同硝酸浓度下亚硝酸浓度随时间的变化
图1为20 ℃、不同硝酸浓度情况下,亚硝酸吸光度值(A)随时间变化的曲线。从图1可以看出,在酸度小于等于0.70 mol/L时,溶液吸光度值在200 s内未见增加,此时溶液中的反应以亚硝酸的分解反应为主;当酸度升高时,如酸度为1.7、2.5 mol/L时,吸光度值A先降低后增加,这表明溶液中亚硝酸的分解速率先大于生成速率,而后生成速率大于分解速率;当酸度为3.5 mol/L时,几乎观察不到吸光度值降低,加入亚硝酸钠溶液后吸光度值迅速增加,此时溶液中的反应以亚硝酸的生成反应为主。
由图1(a)还可知,在酸度小于等于0.70 mol/L时,亚硝酸吸光度值随时间的变化曲线呈下降趋势,且下降速率越来越平缓,最后近似呈一直线,与指数衰减类似,因此采用指数衰减对反应的前150 s进行拟合,结果示于图2。指数衰减通式可表述为式(5)。

20 ℃,μ=4.0 mol/L,c0(DMHAN)=3.0×10-2 mol/L,c0(HNO2)=3.0×10-3 mol/L c(H+) ,mol/L:1——0. 10,2——0.40,3——0.70,4——1.7,5——2.5,6——3.5图1 不同条件下溶液中亚硝酸吸光度值随时间的变化Fig.1 Variation of absorbance of nitrous acid with time at different conditions

20 ℃,μ=0.5 mol/L,c0(DMHAN)=6.0×10-2 mol/L,c0(HNO2)=3.0×10-3 mol/L,c0(H+)=0.30 mol/L实线为拟合数据图2 二甲基羟胺与亚硝酸的反应Fig.2 Variation of concentration of nitrous acid with time
(5)
对拟合的曲线求导,即可得反应某时刻的近似反应速率r的值。设将亚硝酸加入比色皿后,比色皿内亚硝酸的理论初始浓度为c0,将c0带入拟合式(5)中求得t0的值就可以认为是反应开始的时刻。再将t0带入拟合式中求导,计算得到反应初始时刻的反应速率r0的值。
2.4.1 溶液的制备 取含37种脂肪酸甲酯对照品的混合标准试剂适量,用正己烷配制成总成分质量浓度为1 000、500、100、50、10、1 mg/L的系列混合对照品溶液;另外,直接将1%水杨酸甲酯溶液以正己烷稀释至500 μg/mL,作为内标溶液。
2.2反应动力学方程的确定
在20 ℃时,分别于0.10、0.20、0.30、0.40、1.0、1.5 mol/L的硝酸中测定了1.0×10-3~6.0×10-3mol/L HNO2的吸光度值(A),发现不同酸度下相同浓度亚硝酸的吸光度值差异不大,依据不同酸度下相同浓度亚硝酸的平均吸光度值作图,示于图3。由图3得HNO2的工作曲线为y=56.135x+0.001。
由于以下原因,分光光度测量在低速率的搅拌下进行:(1) 使用搅拌可以减轻扩散步骤的影响;(2) 反应中会放出热量,使用搅拌可以加速热传递,更利于控温;(3) 考虑到引入搅拌可能加速反应的进行,因此不宜将搅拌速率设置过高。

图3 HNO2的工作曲线Fig.3 Working curve of HNO2
2.2.1HNO2、DMHAN和H+的反应级数在20 ℃,离子强度μ=0.50 mol/L的条件下,改变HNO2的初始浓度,使c0(HNO2)=2.0×10-3~6.0×10-3mol/L。计算后,得到初始时刻的反应速>率r0的绝对值为5.9×10-5~2.3×10-4mol/(L·s),依式(4)作lg(-r0)-lgc0(HNO2)图,得图4。由图4可知,HNO2的反应级数近似为1.26级。同理,在相同温度和离子强度下分别改变DMHAN和H+的初始浓度,求得DMHAN和H+的反应级数分别为0.85和0.45级。实验中各反应物浓度列入表1。

变量反应速率与变量的关系反应级数r条件c0(H+)/(mol·L-1)102c0(DMHAN)/(mol·L-1)103c0(HNO2)/(mol·L-1)c0(HNO2)lg(-r0)=1.26lgc0(HNO2)-0.801.260.9970.306.02.0~6.0c0(DMHAN)lg(-r0)=0.85lgc0(DMHAN)-2.940.850.9980.303.0~9.03.0c0(H+)lg(-r0)=0.45lgc0(H+)-3.780.450.9930.10~0.406.03.0
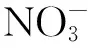
2.2.3温度对反应的影响得到了完整的初始反应动力学方程(即式(6))后,依Arrhenius定理,求得不同温度下反应速率常数后,以lnk对1/T作图,即可求得活化能Ea。温度分别为15、17.5、20、22.5、25 ℃,依式(6)计算得到反应初始时刻k的值,依式(7)作图,结果示于图6。可得活化能Ea=55.1 kJ/mol,温度升高,反应速率增加。
表2不同离子强度下溶液的阴离子组成及其反应速率
Table 2Constituent of anion under different ion strength and their reaction rate

μ/(mol·L-1)c(NO-3)/(mol·L-1)c(ClO-4)/(mol·L-1)n(ClO-4)/n(NO-3)-104r0/(mol·L-1·s-1)lg(-r0)0.400.40000.91-4.040.360.040.110.97-4.010.500.50001.04-4.000.360.140.391.06-3.970.600.60001.09-3.960.360.240.671.18-3.930.700.70001.18-3.930.360.340.941.23-3.910.800.80001.27-3.900.360.441.221.32-3.87
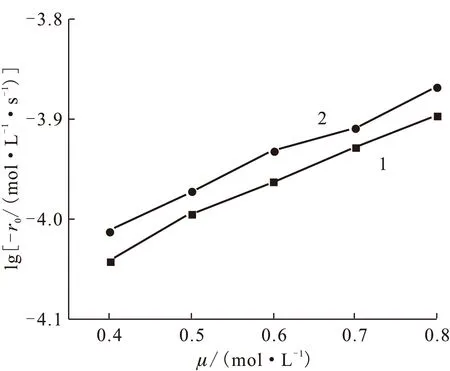
1——HNO3和NaNO3,2——HNO3和NaClO4图5 不同离子强度、不同阴离子组成的反应速率Fig.5 Reaction rate under different ion strength and different constituent

c0(HNO2)=3.0×10-3 mol/L,c0(DMHAN)=6.0×10-2 mol/L,c0(HNO3)=0.30 mol/L,μ=0.50 mol/L图6 温度对反应速率常数的影响Fig.6 Effect of temperature on the reaction rate constant
(6)
(7)
2.3化学计量的测定
2.3.1二甲基羟胺的标准曲线二甲基羟胺可以将Fe(Ⅲ)还原为Fe(Ⅱ),Fe(Ⅱ)会与邻菲罗林络合,通过吸光度值就可得出二甲基羟胺的含量。依照文献[14]所述方法,配制6.0×10-6、8.0×10-6、10×10-6、12×10-6、14×10-6、16×10-6mol/L的二甲基羟胺溶液并测量其吸光度值,得到标准曲线示于图7。由图7可知,线性良好。
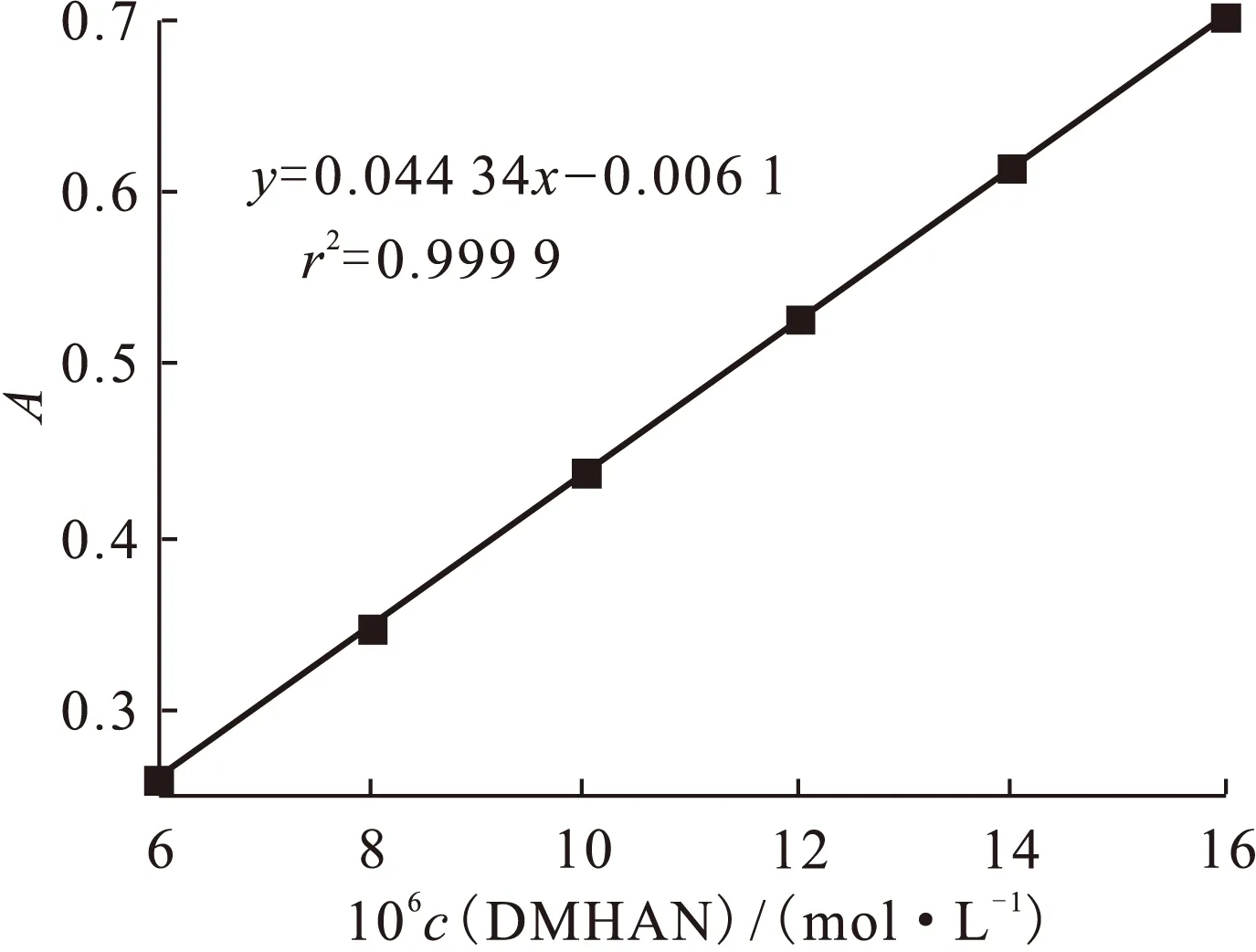
图7 二甲基羟胺的标准曲线Fig.7 Working curve of DMHAN
2.3.2肼对吸光度值的影响由于肼与亚硝酸的反应速率明显高于甲基肼与亚硝酸的反应速率,因此本工作使用肼代替文献[14]中的甲基肼,以减少误差。肼浓度对测定DMHAN的影响结果示于图8。由图8可知,0~8.0×10-4mol/L的肼不会对该方法产生影响。

c0(DMHAN)=8.7×10-6 mol/L图8 肼浓度对测定DMHAN的影响Fig.8 Effect of hydrazine concentration on the determination of DMHAN
2.3.3反应计量比在20 ℃,μ=0.50 mol/L,c0(H+)=0.30 mol/L的条件下,改变二甲基羟胺和亚硝酸的初始浓度,然后算得反应中二者消耗量之比。实验中添加的二甲基羟胺和亚硝酸的初始浓度及算得的计量比列入表3。表3数值的平均值为2.51,因此在20 ℃,μ=0.50 mol/L,c0(H+)=0.30 mol/L,c0(DMHAN)=1.0×10-2~2.0×10-2mol/L,c0(HNO2)=3.0×10-3~5.0×10-3mol/L时,HNO2和DMHAN体系表观反应计量比约为2.5∶1。
表3亚硝酸与二甲基羟胺消耗量之比
Table 3Ratio of HNO2to DMHAN
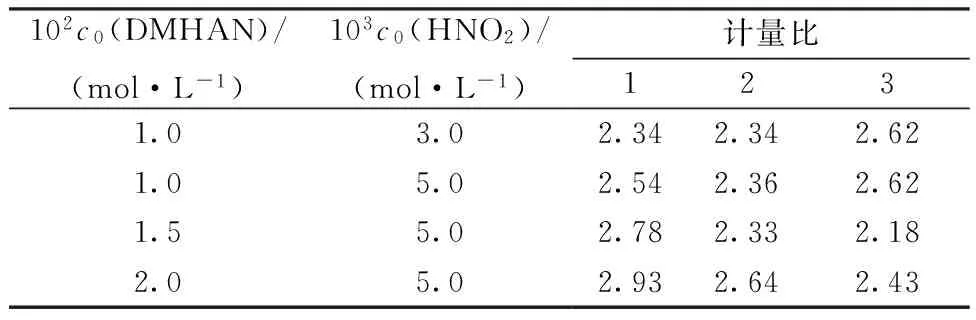
102c0(DMHAN)/(mol·L-1)103c0(HNO2)/(mol·L-1)计量比1231.03.02.342.342.621.05.02.542.362.621.55.02.782.332.182.05.02.932.642.43
2.4讨论
在稀硝酸体系下羟胺与亚硝酸的反应中,亚硝酸与羟胺的反应计量比为n(HNO2)∶n(HAN)=1∶1;而本研究结果却为n(HNO2)∶n(DMHAN)≈2.5∶1,这说明在稀硝酸体系中二甲基羟胺与亚硝酸的反应机理可能不同于羟胺与亚硝酸的反应机理。
依文献[13,15-16]的研究结果,羟胺的同系物易在反应中生成氮氧自由基,且二甲基羟胺与亚硝酸的反应产物中存在甲醇和甲醛,因此反应过程中可能发生如下反应。
(8)
(CH3)2NHONO++H2O+H+
(9)
(10)
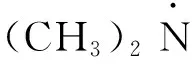
(11)
CH3NOCH2+H2O+NO
(12)
新生成的二甲基羟胺在体系内存在如下平衡:
(13)
同时,生成物CH3NOCH2可以发生如下反应:
(14)
(15)
若忽略反应式(14)与反应式(15),设反应式(11)与反应式(12)发生的比例为(1-x)∶x时(0≤x≤1),则反应式(8)—(13)可写为:
(16)
反应式(16)与x的取值无关,则反应的实际计量比n(HNO2)∶n(DMHAN)=2∶1。由于反应式(15)中又生成了羟胺的同系物单甲基羟胺,单甲基羟胺显然也会与体系中的亚硝酸反应,因此使得反应的表观计量比略有增加,达到n(HNO2)∶n(DMHAN)≈2.5∶1。当表观计量比n(HNO2)∶n(DMHAN)≈2.5∶1时,式(14)与式(15)为1∶1发生;依据文献[13]中甲醛与甲醇的比例,可以判断式(14)与式(15)为1∶5发生。
假设反应式(9)为反应的决速步,此时总反应速率r可表达为:
(17)
此时认为反应式(8)处于平衡态,有:
(18)

k3c((CH3)2NHONO+)
(19)
将式(18)和(19)代入式(17)中,可得:
(20)
因此,该反应对二甲基羟胺和亚硝酸而言,均应为1级反应。目前二甲基羟胺在硝酸、亚硝酸体系中的研究仍较为有限,其真实反应机理需进一步研究。如果式(20)推导正确,则本文结果与文献[13]存在一定差异,这可能是由实验条件不同引起。首先,式(11)与式(12)发生的比例虽然不会影响式(16)的化学计量数,但会改变体系中二甲基羟胺的浓度,实验条件不同使得式(11)与式(12)发生的比例改变,使反应速率改变,影响表观动力学;其次,中间产物CH3NOCH2存在式(14)与式(15)的竞争反应,改变实验条件也会改变式(14)与式(15)发生的比例,式(15)中生成的单甲基羟胺也会与体系中的亚硝酸反应,当表观计量比n(HNO2)∶n(DMHAN)≈2.5∶1时,式(14)与式(15)近似1∶1发生,而依据文献[13]中甲醛与甲醇的比例,可以判断式(14)与式(15)为1∶5发生。由式(16)可知,反应式(8)—(13)的实际计量比n(HNO2)∶n(DMHAN)=2∶1,但由于中间产物CH3NOCH2存在式(14)与式(15)的竞争反应,反应式(15)中又生成了可以与亚硝酸反应的单甲基羟胺,因此使得反应的表观计量比略有增加,达到n(HNO2)∶n(DMHAN)≈2.5∶1;又因式(14)与式(15)发生的比例难以定量,因此使得表3的数据出现一定的涨落,计量比数值在2.18~2.93。
3 结 论
采用分光光度法研究了稀硝酸体系下N,N-二甲基羟胺与亚硝酸的反应动力学,得到的反应动力学方程式如下:
硝酸根不参与反应。在20 ℃,c0(H+) =0.30 mol/L,c0(HNO2)=3.0×10-3mol/L,c0(DMHAN)=6.0×10-2mol/L,μ=0.50 mol/L时,k(μ)=3.09 (mol/L)-1.56·s-1,反应活化能Ea=55.1 kJ/mol。反应中HNO2与DMHAN反应的表观计量比约为2.5∶1。该结果为后处理流程中实现对亚硝酸的合理控制提供了参考数据。
[1]黄钟.后处理的历史、现状和发展前景[M].北京:核科学技术情报研究所,1999.
[2]于恩江,黄怀安,周兴权,等.硝酸羟胺在动力堆乏燃料后处理流程钚线第三循环中的应用[J].原子能科学技术,1993,27(5):451-457.
[3]Takahiro I, Nobuharu S, Makoto I, et al. Active test of purification facility at rokkasho reprocessing plant[C]∥Proceedings of Global 2009, Paris, France, Paper 9214: 206-213.
[4]Gowland R J, Stedman G. Kinetic and product studies on the deccomposition of hydroxylamine in nitric acid[J]. Inorg Nucl Chem, 1981, 43: 2859-2862.
[5]Bennett M R, Brown G M, Maya L, et al. Oxidation of hydraxylamine by nitrous and nitric acids[J]. Inorg Chem, 1982, 21(6): 2461-2468.
[6]陈辉.N,N-二甲基羟胺、甲基肼辐解行为和机理研究[D].北京:中国原子能科学研究院, 2010.
[7]王锦花.羟胺衍生物辐解及其氧化还原反应的研究[D].上海:上海大学, 2005.
[8]Koltunov V S, Baranov S M. Reaction kinetics of Np and Pu ions with hydroxylamine derivatives[J]. Radiokhimiya, 1993, 35(4): 54-62; 63-71; 85-91.
[9]何辉.N,N-二甲基羟胺在铀钚分离中的应用和计算机程序的开发[D].北京:中国原子能科学研究院,2001.
[10]张安运,厉凯,何辉,等.N,N-二甲基羟基胺与V(Ⅴ)氧化还原反应动力学及机理研究[J].应用化学,2001,18:180-183.
[11]李小该,何辉,叶国安,等.二甲基羟胺还原Np(Ⅵ)的反应动力学[J].核化学与放射化学,2010,32(5):262-267.
[12]张虎,叶国安,李丽,等.电化学调价制备2AFⅠ:二甲基羟胺和甲基肼的电解氧化[J].核化学与放射化学,2010,32(2):76-83.
[13]李高亮,何辉.N,N-二甲基羟胺与HNO2反应动力学[J].应用化学,2010,27(8):916-923.
[14]李传博,刘金平,晏太红,等.PUREX流程中二甲基羟胺与甲基肼的分析[J].核化学与放射化学,2011,33(5):268-273.
[15]张安运.N,N-二乙基羟胺与Np(Ⅵ)和Pu(Ⅳ)氧化还原反应动力学和反应机理的研究[D].北京:中国原子能科学研究院,1998.
[16]李小该.IPOR流程1B槽中镎的走向行为研究[D].北京:中国原子能科学研究院,2009.
Reaction Kinetics BetweenN,N-Dimethylhydroxylammonium Ion and Nitrous Acid in Nitric Acid
ZHU Dong-dong, LI Chuan-bo, ZHENG Wei-fang*, YAN Tai-hong,XIE Shu-bao, ZUO Chen, SHI Si-wei
China Institute of Atom Energy, P. O. Box 275(93), Beijing 102413, China
The reaction kinetics ofN,N-dimethylhydroxylammonium ion(DMHAN) with nitrous acid were studied by spectrophotometerly in 0.1-0.4 mol/L nitric acid media. Influences of temperature, ion strength, nitric acid concentration, nitrous acid concentration and DMHAN concentration were investigated. The reaction rate equation is obtained as:
N,N-dimethylhydroxylammonium; nitric acid; nitrous acid; reaction kinetics; stoichiometric ratio
2015-04-08;
2015-10-26
*通信联系人:郑卫芳(1970—),男,江苏金坛人,博士,研究员,核燃料循环与材料专业,E-mail: wfazh@ciae.ac.cn
-dc(HNO2)/dt=kc1.26(HNO2)c0.85(DMHAN)c0.45(H+)
O643.12
A
0253-9950(2016)05-0267-07
10.7538/hhx.2016.YX.2015028
-dc(HNO2)/dt=kc1.26(HNO2)c0.85(DMHAN)c0.45(H+)
在20 ℃,离子强度为0.50 mol/L时,k=3.09 (mol/L)-1.56·s-1,Ea≈55.1 kJ/mol;反应中,亚硝酸与二甲基羟胺的表观反应计量比约为2.5∶1。
The reaction rate constant and the reaction activation energy are 3.09 (mol/L)-1.56·s-1and 55.1 kJ/mol at 20 ℃,μ=0.50 mol/L, respectively. The stoichiometric ratio of nitrous acid to DMHAN is observed by 2.5∶1.
