动脉平滑肌细胞的钙池操纵钙通道对细胞自噬的调节
2016-11-08齐元麟陈富华任正肖张明芳
齐元麟,陈富华,任正肖,王 情,王 丹,张明芳
(福建医科大学基础医学院1.生物化学与分子生物学系,2.生理学与病理生理学系,心血管科学研究室,福建 福州 350108)
动脉平滑肌细胞的钙池操纵钙通道对细胞自噬的调节
齐元麟1,陈富华2,任正肖2,王情2,王丹2,张明芳2
(福建医科大学基础医学院1.生物化学与分子生物学系,2.生理学与病理生理学系,心血管科学研究室,福建 福州350108)
目的探讨大鼠动脉平滑肌细胞A7R5上钙池操纵性钙通道(store-operated calcium channel, SOCC)对细胞自噬的影响。方法在293T细胞中包装含有STIM1、Orai1基因的慢病毒,将获得的慢病毒LV-STIM1、LV-Orai1感染大鼠A7R5细胞,Western blot检测感染前后STIM1、Orai1蛋白表达及细胞自噬调节蛋白Beclin-1的表达。慢病毒感染A7R5后饥饿处理6 h或雷帕霉素处理24 h,Western blot检测处理后各组自噬相关蛋白LC3的蛋白表达量。结果重组载体pLV-STIM1、pLV-Orai1经双酶切鉴定正确。在293T成功包装慢病毒LV-STIM1、LV-Orai1。病毒感染A7R5后,与对照组相比,STIM1、Orai1蛋白表达量分别上调96%和163%,而自噬调节蛋白Beclin 1下调64%。饥饿或雷帕霉素处理可明显增加细胞自噬水平,体现为自噬标志蛋白LC3-Ⅱ含量增加,而慢病毒感染STIM1、Orai1可明显抑制饥饿或雷帕霉素诱导的细胞自噬。结论在大鼠动脉平滑肌A7R5细胞过表达钙池操纵钙通道分子STIM1和Orai1可使细胞自噬水平降低。这一分子机制可能与肺动脉高压发病相关。
动脉平滑肌细胞;钙池操纵钙通道;细胞自噬;基质相互作用分子1;钙释放激活钙通道蛋白1;肺动脉高压
在肺动脉高压(pulmonary arterial hypertension, PAH)发病过程中,各种离子通道,包括钙离子通道蛋白发挥着重要作用[1-2]。我们前期发现,大鼠PAH模型上存在着钙池操纵钙通道(store-operated calcium channel, SOCC)组成分子基质相互作用分子1(stromal interaction molecule 1, STIM1)和钙释放激活钙通道蛋白1(calcium release-activated calcium channel protein 1, Orai1)的高表达,并发现STIM1过表达可激活细胞的Akt-mTOR信号通路,促进肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)的增殖[3],可能与PAH发病有关。细胞自噬(autophagy)是一种程序化的细胞内降解过程,对细胞内环境的稳定及细胞生命活动的顺利进行十分重要[4]。目前自噬与PAH关系的研究较少且存在矛盾,有认为自噬可促进PAH发展[5],也有认为自噬可抑制PAH发生[6]。钙信号与细胞自噬间存在复杂的互动,两者又都参与了PAH的发病,但它们在动脉平滑肌细胞上的关系尚未见报道。本研究首先在动脉平滑肌细胞A7R5内过表达STIM1或(和)Orai1两种蛋白,建立SOCC高表达的细胞模型;随后检测这些细胞的自噬调节蛋白Beclin-1的表达情况,探讨SOCC能否调节细胞自噬;随后观察SOCC组成分子过表达对饥饿或雷帕霉素诱导的细胞自噬的影响;拟在细胞水平探讨SOCC与自噬的关系,为PAH防治提供新思路和靶点。
1 材料与方法
1.1材料A7R5细胞由福建医科大学生物化学与分子生物学实验室馈赠,人肾上皮细胞系293T由福建医科大学转化医学院馈赠,两种细胞在本实验室-80℃冰箱保存。超级感受态菌、pHelper (pMDLg,pRSV-Rev和pVSV-G)质粒、表达载体pLV-STIM1、pLV-Orai1和对照质粒pLV-EGFP由福建医科大学生物化学与分子生物学实验室惠赠。
胎牛血清,Hyclone公司;Earle平衡盐溶液(Earle’s balanced salt solution, EBSS)、DMEM、F-12培养基、青链霉素,Invitrogen公司;质粒抽提试剂盒,Qiagen公司;雷帕霉素、琼脂糖、牛血清白蛋白、HEPES、D-葡萄糖、抑肽酶、正钒酸钠,Sigma公司;X-tremeGENE HP DNA转染试剂,罗氏公司;兔抗STIM1、Orai1抗体,Alomone Labs公司;兔抗β-actin、LC3、Beclin 1抗体及第二抗体,Cell Signaling公司;DL10000 DNA marker、BCA蛋白定量试剂盒、RIPA裂解液、PMSF、抗体稀释液、ECL发光试剂盒,碧云天生物技术研究所;其余试剂均为进口或国产分析纯。
1.2方法
1.2.1pLV-EGFP、pLV-STIM1和pLV-Orai1载体的酶切鉴定3种质粒转化入感受态大肠杆菌Top10,涂板,挑取单克隆,大量扩增培养后,采用Qiagen质粒中量提取试剂盒抽提质粒。质粒经Sma I和BamH I限制酶双酶切后,于1%琼脂糖电泳分离,EB染色,紫外灯下观察。
1.2.2293T细胞的培养和病毒的包装在293T细胞中利用四质粒系统包装慢病毒颗粒。293T细胞常规培养在含10%胎牛血清的DMEM培养基中。包装前1 d将293T细胞分到6孔板中,每孔细胞数约为106个,d 2细胞融合度可达到80%~90%,取出培养板,换上新鲜培养液(不含双抗,每孔2 mL)。慢病毒载体质粒pLV-EGFP、pLV-STIM1和pLV-Orai1分别和3种包装质粒pMDLg、pVSV-G、pRSV-Rev混合后。采用X-tremeGENE HP DNA转染试剂将质粒转入293T细胞,24 h后通过荧光显微镜观察pLV-EGFP组的荧光量来判断转染效率。若转染效率达到>95%收获病毒上清液。5 000 r·min-1离心5 min去除细胞碎片和死细胞,将离心后的上清液分装至EP管中。
1.2.3动脉平滑肌细胞A7R5的培养、病毒感染A7R5细胞于F-12培养基(含10%胎牛血清和1%青链霉素)、在5% CO2和37℃下正常培养。细胞按合适的比例接种6孔板中,每孔加培养液2 mL,培养约24 h,使细胞融合度达到50%~60%。感染前将细胞换液,将病毒液和完全培养液1 ∶1混合后总体积为2 mL;在2 mL的病毒混合液中加入2 μL polybrene(终浓度10 mg·L-1),混匀后缓慢滴入6孔板中,轻轻摇匀后将6孔板重新放到37℃、5% CO2中培养,24 h后更换细胞液为完全培养基。48 h后以pLV-EGFP感染细胞的感染效率和感染状态为基准。若荧光率大于80%,可用于提取蛋白以及后续的生物功能试验。如果感染效率低于80%则需要重新进行感染实验。
1.2.4STIM1和/或Orai1慢病毒感染的鉴定及对细胞自噬调节蛋白表达的影响病毒感染72 h后,收集各组细胞(未感染组、感染EGFP病毒组、感染STIM1病毒组、感染Orai1病毒组、按1 ∶1比例同时感染STIM1和Orai1病毒组),PBS洗2次,加入RIPA细胞裂解液(含1 mmol·L-1PMSF、1 mmol·L-1正钒酸钠、10 mg·L-1抑肽酶)提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blot实验。10% SDS-PAGE电泳后行转膜印迹,分别用Actin、STIM1、Orai1、Beclin 1第一抗体与膜上的抗原结合,然后用HRP偶联的二抗与其反应,用ECL化学发光试剂检测,经压片曝光后,显影和定影。采用Phoretix 1D V2003.03图象分析软件测定和比较各组蛋白表达情况。
1.2.5STIM1和/或Orai1慢病毒感染对饥饿和雷帕霉素诱导的细胞自噬的影响细胞分为5组:未感染组、感染EGFP病毒组、感染STIM1病毒组、感染Orai1病毒组、按1 ∶1比例同时感染STIM1和Orai1病毒组,每组各做4块板。病毒感染72 h后,换液。上述5组的每4块板按1块加普通培养基、1块加EBSS处理6 h、1块加DMSO处理24 h、一块加雷帕霉素(终浓度100 nmol·L-1)处理24 h的方案,进行实验处理。结束后去除培养液,各组提取蛋白行Western blot,分析LC3的表达。

2 结果
2.1慢病毒载体的抽提和鉴定用限制性内切酶Sma I、BamH I对pLV-EGFP、pLV-STIM1和pLV-Orai1进行双酶切,pLV-STIM1在2 000、8 000 bp附近能见到明显的条带。因为pLV-Orai1的Orai1基因中含有Sma I的酶切位点,所以在此双酶切系统中,pLV-Orai1会出现3条带,分别位于200 bp、700 bp、8 000 bp附近(Fig 1)。

Fig 1 Characterstics of lentiviral STIM1 and Orai1 overexpressing vector
Vectors were digested by Sma Ⅰ and BamH Ⅰ, and then separated in 1% agarose gel.1: DL 10 000 Marker, 2: pLV-EGFP, 3. pLV-STIM1, 4. pLV-Orai1
2.2慢病毒的包装和感染利用四质粒系统在293T细胞中包装慢病毒颗粒。24 h后倒置荧光显微镜下观察发现此次转染效率良好,达到了95%(Fig 2)。用带有pLV-STIM1、pLV-Orai1质粒的病毒以及携带荧光标签蛋白pLV-EGFP质粒的病毒分别感染A7R5,同时将pLV-STIM1和pLV-Orai1质粒的病毒1 ∶1混合后感染A7R5,72 h后通过观察pLV-EGFP感染细胞的荧光蛋白表达情况来判断感染效率。在倒置荧光显微镜下观察发现此次感染率良好,达到了约为90%(Fig 3)。
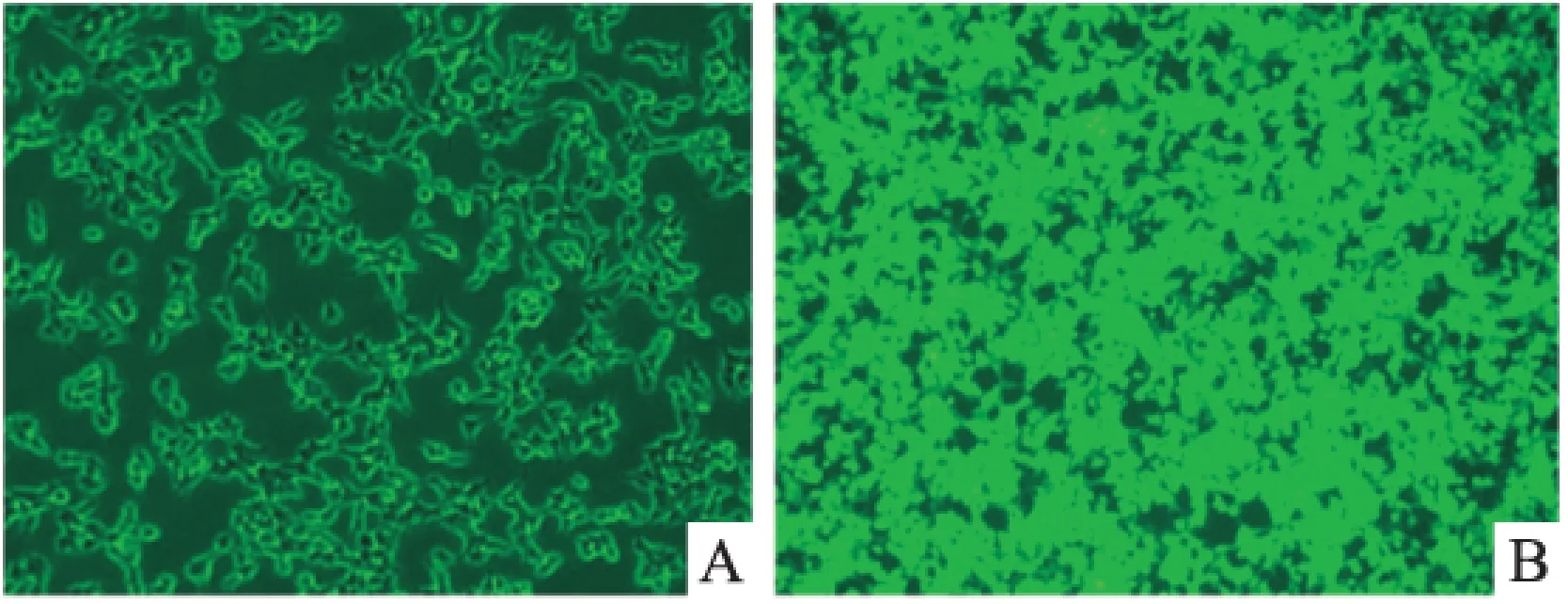
Fig 2 Lentivirus package in 293T cells with pLV-EGFP vector
A:Controlled 293T cells; B: 293T cells transfection of pLV-EGFP plasmid
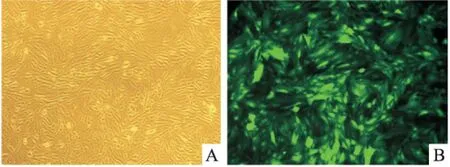
Fig 3 Infection of LV-EGFP lentivirus to rat arterial smooth muscle cells A7R5
A7R5 cells were infected by LV-EGFP lentivirus and then observed under (A) white light, (B) fluorescence.
2.3STIM1和Orai1在A7R5中的过表达及对自噬调节蛋白Beclin 1的影响分别提取感染前后A7R5细胞总蛋白,检测各组STIM1和Orai1蛋白的表达量,结果显示感染组中的STIM1和Orai1表达相比于未感染组(Control)和对照病毒感染组(EGFP)均明显增高,差异具有统计学意义(Fig 4)。随后我们检测了过表达STIM1和Orai1对自噬调节蛋白Beclin 1的影响,结果显示STIM1和Orai1均可明显下调Beclin 1的表达(Fig 5)。
2.4STIM1和Orai1过表达对饥饿及雷帕霉素诱导的A7R5细胞自噬的影响为进一步探讨SOCC组成分子对细胞自噬水平的调节,我们测定了过表达STIM1和Orai1对饥饿(EBSS)和雷帕霉素诱导的A7R5细胞LC3蛋白的影响。结果显示,EBSS(Fig 6)和雷帕霉素(Fig 7)处理A7R5,均可诱导细胞自噬,表现为LC3-Ⅱ含量的明显上升。但过表达STIM1和Orai1的细胞,其自噬标志分子LC3-Ⅱ的水平远低于正常组药物处理后,说明STIM1和Orai1可以抑制EBSS或雷帕霉素诱导的细胞自噬。

Fig 4 Overexpression of STIM1 and/or Orai1 in A7R5 arterial smooth muscle cells
A7R5 cells were infected by lentivirus containing control(EGFP), STIM1 and Orai1 genes. After 72 hours, cells were lysed and the supernatants were collected for Western-blot.(A) Lane 1: A7R5 cells, 2: A7R5 cells infected by LV-EGFP lentivirus, 3: LV-STIM1, 4: LV-Orai1, 5: Infected with both LV-STIM1 and pLV-Orai1(1:1). (B, C)*P<0.05vscontrol and EGFP groups
3 讨论
动脉平滑肌细胞的离子通道与其生理学功能密切相关[7-8],动脉平滑肌细胞膜上有3种钙通道:受体操纵性钙通道(ROCC)、L-型电压依赖型钙通道(L-VDCC)和钙池操纵性钙通道(SOCC),它们共同调节动脉平滑肌细胞内钙离子稳态,近来,SOCC受到越来越多研究者的关注[9-10]。目前认为,SOCC的分子基础是两种蛋白质,即定位在内质网的钙感受器STIM1(基质相互作用分子1)和定位在细胞膜的通道蛋白Orai1(钙释放激活钙通道蛋白1),当内质网钙库耗竭时,STIM1聚集在一起并与定位于细胞膜的Orai1结合,促进SOCC通道的开放和钙离子的内流。

Fig 5 Detection of Beclin 1 in A7R5 arterial smooth muscle cells
A7R5 cells were infected by lentivirus containing control(EGFP), STIM1 and Orai1 genes. Cell lysates were collected for detection of Beclin 1 expressions.(A) Lane 1: A7R5 cells, 2: A7R5 cells infected by LV-EGFP lentivirus, 3: LV-STIM1, 4: LV-Orai1, 5: Infected with both LV-STIM1 and pLV-Orai1(1:1). (B)*P<0.05vscontrol and EGFP groups
本研究团队一直关注PAH发病中肺动脉平滑肌SOCC功能研究[3,11-12],前期工作发现,在野百合碱(monocrotaline, MCT)诱导的大鼠PAH模型上,大鼠肺动脉组织的STIM1 mRNA和蛋白质表达水平均明显高于对照大鼠,证实PAH模型上存在STIM1的表达上调。由于PAH发病与PASMCs的过度增殖有关,我们在体外培养的动脉平滑肌细胞A7R5上建立STIM1瞬时高表达模型,观察其对细胞增殖的影响。结果显示,过表达STIM1可促进A7R5的增殖,说明PAH大鼠肺动脉组织STIM1高表达可促进动脉平滑肌细胞增殖,可能对PAH起促进作用[3]。
自噬(autophagy)是进化上保守的细胞内降解机制。在自噬过程中,双层膜的自噬体(autophagosomes)围绕着衰老细胞器或蛋白质形成,随后与溶酶体融合,使内容物降解。通过降解这些物质而再生小分子代谢物,自噬协助维持细胞的能量平衡和物质更新。正常的自噬对细胞内环境的稳定十分重要,但在病理的状态下,自噬过高或自噬不足都会导致细胞正常生理功能发生紊乱,严重时导致细胞死亡[13]。目前自噬与PAH关系的研究较少。Long等[5]发现在PAH发展过程中肺组织自噬水平升高,自噬标志蛋白LC3B-II表达增加,自噬抑制剂氯喹可抑制MCT诱导的PAH,降低自噬水平,促进PASMCs凋亡。说明自噬可促进PAH发病。相反地,Lee等[6]虽然也发现PAH病人和PAH模型动物中存在自噬水平增加,但基因敲除LC3B却使小鼠对低氧诱发的PAH更加敏感,证明PAH发病中上调的自噬是机体的一种保护机制,自噬可抑制PAH发病。
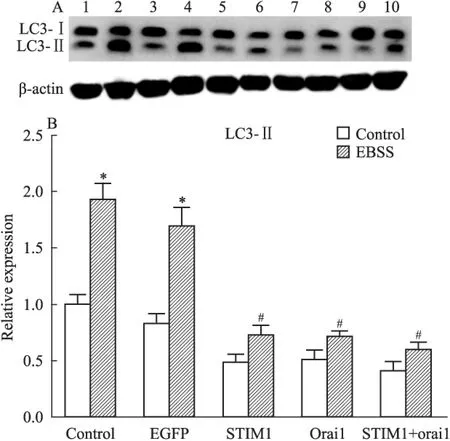
Fig 6 Starvation-induced autophagy in A7R5 arterial smooth muscle cells
A7R5 cells were grouped and infected by various lentivirus. After 72 hours, cells were grouped and half of groups treated by Earle′s buffered saline solution(EBSS) for 6 hours. Cell lysates were collected for detection of LC3 expressions. (A) Lane 1: A7R5, 2: A7R5 treated by EBSS, 3: Infected with LV-EGFP, 4: LV-EGFP+EBSS, 5: LV-STIM1, 6: LV-STIM1+EBSS, 7: LV-Orai1, 8: LV-Orai1+EBSS, 9: Infected with both LV-STIM1 and LV-Orai1(1 ∶1), 10: LV-STIM1+LV-Orai1+EBSS. (B)*P<0.05vscontrol and EGFP groups;#P<0.05vscontrol or EGFP groups with EBSS treatments.
为探讨动脉平滑肌细胞上SOCC对细胞自噬的调节,探讨它们在PAH发病中的可能的相互作用,本研究包装了STIM1和Orai1过表达的慢病毒并感染A7R5细胞。我们采用的第三代自身失活型慢病毒载体,相比于前两代,第三代剔除了3′LTR内的激活原件,排除了其激活下游基因的能力。3个包装必需蛋白分别放置在不同的质粒上(pMDLg、pVSV-G和pRSV-Rev),大大降低了重组病毒的几率,具有较高的安全性[14]。考虑到慢病毒感染平滑肌细胞效率不高,我们在感染A7R5时,加入辅助感染试剂polybrene,有效提高了感染效率。我们采用Western blot检测感染后细胞中目的基因STIM1和Orai1的表达量,发现两者表达量都明显上调,说明SOCC过表达模型建立成功。
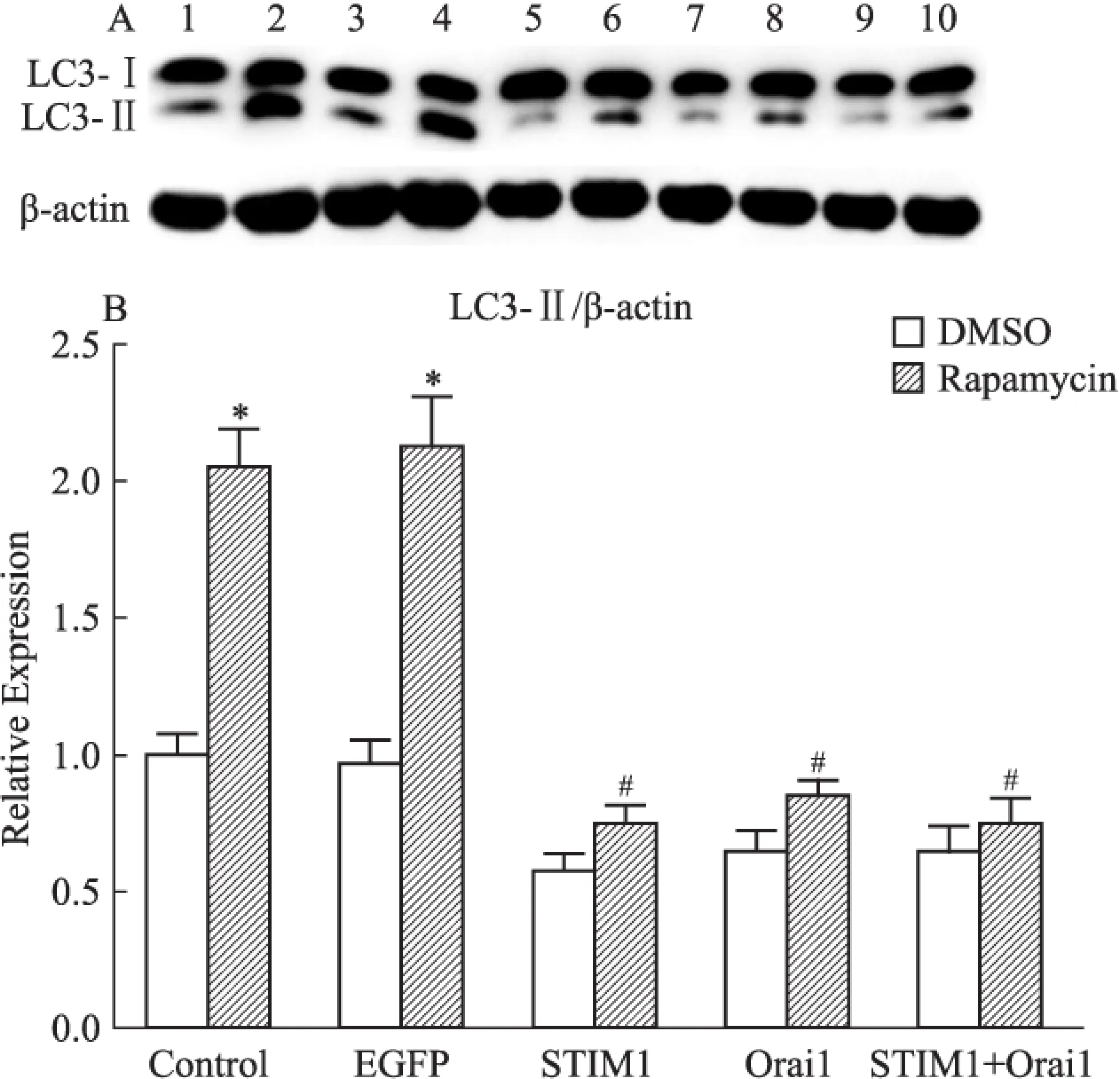
Fig 7 Rapamycin-induced autophagy in A7R5 arterial smooth muscle cells
A7R5 cells were grouped and infected by various lentivirus. After 72 hours, cells were grouped and half of groups treated by 100 nmol·L-1rapamycin for 24 hours. Cell lysates were collected for detection of LC3 expressions.(A) Lane 1: A7R5, 2: A7R5 treated by rapamycin, 3: Infected with LV-EGFP, 4: LV-EGFP+rapamycin, 5: LV-STIM1, 6: LV-STIM1+rapamycin, 7: LV-Orai1, 8: LV-Orai1+rapamycin, 9: Infected with both LV-STIM1 and LV-Orai1(1 ∶1), 10: LV-STIM1+LV-Orai1 + rapamycin. (B)*P<0.05vscontrol and EGFP groups;#P<0.05vscontrol or EGFP groups with rapamycin treatments.
我们随后检测了STIM1和(或)Orai1过表达对A7R5细胞自噬的影响,结果显示,STIM1和(或)Orai1过表达可抑制关键的自噬调节基因Beclin 1。Beclin1是在哺乳动物中第一个被发现的具有特异性调节自噬的基因,其表达强度与自噬水平呈正相关[15],对自噬的诱导至关重要,是其他自噬蛋白在自噬泡上定位的关键因子,调节细胞自噬体的形成与成熟。我们随后观察了STIM1和(或)Orai1过表达对饥饿诱导的细胞自噬的影响,发现两者的过表达均可抑制EBSS诱导的自噬标志蛋白LC3-Ⅱ上调。这些结果说明SOCC过表达可抑制细胞自噬。
细胞自噬也被称为第Ⅱ型的程序性细胞死亡[15],在肿瘤发病早期,细胞自噬可促使转化细胞的死亡,从而抑制肿瘤发生[16]。肺动脉高压的发病与肿瘤有相似之处,同样表现为细胞增殖过度和死亡不足,我们认为,STIM1和Orai1抑制细胞自噬,可能反馈性增加了肺动脉平滑肌细胞的增殖,从而促进了细胞的过度增殖和肺动脉高压的形成。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)是细胞自噬的重要调节因子,其中mTOR是自噬的抑制剂[16],而AMPK则可激活细胞自噬[17]。我们在前期研究中观察了STIM1对Akt/mTOR信号途径的调节,我们发现[3],在A7R5细胞中过表达STIM1可增加Akt和mTOR磷酸化水平,以及mTOR的直接底物p70S6K和4E-BP1的磷酸化,证明了STIM1可上调Akt/mTOR信号。在本研究中,我们用mTOR的抑制剂雷帕霉素处理A7R5,发现其可诱导细胞自噬,而STIM1和(或)Orai1过表达可抑制雷帕霉素诱导的细胞自噬,说明SOCC对细胞自噬的抑制,可能与SOCC上调了mTOR信号有关。
(致谢:本文在福建医科大学基础医学院心血管研究室完成,特此致谢!)
[1]Collins H E, Zhu-Mauldin X, Marchase R B, Chatham J C. STIM1/Orai1-mediated SOCE: current perspectives and potential roles in cardiac function and pathology[J].AmJPhysiolHeartCircPhysiol,2013,305(4): H446-58.
[2]Morrell N W, Adnot S, Archer S L, et al. Cellular and molecular basis of pulmonary arterial hypertension[J].JAmCollCardiol,2009,54(1): S20-31.
[3]张明芳, 齐元麟, 王丹, 等. 动脉平滑肌细胞 STIM1过表达上调Akt/mTOR 通路并促进细胞增殖[J]. 中国药理学通报, 2016, (1): 37-42.
[3]Zhang M F, Qi Y L, Wang D, et al. STIM1 promotes arterial smooth muscle cells proliferation by regulating Akt/mTOR pathway[J].ChinPharmacolBull, 2016,(1): 37-42.
[4]Ryter S W, Choi A M. Autophagy in lung disease pathogenesis and therapeutics[J].RedoxBiol, 2015, 4: 215-25.
[5]Long L, Yang X, Southwood M, et al.Chloroquine prevents progression of experimental pulmonary hypertension via inhibition of autophagy and lysosomal bone morphogenetic protein type Ⅱ receptor degradation[J].CircRes,2013,112: 1159-70.
[6]Lee S J, Smith A, Guo L, et al. Autophagic protein LC3B confers resistance against hypoxia-induced pulmonary hypertension[J].AmJRespirCritCareMed,2011,183:649-58.
[7]张传林,王蕊,马克涛,等.大黄素增强SD大鼠脑基底动脉平滑肌细胞BKCa电流[J].中国药理学通报,2013,29(9):1244-7.
[7]Zhang C L,Wang R, Ma K T, et al.Enhanced effect of emodin on BKCa channel mediated outward currents of basilar artery smooth muscle cells in SD rat[J].ChinPharmacolBull,2013,29(9):1244-7.
[8]王洋,马克涛,张传林,等.奎尼丁增强大鼠软脑膜动脉平滑肌细胞BKCa通道介导的外向电流[J].中国药理学通报,2014,30(2):203-6.
[8]Wang Y, Ma K T, Zhang C L, et al.Quinidine enhances BKCa channel-mediated outward current in pial artery smooth muscle cell of SD rat[J].ChinPharmacolBull,2014,30(2):203-6.
[9]Parrau D, Ebensperger G, Herrera E A, et al. Store-operated channels in the pulmonary circulation of high-and low-altitude neonatal lambs[J].AmJPhysiolLungCellMolPhysiol, 2013, 304(8): L540-8.
[10]Hooper R, Samakai E, Kedra J, Soboloff J. Multifaceted roles of STIM proteins[J].PflugersArchiv,2013,465(10): 1383-96.
[11]穆云萍, 焦海霞, 朱壮丽, 等. 慢性低氧大鼠TRPC1表达与肺动脉收缩变化时间曲线关系[J]. 中国药理学通报, 2014,30(12): 1667-71.
[11]Mu Y P, Jiao H X, Zhu Z L, et al. Relationship of time-course curve between the expression of TRPC1 and vascular tone of pulmonary arteries in chronic hypoxia pulmonary hypertension rats[J].ChinPharmacolBull, 2014, 30(12): 1667-71.
[12]胡莹, 焦海霞, 王瑞幸, 等. 三七皂苷R1对肺高压大鼠模型肺动脉的舒张作用[J]. 中国药理学通报, 2013, 29(11): 1572-6.
[12]Hu Y, Jiao H X, Wang R X, et al. Vasodilation of notoginsenoside R1 on pulmonary arteries of pulmonary hypertensive rats[J].ChinPharmacolBull, 2013, 29(11): 1572-6.
[13]Choi A M, Ryter S W, Levine B. Autophagy in human health and disease[J].NEnglJMed, 2013, 368(7): 651-62.
[14]Dull T, Zufferey R, Kelly M, et al. A third-generation lentivirus vector with a conditional packaging system[J].JVirol,1998,72(11):8463-71.
[15]Klionsky D J, Abdelmohsen K, Abe A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy(3rd edition)[J].Autophagy,2016,12(1): 1-222.
[16]Dunlop E A, Tee A R. mTOR and autophagy: a dynamic relationship governed by nutrients and energy[J].SeminCellDevBiol,2014,36:121-9.
[17]Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J].NatCellBiol,2011,13(2):132-41.
Regulation of autophagy by store-operated calcium channel in arterial smooth muscle cells
QI Yuan-lin1, CHEN Fu-hua2, REN Zheng-xiao2, WANG Qing2, WANG Dan2, ZHANG Ming-fang2
(1.DeptofBiochemistryandMolecularBiology,SchoolofBasicMedicalSciences,FujianMedicalUniversity,Fuzhou350108,China;2.DeptofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,FujianMedicalUniversity,Fuzhou350108,China)
AimTo investigate the effect of store-operated calcium channel(SOCC) on autophagy in rat arterial smooth muscle cells A7R5.MethodsLentiviruses containing STIM1 or Orai1 gene were packaged in 293T cells and then were used to infect rat arterial smooth muscle cells A7R5. The expression levels of STIM1, Orai1 and Beclin 1, a critical autophagy-regulating protein, of lentivirus-infected A7R5 cells, were detected by Western-blot.Autophagy in lentivirus-infected A7R5 cells was induced by starvation or rapamycin, an inhibitor of mammalian target of rapamycin(mTOR). Autophagy marker LC3 of these cells was detected by Western-blot.ResultsThe constructions of vector pLV-STIM1 and pLV-Orai1 were confirmed by restriction enzymes digestion analysis. Compared with the control group, expressions of STIM1 or Orai1 protein was significantly increased after lentivirusLV-STIM1 and LV-Orai1infection, whereas the expressions of autophagy related protein Beclin-1 were down-regulated. Starvation or rapamycin stimulated A7R5 autophagy but overexpression of STIM1 or Orai1 significantly inhibited starvation or rapamycin induced autophagy.ConclusionOverexpression of store-operated calcium channel components STIM1 and/or Orai1 in rat arterial smooth muscle cells A7R5 inhibit autophagy.This mechanism might contribute to the development of pulmonary arterial hypertension.
arterial smooth muscle cells; store-operated calcium channel; autophagy; stromal interaction molecule 1(STIM1); calcium release-activated calcium channel protein 1(Orai1); pulmonary arterial hypertension
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.034.html
2016-06-10,
2016-08-20
福建省自然科学基金资助项目(No 2013J01373, 2015J01611), 福建省教育厅科技重点资助项目(No JA10130)
齐元麟(1975-), 男, 博士, 副研究员, 研究方向: 细胞自噬的分子机制, E-mail: ylqi@fjmu.edu.cn;
陈富华(1989-), 男, 硕士生, 研究方向: 心血管病理生理学, 共同第一作者, E-mail: 805569335@qq.com;
10.3969/j.issn.1001-1978.2016.10.017
A
1001-1978(2016)10-1416-06
R-332;R322.121;R322.74;R329.24;R348.1;R544;R977.6
张明芳(1973-), 女, 博士, 副教授, 研究方向: 心血管病理生理学, 通讯作者,E-mail: mfzhang@fjmu.edu.cn
