β淀粉样蛋白跨血脑屏障转运机制研究进展
2016-11-08张海静赵春晖张文生
张海静,赵春晖,张文生
(1.北京师范大学中药资源保护与利用北京市重点实验室,北京 100088;2.教育部天然药物工程研究中心,北京 100088;3.北京师范大学资源学院,北京 100875)
β淀粉样蛋白跨血脑屏障转运机制研究进展
张海静1,2,3,赵春晖1,2,3,张文生1,2,3
(1.北京师范大学中药资源保护与利用北京市重点实验室,北京100088;2.教育部天然药物工程研究中心,北京100088;3.北京师范大学资源学院,北京100875)
β淀粉样蛋白;阿尔茨海默病;血脑屏障;转运;晚期糖基化终末产物受体;低密度脂蛋白受体相关蛋白
β淀粉样蛋白(amyloid beta-peptides, Aβ)是神经系统退行性疾病——阿尔茨海默病(Alzheimer’s disease, AD)发病过程中的核心病理。在β淀粉样蛋白级联假说中,Aβ脑内的积聚引发一系列分子级联作用,发生神经炎症损伤并对周围神经元和突触产生毒性作用,导致记忆损伤,造成AD发生发展。
正常情况下,体内Aβ的产生和清除处于动态平衡中,当Aβ的代谢过程发生紊乱打破这种平衡时,会引起Aβ累积并促使其异常聚集。脑内对于Aβ的清除机制主要有Aβ降解酶降解、细胞吞噬和血脑屏障(blood-brain barrier, BBB)转运出脑,其中BBB对Aβ在脑内的积累发挥关键作用,因此,本文就近年来对Aβ跨BBB转运的机制进行了综述。
1 AD与Aβ
Aβ在大脑皮层和海马区神经元细胞外沉积可形成老年斑(senile plaques,SP),是AD患者的主要组织病理特征。体内Aβ是由单次跨膜蛋白——淀粉样前体蛋白(amyloid precursor protein, APP)经β-分泌酶1(beta-site amyloid precursor protein cleaving enzyme 1, BACE1)和γ-分泌酶(γ-secretase)依次切割而成[1],可由全身组织的多种细胞产生,并分泌到细胞外,在血液、脑脊液与脑间质液之间循环[2],其单体会在体内或体外条件下自发聚集形成寡聚体或多聚体,从而增强其对神经元的毒性。Aβ在AD中主要表现为神经毒性作用,可能引发氧化应激、线粒体及突触功能紊乱、活化胶质细胞,进而引发炎症反应、促使Tau蛋白磷酸化形成神经纤维缠结、诱导细胞凋亡等。
2 血脑屏障结构与功能
血脑屏障是脑组织与血液之间将中枢神经系统与外周进行隔离的物理性屏障,具有限制分子跨血脑屏障转运,以维持中枢神经系统稳态的重要作用。其构成包括脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)、周皮细胞(pericytes)、星形胶质细胞的终足(astrocyte end-foot)及基底膜[3](Fig 1)(Basal membrane)。脑微血管内皮细胞是构成BBB的基础,其结构及功能上与其他血管内皮细胞具有明显地区别,包括更多的线粒体、丰富的酶系统、无窗孔结构、很少的胞饮小泡及缺乏收缩蛋白,细胞间的紧密连接(tight junction)使脑微血管内皮细胞形成连续的单层细胞物理屏障,能抑制跨细胞的自由扩散,并调节离子及复合物在脑血流与脑组织间的流动。
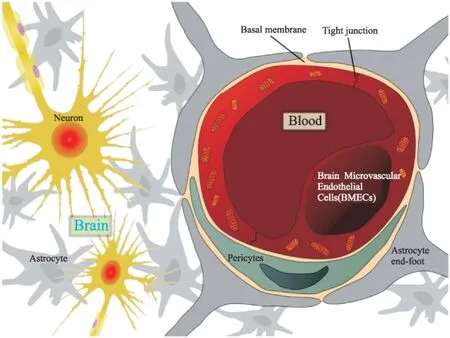
Fig 1 Structure of neurovascular unit and blood-brain barrier
正常生理状况下,脑间质液中Aβ浓度是血液中的6倍,但体液中Aβ总量是脑中(脑脊液与脑间质液)的十倍,因此BBB对Aβ在血液与脑组织中的分布具有重要作用。Aβ穿越BBB的主要方式为BMECs上受体介导或载体介导的转运,是受体介导的转胞吞(transcytosis)过程,包括Aβ的识别、内化和转胞吞。其中转胞吞是一个小窝(caveolae)依赖的过程。在BBB的腔内侧和腔外侧存在多种不同的Aβ转运受体,如LRP-1、P-gp、RAGE等,它们分别介导Aβ由脑间质液向血液或由血液向脑间质液转运(Fig 2)。
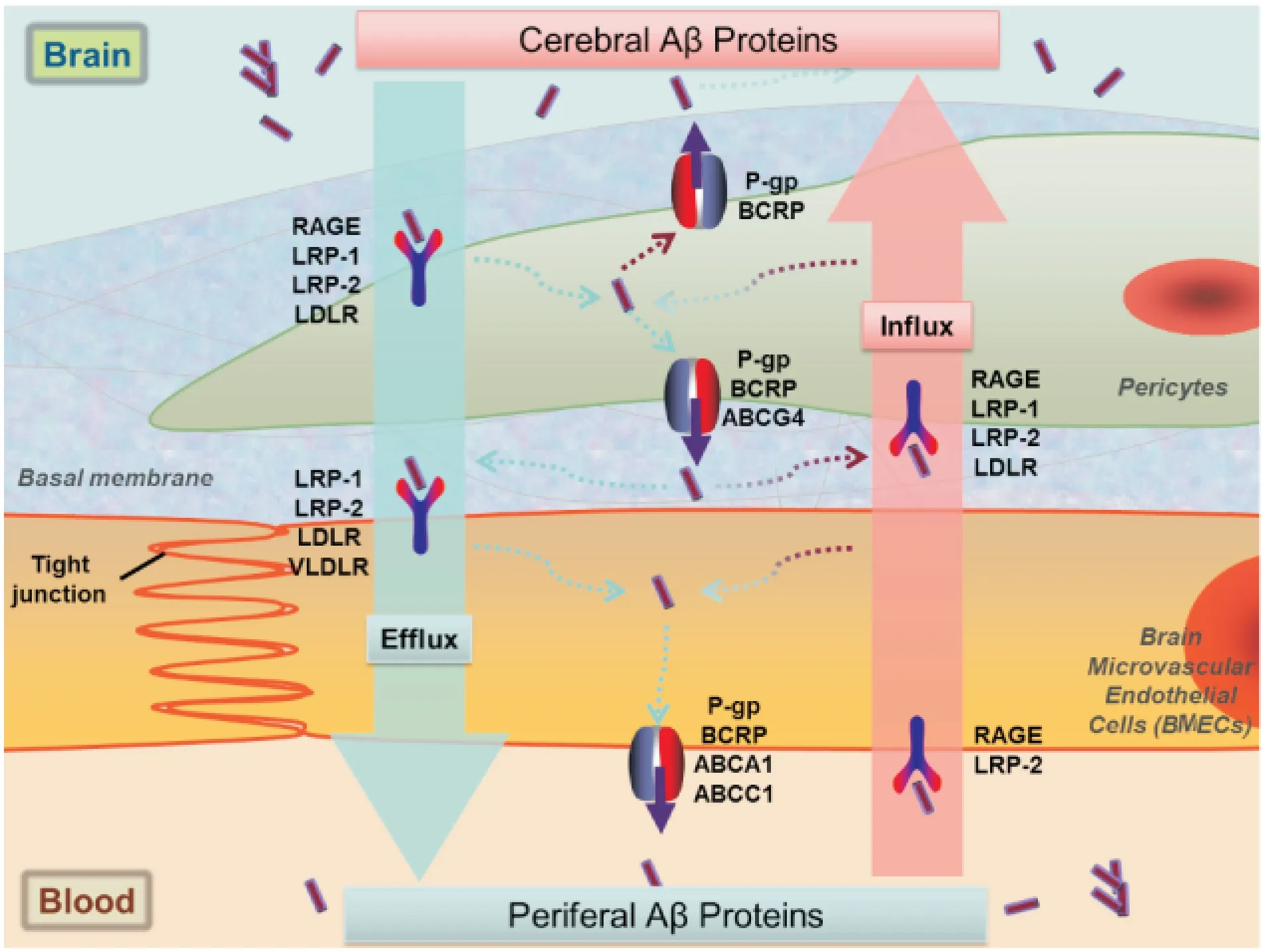
Fig 2 Transport of Aβ through blood-brain barrier
3 Aβ跨血脑屏障转运受体
3.1晚期糖基化终末产物受体(receptor for advanced glycation end-products, RAGE)RAGE是一种多配体的膜受体,属于免疫球蛋白超家族成员,由胞外区、单次跨膜区和胞内区组成,主要表达于内皮细胞、神经元细胞、免疫细胞与血管平滑肌细胞中。RAGE除与体内多种配体结合,如AGEs、Aβ等,引发一系列细胞氧化应激和炎症反应外,还是介导Aβ由血液向脑内转运的重要受体。
对于Aβ跨BBB的转运研究是从流入(influx)开始的,有研究发现通过向小鼠腹膜内注射富含Aβ的脑提取物会导致脑内淀粉样蛋白含量的升高[4],说明Aβ会穿过BBB在脑内积聚。Deane等[5]对小鼠进行Aβ脑灌注的研究表明RAGE会介导Aβ跨血脑屏障转运并促进其在脑内的积聚。Candela等[6]运用激光共聚焦显微镜三维扫描体外培养的BMECs,证明RAGE只表达于BMECs的腔内侧,并且会介导血液中Aβ单向的向脑内流入的转胞吞作用[5-6]。RAGE是介导Aβ由外周向脑内流入的主要受体,通过使用RAGE抑制剂或敲除RAGE基因的小鼠会明显减少Aβ由血液向脑内的转运[5, 7]。
RAGE还表达于BBB的周皮细胞上,但由于周皮细胞并不具备BMECs的极性,因而会介导Aβ的双向转运。除此之外,表达于BMECs的RAGE与Aβ相互作用还会引发一系列炎症反应和氧化应激[8-9],破坏BMECs之间的紧密连接,增加BBB的渗透性,打乱脑的内稳态。Kook等[10]发现Aβ-RAGE相互作用使胞内钙离子和基质金属蛋白酶水平升高,通过Ca2+-钙调磷酸酶信号通路导致紧密连接蛋白1(zonula occludin-1,ZO-1)的表达降低,从而对BBB的紧密连接造成损伤。RAGE与Aβ的结合还会引发正反馈调节,使RAGE的表达水平升高,并进一步促进Aβ向脑内的转运,引起AD发病的加重。
3.2低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)家族LDLR家族包括LDLR、低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein, LRP)及极低密度脂蛋白受体(very-low-density lipoprotein receptor, VLDLR)等成员,具有介导脂蛋白内吞或信号转导等不同的功能。
LRP-1,也被称为α-巨球蛋白,是LRP家族成员之一,是表达于细胞膜上的受体,其功能涉及胞内信号转导、脂质稳态和介导内吞作用。对LRP-1最初的认识是作为载脂蛋白E的受体用于由胞外向胞内转运胆固醇,之后发现它可以与多种结构与功能不同的配体相结合,比如α2-巨球蛋白、乳铁蛋白、VIII型因子、组织纤溶酶原激活物、APP和Aβ。同时由于其胞内段含有丝氨酸和酪氨酸磷酸化位点,在胞内信号转导中发挥重要作用。
在BBB中,LRP-1表达于BMECs的腔外侧,介导Aβ由脑内向血液流出过程。表达于BMECs腔外侧的LRP-1通过识别与结合Aβ,以及接下来的内吞和转胞吞作用将Aβ转运出脑[11]。体内和体外的研究认为LRP-1是介导Aβ从脑内跨BBB清除的主要受体[12]。Shibata等[13]研究表明小鼠能迅速通过LRP-1介导的跨BBB转运将注射到脑内的Aβ1-40清除出脑,并且LRP-1的表达量在老龄鼠中明显下调并导致Aβ在AD病人脑内的积聚。降低LRP-1的表达会引起脑内Aβ水平的升高,而提高LRP-1的表达量则相应的减少Aβ在脑内的积聚[12]。相对于RAGE对Aβ转运的定论,LRP-1发挥作用的机制则还有争议。除以上观点外,还有研究表达了相反的意见,Ito等[14]认为在Aβ1-40跨BBB由脑内向血液流出过程中并不是LRP-1发挥关键作用,而是另一种未知的转运体。也有研究认为LRP-1不仅介导Aβ的脑内向血液流出转运,同时还参与血液向脑内的流入转运,即双向转运[15]。
LRP-2,又被称为megalin,相对于Aβ1-42更能高亲和性的结合Aβ1-40[11],表达于BBB的BMECs腔内侧和腔外侧以及周皮细胞上,能同时介导Aβ流入或流出大脑的双向转运[16]。同时LRP-4也能结合Aβ1-40,并介导其跨BBB转运。LDLR与VLDLR同时表达于BMECs的腔外侧,对于Aβ转运出脑发挥作用,其中在Aβ模型鼠体内通过过表达LDLR可以提高Aβ跨BBB的清除[16],减少在脑内的积聚;VLDLR则会通过结合Aβ-载脂蛋白复合物将其从脑内转运到血液[17]。
3.3P-糖蛋白(P-glycoprotein, P-gp或MDR1)与乳腺癌耐药相关蛋白(breast cancer resistance protein, BCRP)P-gp与BCRP又分别称为ABCB1、ABCG2,都是ATP结合盒(ATP- binding cassette,ABC)转运体,表达于BMECs的腔内侧,因为其具有相似的底物如Aβ,且都是作为BBB的主要流出泵,抑制其底物进入脑内及增强流出[18],所以在研究中常一起考虑。Lam等[19]在体外实验中首次发现富含P-gp的囊泡会引起Aβ的跨膜转运,说明P-gp作为Aβ的流出泵影响从脑内的清除。另有研究发现,在AD模型鼠与AD病人的海马组织血管中P-gp与BCRP的表达量和转运活性比正常组明显降低[20],并导致脑内Aβ含量的升高,且在P-gp基因敲除小鼠脑中Aβ的积聚明显升高。
虽然具有相似的底物,但对BCRP的研究却显示出不同的结果。体外BBB模型研究显示BCRP可与P-gp一样限制Aβ跨BBB入脑并介导流出[6, 21],而同时也有研究认为BCRP对脑内Aβ的清除过程并不发挥作用[22]。很多研究也证实在AD病人及AD模型鼠中BCRP的表达量没有变化甚至是上调[18]。最近的研究提示P-gp与BCRP可能并不直接介导脑内Aβ的流出,而是通过限制血液内Aβ向脑内的流入、介导BMECs细胞中Aβ流出来减少在脑内的积聚[6, 23]。
3.4ABCC1、 ABCA1及ABCG4同ABCB1和ABCG2一样,ABCC1、 ABCA1及ABCG4也是ABC超家族成员,ABC转运体是一类庞大而古老的蛋白家族,其都具有相似的ABC结构域,能通过结合和水解ATP的释放能量进行底物的转运以及RNA转录或DNA修复。
ABCA1表达于BMECs和周细胞上,在LXR/ABCA1信号通路中,肝X受体(liver X receptor, LXR)作为核受体,它的激活会导致ABCA1表达上调[23]。通过使用LXR的激动剂GW3965、TO901317、24S-hydroxycholesterol或27-hydroxycholesterol会明显降低Aβ在AD模型鼠脑内的沉积[23],并改善其认知功能,这一过程是通过LXR/ABCA1信号通路实现的。相似的,过表达ABCA1会引发同样的结果,而ABCA1的降低会提高Aβ在AD模型鼠脑内的沉积[24]。
ABCC1在BBB中的BMECs和周细胞上表达,而其在BMECs确切的细胞定位还有争论,可能与实验材料的种属有关[25]。最近的研究发现敲除abcc1基因的AD模型鼠大脑内Aβ水平升高,而用硫乙拉嗪(thiethylperazine)激活ABCC1则明显降低Aβ含量[26]。
在体外细胞系中研究发现ABCG4会介导Aβ向细胞外流出,并推测ABCG4通过与ABCG2相配合将Aβ跨BBB转运出脑[21]。
4 Aβ跨血脑屏障清除策略
4.1减少Aβ通过血脑屏障向脑内流入作为Aβ由血液向脑内运输的主要受体和转运体,通过使用RAGE的抑制剂或降低BBB上RAGE表达量将会是非常有前景的治疗策略。目前主要的RAGE抑制剂有可溶性RAGE(soluble RAGE,sRAGE)、RAGE特异性抗体及其它低分子量RAGE抑制剂。
sRAGE即RAGE在细胞膜的胞外段可溶性部分,可与RAGE竞争性结合配体如Aβ,阻断Aβ与表达于BMECs腔内侧的RAGE相结合,从而降低Aβ由血液向脑内转运,减少在脑内的沉积[5],并改善动物模型的空间学习记忆能力。已有相当多的研究表明sRAGE是一种非常有效的RAGE抑制剂。
RAGE特异性抗体可通过识别与结合RAGE胞外区,阻断RAGE与Aβ等配体的结合,从而减少Aβ的转运[5,7]。FPS-ZM1是近期报道的一种新型小分子RAGE抑制剂,它能特异性结合RAGE胞外段V区,与Aβ竞争性抑制结合位点,抑制Aβ由血液跨BBB入脑[7]。与之类似,体内外实验证明另一种小分子RAGE抑制剂PF04494700 (TTP488)可抑制RAGE与其配体的结合[27],现已进入临床二期实验。
在Deane等[5]的小鼠脑灌注实验中,RAGE-null小鼠几乎没有Aβ通过BBB转运入脑,说明通过降低RAGE表达水平可能对改善AD发病具有一定作用。通过抑制RAGE靶点还会降低神经炎症与氧化应激[28],对于治疗AD具有重要作用。
4.2增加Aβ通过血脑屏障从脑内流出目前对于Aβ通过BBB清除出脑的具体机制尚无明确定论,有多种受体可能在介导Aβ转运出脑的过程中发挥作用,其中研究较多的为LRP-1。通过提高脑内LRP-1的表达量或LRP-1对Aβ的亲和性可能对脑内Aβ的清除发挥积极作用。
介于LRP-1是Aβ通过BBB清除出脑的主要受体,其在脑内表达降低或敲除会降低Aβ的清除并促进Aβ在脑内及脑血管的积聚,从而引起AD或杜氏脑血管β淀粉样变性的发生发展,因此提高LRP-1在脑内(主要是内皮细胞)的表达有利于脑内Aβ的跨BBB清除作用。
研究发现LRP-1对于Aβ1-40的亲和性远高于含有更多β片层结构的Aβ多肽,如Aβ1-42及血管趋向性突变Dutch/Iowa (DI,含有Gln替换Glu的突变位点)的Aβ1-40[11]。因此,LRP-1对于Aβ1-42及突变Aβ1-40的转运效率明显降低,导致转基因Tg DI/Swe小鼠相比Tg2576小鼠显示出更早的脑内Aβ积聚状态。因此,提高LRP-1与Aβ的亲和性可能对于Aβ跨BBB从脑内向血液中转运具有促进作用。
此外,LRP-2、LRP-4、LDLR、VLDLR及P-gp等受体也可能对脑内Aβ的跨BBB清除发挥作用,但具体作用及机制尚不明确。
5 总结与展望
β淀粉样蛋白级联假说认为Aβ的生成增多及清除减少导致其在脑内异常积累,引发下游细胞凋亡、神经突触丢失、神经传导障碍、氧化应激、神经炎症等一系列级联反应,最终造成AD的发生发展。目前针对Aβ生成的新药临床试验屡屡碰壁,而大量研究证明,作为维持Aβ体内动态平衡的BBB的功能紊乱可能对AD的启动发挥重要作用[29-30]。
BBB上的RAGE与LRP-1对于调控脑内Aβ的水平发挥关键作用。RAGE作为AD发病机制中的重要靶点,通过使用RAGE抑制剂或降低RAGE在BBB上的表达能够减少Aβ通过血脑屏障由血液向脑内流入,除RAGE抗体与sRAGE以外,已经有FPS-ZM1及PF04494700等多种小分子RAGE抑制剂被证实具有抑制RAGE结合Aβ的作用。而对于提高脑内LRP-1的表达量或LRP-1对Aβ的亲和性的研究较少,需要更多实验来证实其作用。
对于BBB功能及其Aβ相关转运受体的进一步研究有助于理解AD的发生发展以及开发对应的新型有效的治疗方法。由于BBB的复杂结构及特殊定位,以及其在神经血管单元中的重要地位,对其整体功能研究也较为困难,尚需进行大量深入研究。
[1]韦云,刘剑刚,李浩,等. γ-分泌酶、淀粉样前体蛋白和早老蛋白1在阿尔采末病中相关性的研究进展[J]. 中国药理学通报, 2014, 30(02): 167-9.
[1]Wei Y, Liu J G, Li H, et al. Research progress on interactions among γ-secretase, amyloid precusor protein and presenilin-1 in Alzheimer’s disease[J].ChinPharmacolBull, 2014, 30(02): 167-9.
[2]Ueno M, Chiba Y, Matsumoto K, et al. Clearance of beta-amyloid in the brain[J].CurrentMedChem, 2014, 21: 4085-90.
[3]查雨锋,傅晓钟,张顺,等. 大鼠脑微血管内皮细胞与周细胞、星形胶质细胞共培养建立体外血脑屏障模型[J]. 中国药理学通报, 2015, 31(5): 730-5.
[3]Zha Y F, Fu X Z, Zhang S, et al. Establishment of aninvivoblood-brain barrier model by co-culturing rat brain microvascular endothelial cells, pericytes and astrocytes[J].ChinPharmacolBull, 2015, 31(5): 730-5.
[4]Eisele Y S, Obermuller U, Heilbronner G, et al. Peripherally applied A beta-containing inoculates induce cerebral beta-amyloidosis[J].Science, 2010, 330(6006): 980-2.
[5]Deane R, Du Yan S, Submamaryan R K, et al. RAGE mediates amyloid-beta peptide transport across the blood-brain barrier and accumulation in brain[J].NatMed, 2003, 9(7): 907-13.
[6]Candela P, Gosselet F, Saint-Pol J, et al. Apical-to-basolateral transport of amyloid-beta peptides through blood-brain barrier cells is mediated by the receptor for advanced glycation end-products and is restricted by P-glycoprotein[J].JAlzheimersDis, 2010, 22:(3) 849-59.
[7]Deane R, Singh I, Sagare A P, et al. A multimodal RAGE-specific inhibitor reduces amyloid beta-mediated brain disorder in a mouse model of Alzheimer disease[J].JClinInvest, 2012, 122(4): 1377-92.
[8]Baiguera S, Fioravanzo L, Grandi C, et al. Involvement of the receptor for advanced glycation-end products (RAGE) in beta-amyloid-induced toxic effects in rat cerebromicrovascular endothelial cells culturedinvitro[J].IntJMolMed, 2009, 24(1): 9-15.
[9]Carrano A, Hoozemans J J, van der Vies S M, et al. Amyloid Beta induces oxidative stress-mediated blood-brain barrier changes in capillary amyloid angiopathy[J].AntioxidRedoxSignal, 2011, 15(5): 1167-78.
[10]Kook S Y, Hong H S, Moon M, et al. Aβ1-42RAGE interaction disrupts tight junctions of the blood-brain barrier via Ca(2)(+)-calcineurin signaling[J].JNeurosci, 2012, 32(26): 8845-54.
[11]Deane R, Wu Z, Sagare A, et al. LRP/amyloid beta-peptide interaction mediates differential brain efflux of Abeta isoforms[J].Neuron, 2004, 43(3): 333-44.
[12]Qosa H, Abuznait A H, Hill R A, Kaddoumi A. Enhanced brain amyloid-beta clearance by Rifampicin and caffeine as a possible protective mechanism against Alzheimer’s disease[J].JAlzheimersDis, 2012, 31(1): 151-65.
[13]Shibata M, Yamada S, Kumar S R, et al. Clearance of Alzheimer's amyloid-beta(1-40)peptide from brain by LDL receptor-related protein-1 at the blood-brain barrier[J].JClinInvest, 2000, 106: 1489-99.
[14]Ito S, Ueno T, Ohtsuki S, Terasaki T. Lack of brain-to-blood efflux transport activity of low-density lipoprotein receptor-related protein-1 (LRP-1) for amyloid-beta peptide(1-40) in mouse: involvement of an LRP-1-independent pathway[J].JNeurochem, 2010, 113(5): 1356-63.
[15]Pflanzner T, Janko M C, Andre-Dohmen B, et al. LRP1 mediates bidirectional transcytosis of amyloid-beta across the blood-brain barrier[J].NeurobiolAging, 2011, 32(2): 2323.e1-2323.e11.
[16]Castellano J M, Deane R, Gottesdiener A J, et al. Low-density lipoprotein receptor overexpression enhances the rate of brain-to-blood A beta clearance in a mouse model of beta-amyloidosis[J].ProNatAcadSciUSA, 2012, 109(38): 15502-7.
[17]Deane R, Sagare A, Hamm K, et al. apoE isoform-specific disruption of amyloid beta peptide clearance from mouse brain[J].JClinInvest, 2008, 118(12): 4002-13.
[18]Wijesuriya H C, Bullock J Y, Faull R L, et al. ABC efflux transporters in brain vasculature of Alzheimer’s subjects[J].BrainRes, 2010, 1358: 228-38.
[19]Lam F C, Liu R H, Lu P H, et al. beta-Amyloid efflux mediated by p-glycoprotein[J].JNeurochem, 2001, 76: 1121-8.
[20]Carrano A, Snkhchyan H, Kooij G, et al. ATP-binding cassette transporters P-glycoprotein and breast cancer related protein are reduced in capillary cerebral amyloid angiopathy[J].NeurobiolAging, 2014, 35(3): 565-75.
[21]Do T M, Noel-Hudson M S, Ribes S, et al. ABCG2- and ABCG4-Mediated Efflux of Amyloid-beta Peptide (1-40) at the Mouse Blood-Brain Barrier[J].JAlzheimersDis, 2012, 30(1): 155-66.
[22]Hartz A M S, Miller D S, Bauer B. Restoring blood-brain barrier P-glycoprotein reduces brain amyloid-beta in a mouse model of Alzheimer’s disease[J].MolPharmacol, 2010, 77(5): 715-23.
[23]Saint-Pol J, Candela P, Boucau M C, et al. Oxysterols decrease apical-to-basolateral transport of Ass peptides via an ABCB1-mediated process in aninvitroBlood-brain barrier model constituted of bovine brain capillary endothelial cells[J].BrainRes, 2013, 1517: 1-15.
[24]Fitz N F, Cronican A A, Saleem M, et al. Abca1 deficiency affects Alzheimer’s disease-like phenotype in human ApoE4 but not in ApoE3-targeted replacement mice[J].JNeurosci, 2012, 32(38): 13125-36.
[25]Gosselet F, Saint-Pol J, Candela P, Fenart L. Amyloid-β peptides, Alzheimer’s disease and the blood-brain barrier[J].CurrAlzheimerRes, 2013, 10(10): 1015-33.
[26]Krohn M, Lange C, Hofrichter J, et al. Cerebral amyloid-beta proteostasis is regulated by the membrane transport protein ABCC1 in mice[J].JClinInvest, 2011, 121(10): 3924-31.
[27]Sabbagh M N, Agro A, Bell J, et al. PF-04494700, an oral inhibitor of receptor for advanced glycation end products (RAGE), in Alzheimer disease[J].AlzheimerDisAssocDisord, 2011, 25(3): 206-12.
[28]Lyu C, Wang L, Liu X, et al. Multi-faced neuroprotective effects of geniposide depending on the RAGE-mediated signaling in an Alzheimer mouse model[J].Neuropharmacology, 2015, 89: 175-84.
[29]van de Haar H J, Burgmans S, Hofman P A, et al. Blood-brain barrier impairment in dementia: current and futureinvivoassessments[J].NeurosciBiobehavRev, 2015, 49: 71-81.
[30]Sagare A P, Bell R D, Zlokovic B V. Neurovascular dysfunction and faulty amyloid beta-peptide clearance in Alzheimer disease[J].ColdSpringHarbPerspectMed, 2012, 2(10):a011452.
Research progress on transport mechanism of amyloid beta-peptides across blood-brain barrier
ZHANG Hai-jing1,2,3, ZHAO Chun-hui1,2,3, ZHANG Wen-sheng1,2,3
(1.BeijingAreaMajorLaboratoryofProtectionandUtilizationofTraditionalChineseMedicine,BeijingNormalUniversity,Beijing, 100088,China; 2.EngineeringResearchCenterofNaturalMedicine,MinistryofEducation,BeijingNormalUniversity,Beijing100088,China;3.CollegeofResourcesScienceTechnology,BeijingNormalUniversity,Beijing100875,China)
Amyloid beta-peptides (Aβ) is the key pathological feature of Alzheimer’s Disease (AD). Various factors contribute to the accumulations of Aβ in the brains of patients. Among them, blood-brain barrier (BBB) plays a crucial role in transporting Aβ between the brain and the bloodstream while this transfer function is mediated by the receptor of Aβ on BBB. The abnormality of Aβ transport and related receptor expression can be detected in the brains of patients with AD, resulting in an unusual increase in Aβ levels unusually increased . This review elaborates the structure and function of BBB, the transport of Aβ and the expression and transport mechanism of the related receptor, as well as summarizes the possible clearance strategy of Aβ across the BBB.
amyloid beta-peptides; Alzheimer’s Disease; blood-brain barrier; transport; receptor for advanced glycation end-products; low-density lipoprotein receptor-related protein
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.010.html
2016-06-30,
2016-08-05
国家自然科学基金资助项目(No 81274118);国家科技部“重大新药创制”科技重大专项资助项目(No 2012ZX09 103-201);中央高校基本科研业务费项目(No 2015KJJC A05)
张海静(1988-),女,博士生,研究方向:神经退行性疾病分子机制及神经药理学,Tel:010-62200669,E-mail:haijingzhang88@163.com;
张文生(1966-),男,教授,博士生导师,研究方向:神经退行性疾病分子机制及神经药理学,通讯作者,Tel:010-62200669,E-mail:zws@bnu.edu.cn
10.3969/j.issn.1001-1978.2016.10.005
A
1001-1978(2016)10-1348-05
R-05;R322.81;R341;R392.11;R745.702.2摘要:β淀粉样蛋白(amyloid beta-peptides, Aβ)是阿尔茨海默病(Alzheimer’s disease, AD)的主要病理特征。Aβ在患者脑内的积聚由多种因素诱导,其中血脑屏障(blood-brain barrier, BBB)对于Aβ在脑内与血液之间的转运发挥关键作用,而这一转运作用是通过BBB上Aβ受体介导的。在AD患者脑内可检测到Aβ转运及相关受体表达的异常,与脑内Aβ含量的异常升高有关。对BBB结构与功能、Aβ转运相关受体的表达及其转运机制进行了综述,并对可能的脑内Aβ跨BBB清除策略进行了总结。
