2型糖尿病骨质疏松研究进展
2016-11-08刘帼静呼晓雷何发忠
刘帼静,呼晓雷,何发忠,张 伟
(1.中南大学湘雅医院临床药理研究所,湖南 长沙 410008;2.中南大学临床药理研究所遗传药理湖南省重点实验室,湖南 长沙 410078)
◇讲座与综述◇
2型糖尿病骨质疏松研究进展
刘帼静1,2,呼晓雷1,2,何发忠1,2,张伟1,2
(1.中南大学湘雅医院临床药理研究所,湖南 长沙410008;2.中南大学临床药理研究所遗传药理湖南省重点实验室,湖南 长沙410078)
糖尿病主要是由于胰岛素分泌不足或者胰岛素抵抗引起的体内血糖升高。糖尿病骨质疏松是一种慢性的糖尿病并发症,一般由于胰岛素绝对或相对不足以及内分泌功能紊乱引起激素失衡、钙磷代谢紊乱而导致的骨密度下降及骨微观结构改变。由于现代人摄入营养物质过剩、运动量下降以及环境变化等因素,引起糖尿病的发生率增加。2型糖尿病的发生率占糖尿病总数的90%左右,且2型糖尿病的患者骨折的发生率明显上升。该文就2型糖尿病对骨影响的研究进展进行综述。
2型糖尿病;骨质疏松;高糖;胰岛素;药物;炎症因子
伴随着我国经济的不断发展,人们生活水平的不断提升,糖尿病的发病率明显上升,并且出现发病人群年轻化的趋势。糖尿病是由于胰岛素分泌不足或者胰岛素抵抗引起的体内糖代谢发生紊乱的代谢性疾病。由于现代人高糖高脂的饮食习惯,2型糖尿病已经成为我国临床常见的心血管疾病之一,2型糖尿病存在多种并发症,骨质疏松是2型糖尿病慢性并发症,其愈来愈受到临床研究工作者的重视。
1 糖尿病引起骨折风险增加
糖尿病会引起很多并发症的出现,包括心血管疾病、肾病、神经性疾病、视网膜疾病以及改变骨细胞的代谢,影响成骨细胞矿化[1]。1型糖尿病患者的骨矿物质密度低于正常人,然而2型糖尿病对于骨代谢的影响一直存在争议,一些研究曾报道糖尿病患者的骨矿物质密度并没有变化或者有所升高,但证据表明1型和2型糖尿病患者骨折的风险都高于正常人[1]。在一项临床研究中,作者对299 104例2型糖尿病和299 104健康人进行随访研究,该研究发现2型糖尿病10年后发生骨折的概率为30.6%,显著性高于非糖尿病患者骨折的概率[2]。研究发现,小鼠给予高脂或高脂和高糖的饮食2 mon后,体重上升,出现胰岛素抵抗和氧化应激、代谢紊乱等现象。高脂高糖喂养的小鼠6 mon后出现高糖和持续的高胰岛素,8 mon后出现了脂肪病变和内皮功能紊乱的现象[3]。体内长期处于高胰岛素、高血糖的条件下,会抑制成骨细胞以及激活破骨细胞,引起骨密度降低,继而骨折发生概率上升[4]。
2 2型糖尿病中炎性因子的变化与骨质疏松
目前关于肥胖对骨折的影响有很多争议,有的学者认为肥胖能够增加骨密度,从而减少骨折的风险[5];然而在另一项研究中,作者用200例志愿者进行对照研究,发现脂肪过多能够增加骨折的风险[6]。多项研究表明,肥胖与2型糖尿病相关,Christopher等[7]发现,肥胖能够引起胰岛β细胞功能失调,出现高胰岛素血现象,胰岛β细胞功能失调是2型糖尿病发生的重要原因。肥胖能够引起体内慢性炎症的发生,在肥胖模型的小鼠体内,炎症因子以及肿瘤坏死因子(TNF-α)的水平上升,提示肥胖和炎症相关[8]。在脂肪组织中促炎症因子诱导白细胞介素-6(IL-6)以及C-反应蛋白浓度升高[9]。TNF-α浓度的升高能够引起成骨细胞的凋亡[10],在骨质疏松人群的血浆中,IL-6的水平也明显高于正常人[11],因此TNF-α和IL-6在肥胖人群中水平上调,可能是诱导骨质疏松发生的重要原因。脂肪细胞和成骨细胞都是由间充质干细胞分化而来,炎症因子在体内的水平升高将会诱导间充质干细胞更多的分化为脂肪细胞,从而导致成骨细胞的数量减少,进而影响骨骼的结构。
3 糖尿病内环境变化对骨代谢影响
3.1胰岛素与高糖对骨质疏松的影响2型糖尿病通常伴随着胰岛素抵抗导致胰岛素水平的升高,而高胰岛素水平会引起尿液中钙含量增加,钙流失增多,从而导致体内钙的失衡[12]。研究发现在小鼠体内,高糖能够增加成骨细胞中ROS水平,导致碱性磷酸激酶(ALP)的活性降低,并且抑制Ⅰ型胶原蛋白水平和成骨细胞矿化[4],Ⅰ型胶原蛋白是成骨细胞分化成为骨细胞的关键蛋白,Ⅰ型胶原蛋白水平降低致使骨细胞生成减少,影响骨结构。同时高糖能够诱导细胞出现氧化应激,通过激活PI3/Akt通路抑制成骨细胞分化,上调PPARγ的表达,促进脂肪的形成。Chuang等[13]也证实高血糖能够通过增加PPARγ表达增加引起骨髓基质细胞(MSCs)脂肪生成。在胚胎干细胞(ES)中,敲除PPARγ基因后细胞不能分化为脂肪细胞,而是自发的分化为成骨细胞,杂合的PPARγ基因敲除小鼠骨量较高并且成骨基因的表达高于正常小鼠[14]。因而,糖尿病患者体内的胰岛素和血糖浓度的升高能够使骨细胞生成减少,从而出现骨质疏松的现象。
3.2活性氧(ROS)对骨质疏松的影响糖尿病患者体内会出现包括氧化应激、高血糖、肥胖等在内的诸多代谢性失常。晚期糖基化产物(AGEs)含量升高[15],糖的自氧化[16],蛋白激酶C(PKC)激活[17],多元醇代谢通路活性提高[18]均会引起线粒体产生ROS的含量增加。ROS含量增加能够对DNA、蛋白和脂质产生损伤作用,且ROS能够引起细胞增殖能力和分化能力降低,诱导凋亡,使细胞周期停滞[19,20]。在体外研究中发现,氧化应激能够抑制成骨细胞分化为骨细胞,诱导成骨细胞凋亡[21,22]。正常情况下人体内氧化和抗氧化处于相对平衡状态,抗氧化剂通常从食物中摄取,例如维生素A、维生素C、维生素E、硒、白藜芦醇和α-生育酚等[23,24]。糖尿病患者体内高糖胰岛素和晚期糖基化产物等浓度升高促使线粒体产生ROS增多,体内的氧化和抗氧化平衡遭到破坏,进而影响成骨细胞的代谢。
3.3脂联素对骨质疏松的影响脂联素在体内是浓度水平较高的脂肪因子,它是由脂肪组织分泌,脂联素在健康人的外周血中浓度水平较高。实验证实,脂联素能够增加胰岛素敏感性、抗炎和抗动脉粥样硬化的作用。通常在肥胖和2型糖尿病患者外周血中脂联素的水平较健康人低[25],脂联素降低通常伴随着胰岛素抵抗。脂联素参与很多生理和病理的代谢,研究发现脂联素浓度水平与骨代谢相关。体外和动物实验显示,脂联素呈现出对钙化的促进作用,脂联素敲除的小鼠血管钙化严重,而给予脂联素治疗后的小鼠能够显著的减少破骨细胞的分化和血管平滑肌细胞的钙化[26]。以上证据显示脂联素是破骨细胞的抑制剂,脂联素水平的降低能够激动破骨细胞,导致骨吸收增加,骨密度降低。同时成骨细胞也表达脂联素和它的受体,体外研究表明脂联素能够通过激动成骨前细胞,抑制破骨前细胞来增加骨密度[27]。
4 糖尿病常用药物对骨质疏松的影响
临床上用于治疗2型糖尿病的药物噻唑烷二酮类,例如环格列酮、恩格列酮和曲格列酮,将会引起PPARγ表达增加。在动物和人体中均已经证实,PPARγ表达增加将会抑制成骨基因的表达,阻碍成骨细胞到骨细胞的分化[28,29]。同时噻唑烷二酮类药物会引起间充质干细胞优先分化为脂肪细胞,减少成骨细胞数量,引起骨质的流失,易发骨折[30,31]。在1个大型的临床研究中发现,用噻唑烷二酮类药物治疗2型糖尿病1年后,65岁以上的妇女骨折风险明显增加[32]。Bernard 等[33]发现,2型糖尿病患者服用二甲双胍能够引起I型前胶原氨基端肽(P1NP)和ALP的表达降低(男性:P1NP, -19.3%,ALP,-16.4%;女性:P1NP, -14.4%,ALP,-15.7%),并且服用二甲双胍的患者P1NP和ALP降低的程度明显高于服用罗格列酮和格列本脲的患者。P1NP和ALP都是骨生成的标志物,其表达降低预示着骨的生成减少,骨质疏松的风险增加[33]。然而另外有研究显示,给予小鼠二甲双胍够能够增加瘦素的敏感性,而瘦素与BMD呈正相关[34]。维生素D对于骨质疏松的影响一直处于争议中。在多个临床分析中,维生素D与骨质疏松并没有相关性。但另有研究发现,维生素D能够增加血液中钙和磷的水平,同时能够降低甲状旁腺素(PTH)分泌过多[35],而钙、磷和甲状旁腺素是成骨细胞矿化为骨细胞的必要元素。而最近有研究发现,中药提取物对于2型糖尿病引起的骨质疏松也有一定的治疗作用[36],这提示我们拓宽对中药领域在糖尿病骨质疏松治疗方面的研究。
5 糖尿病对骨细胞影响
5.1糖尿病对成骨细胞影响间充质干细胞是一种多功能细胞,该细胞由骨髓细胞分化而来,在不同的组织中,间充质干细胞能够分化和增殖为不同的细胞[27]。对于间充质干细胞形成骨细胞的过程中,其在不同的条件下可以分化为成骨细胞或脂肪细胞。在含有高糖的DMEM、胎牛血清、胰岛素、地塞米松和茚甲新的条件下,间充质干细胞更易分化为脂肪细胞;而有抗坏血酸和β-甘油磷酸盐存在的环境下则会分化为成骨细胞。研究证明,MSCs细胞在氧化应激的条件下,将会降低成骨基因的表达,脂肪的生成增多。高糖条件下,MSCs细胞HO-1基因的表达减少进而下调BMPs和Runx-2的表达[38-39],减少成骨细胞的的生成。PPARγ转录因子是影响骨质疏松最重要的基因,它在糖尿病和年龄较大的人群中表达上调,在小鼠的胚胎期敲除该基因,将会导致脂肪生成障碍[40]。糖尿病患者体内的PPARγ表达增多将会诱导间充质干细胞更多的分化为脂肪细胞,从而成骨细胞的数量相对减少,引起骨质疏松。
细胞内的氧化因子增多时,主要抗氧化酶调节因子Nrf-2的表达增多。Hinoi等[42]发现Nrf-2的表达能够通过抑制Runx-2依赖通路从而使成骨细胞的分化能力降低[41]。H2O2能够抑制MC3T3-E1细胞成骨相关基因的表达,并且减少MC3T3-E1细胞的矿化。糖尿病小鼠体内的TNF的表达水平也明显增高,TNF表达的升高能够诱导NF-κB的活性增强,NF-κB则能够减少Runx-2的表达[43]。Runx-2的表达情况能够反映成骨细胞矿化情况,Runx-2表达的降低显示成骨细胞矿化减少。
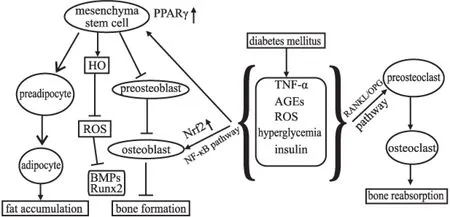
Fig 1 Effect of type 2 diabetes on osteoblast and osteoclast
5.2糖尿病对破骨细胞影响人体的骨骼处于动态平衡状态,它一直处于建造/重塑的动态中,骨吸收与破骨细胞相关,而骨形成主要是与成骨细胞相关。糖尿病对于破骨细胞的影响主要是通过RANKL/OPG通路。糖尿病患者体内促炎症因子IL-6、TNF-α水平升高能够通过RANKL/ OPG通路激活破骨细胞的活性,增加破骨细胞的吸收能力[44],打破原来的动态平衡,使得骨结构变得疏松。同时糖尿病人体内的AGEs和ROS等水平升高,也能够引起RNAKL/OPG通路的过度激活,进而增强破骨细胞吸收能力,产生骨质疏松现象(Fig 1)。
6 结语
综上所述,2型糖尿病作为一种代谢综合征,其内环境的变化能够从多方面影响骨的形成以及骨吸收过程,诱发骨质疏松。现阶段关于糖尿病骨质疏松的研究主要是基于对成骨细胞的抑制和破骨细胞的激动,关于糖尿病骨质疏松的相关机制还有待进一步探讨与研究。而目前关于药物对2型糖尿病骨质疏松的影响研究较少,用于2型糖尿病骨质疏松的治疗药物也较少。如今中药在各个领域展现出新的活力,研究者可以从中药中发现新的药物用于2型糖尿病骨质疏松的治疗。本文主要是对于目前糖尿病骨质疏松的研究现况进行总结,希望能为糖尿病骨质疏松研究者提供新的思路。
[1]Räkel A, Sheehy O, Rahme E, Lelorier J. Osteoporosis among patients with type 1 and type 2 diabetes[J].DiabetesMetab, 2008, 34(3): 193-205.
[2]Rathmann W, Kostev K.Fracture risk in patients with newly diagnosed type 2 diabetes: a retrospective database analysis in primary care[J].JDiabetesComplications, 2015, 29(6): 766-70.
[3]Lozano I, Van der Werf R, Bietiger W,et al.High-fructose and high-fat diet-induced disorders in rats: impact on diabetes risk, hepatic and vascular complications[J].NutrMetab(Lond), 2016, 13:15.
[4]Zhang Y, Yang J H.Activation of the PI3K/Akt pathway by oxidative stress mediates high glucose-induced increase of adipogenic differentiation in primary rat osteoblasts[J].JCellBiochem, 2013, 114(11): 2595-602.
[5]Kopelman P G.Obesity as a medical problem[J].Nature, 2000, 404(6778): 635-43.
[6]Goulding A, Jones I E, Taylor R W,et al.Bone mineral density and body composition in boys with distal forearm fractures: a dual-energy x-ray absorptiometry study[J].JPediatr, 2001, 139(4): 509-15.
[7]Nolan C J, Delghingaro-Augusto V.Reversibility of defects in proinsulin processing and islet beta-cell failure in obesity-related type 2 diabetes[J].Diabetes, 2016, 65(2): 352-4.
[8]Hotamisligil G S, Shargill N S, Spiegelman B M.Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance[J].Science, 1993, 259(5091): 87-91.
[9]Pradhan A D, Manson J E, Rifai N,et al.C-reactive protein, interleukin 6, and risk of developing type 2 diabetes mellitus[J].Jama, 2001, 286(3): 327-34.
[10]Bin G, Cuifang W, Bo Z,et al.Fluid shear stress inhibits TNF-alpha-induced osteoblast apoptosis via ERK5 signaling pathway[J].BiochemBiophysResCommun, 2015, 466(1): 117-23.
[11]Tsarenok S Y, Gorbunov V V.The levels of osteoprotegerin, transforming growth factor-beta, and some cytokines in women with coronary heart disease concurrent with severe osteoporosis[J].TerArkh, 2015, 87(9): 39-43.
[12]McNair P, Madsbad S, Christiansen C,et al.Bone loss in diabetes: effects of metabolic state[J].Diabetologia, 1979, 17(5): 283-6.
[13]Chuang C C, Yang R S, Tsai K S,et al.Hyperglycemia enhances adipogenic induction of lipid accumulation: involvement of extracellular signal-regulated protein kinase 1/2, phosphoinositide 3-kinase/Akt, and peroxisome proliferator-activated receptor gamma signaling[J].Endocrinology, 2007, 148(9): 4267-75.
[14]Akune T, Ohba S, Kamekura S,et al.PPAR gamma insufficiency enhances osteogenesis through osteoblast formation from bone marrow progenitors[J].JClinInvest, 2004, 113(6): 846-55.
[15]Brownlee M.Advanced protein glycosylation in diabetes and aging[J].AnnuRevMed, 1995, 46: 223-34.
[16]Wolff S P, Jiang Z Y, Hunt J V.Protein glycation and oxidative stress in diabetes mellitus and ageing[J].FreeRadicBiolMed, 1991, 10(5): 339-52.
[17]Brownlee M.The pathobiology of diabetic complications: a unifying mechanism[J].Diabetes, 2005, 54(6): 1615-25.
[18]Koya D, King G L.Protein kinase C activation and the development of diabetic complications[J].Diabetes, 1998, 47(6): 859-66.
[19]Slater A F, Stefan C, Nobel I,et al.Signalling mechanisms and oxidative stress in apoptosis[J].ToxicolLett, 1995, 82-83: 149-53.
[20]Shackelford R E, Kaufmann W K, Paules R S.Oxidative stress and cell cycle checkpoint function[J].FreeRadicBiolMed, 2000, 28(9): 1387-404.
[21]Chen R M, Wu G J, Chang H C,et al.2,6-Diisopropylphenol protects osteoblasts from oxidative stress-induced apoptosis through suppression of caspase-3 activation[J].AnnNYAcadSci, 2005, 1042: 448-59.
[22]Fatokun A A, Stone T W, Smith R A.Hydrogen peroxide-induced oxidative stress in MC3T3-E1 cells: The effects of glutamate and protection by purines[J].Bone, 2006, 39(3): 542-51.
[23]Tiedge M, Lortz S, Drinkgern J,et al.Relation between antioxidant enzyme gene expression and antioxidative defense status of insulin-producing cells[J].Diabetes, 1997, 46(11): 1733-42.
[24]Mueller L, Boehm V.Antioxidant activity of beta-carotene compounds in different in vitro assays[J].Molecules, 2011,16(2): 1055-69.
[25]Ebrahimi-Mamaeghani M, Mohammadi S, Arefhosseini S R,et al.Adiponectin as a potential biomarker of vascular disease[J].VascHealthRiskManag, 2015, 11: 55-70.
[26]Zhan J K, Wang Y J, Wang Y,et al.Adiponectin attenuates the osteoblastic differentiation of vascular smooth muscle cells through the AMPK/mTOR pathway[J].ExpCellRes, 2014, 323(2): 352-8.
[27]Jurimae J, Rembel K, Jurimae T,et al.Adiponectin is associated with bone mineral density in perimenopausal women[J].HormMetabRes, 2005, 37(5): 297-302.
[28]Shockley K R, Lazarenko O P, Czernik P J,et al.PPAR gamma2 nuclear receptor controls multiple regulatory pathways of osteoblast differentiation from marrow mesenchymal stem cells[J].JCellBiochem, 2009, 106(2): 232-46.
[29]Lecka-Czernik B, Ackert-Bicknell C, Adamo M L,et al.Activation of peroxisome proliferator-activated receptor gamma(PPARgamma) by rosiglitazone suppresses components of the insulin-like growth factor regulatory system in vitro andinvivo[J].Endocrinology, 2007, 148(2): 903-11.
[30]Benvenuti S, Cellai I, Luciani P,et al.Rosiglitazone stimulates adipogenesis and decreases osteoblastogenesis in human mesenchymal stem cells[J].JEndocrinolInvest, 2007,30(9): C26-30.
[31]Bruedigam C, Eijken M, Koedam M,et al.A new concept underlying stem cell lineage skewing that explains the detrimental effects of thiazolidinediones on bone[J].StemCells, 2010, 28(5): 916-27.
[32]Habib Z A, Havstad S L, Wells K,et al.Thiazolidinedione use and the longitudinal risk of fractures in patients with type 2 diabetes mellitus[J].JClinEndocrinolMetab, 2010, 95(2): 592-600.
[33]Zinman B, Haffner S M, Herman W H,et al.Effect of rosiglitazone, metformin, and glyburide on bone biomarkers in patients with type 2 diabetes[J].JClinEndocrinolMetab, 2010, 95(1): 134-42.
[34]Mpalaris V, Anagnostis P, Anastasilakis A D,et al.Serum leptin, adiponectin and ghrelin concentrations in post-menopausal women: Is there an association with bone mineral density?[J].Maturitas, 2016, 88:32-6.
[35]Lips P, van Schoor N M.The effect of vitamin D on bone and osteoporosis[J].BestPractResClinEndocrinolMetab, 2011, 25(4): 585-91.
[36]章毅, 刘云峰, 高璟英,等.染料木黄酮对大鼠胰岛素分泌的调控作用[J].中国药理学通报, 2015,31(5): 737-8.
[36]Zhang Y, Liu Y F, Gao J Y, et al. Regulation effects of genistein on insulin secretion from pancreatic cells[J].ChinPharmacolBull, 2015,31(5): 737-8.
[37]Pittenger M F, Mackay A M, Beck S C,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science, 1999, 284(5411): 143-7.
[38]Abraham N G.Molecular regulation-biological role of heme in hematopoiesis[J].BloodRev, 1991, 5(1):19-28.
[39]Quan S, Kaminski P M, Yang L,et al.Heme oxygenase-1 prevents superoxide anion-associated endothelial cell sloughing in diabetic rats[J].BiochemBiophysResCommun, 2004, 315(2): 509-16.
[40]Kubota N, Terauchi Y, Miki H,et al.PPAR gamma mediates high-fat diet-induced adipocyte hypertrophy and insulin resistance[J].MolCell, 1999, 4(4): 597-609.
[41]Hinoi E, Fujimori S, Wang L,et al.Nrf2 negatively regulates osteoblast differentiation via interfering with Runx-2-dependent transcriptional activation[J].JBiolChem, 2006, 281(26): 18015-24.
[42]Arai M, Shibata Y, Pugdee K,et al.Effects of reactive oxygen species(ROS) on antioxidant system and osteoblastic differentiation in MC3T3-E1 cells[J].IubmbLife, 2007, 59(1): 27-33.
[43]Chang J, Wang Z, Tang E,et al.Inhibition of osteoblastic bone formation by nuclear factor-kappaB[J].NatMed, 2009, 15(6): 682-9.
[44]Khosla S.Minireview: the OPG/RANKL/RANK system[J].Endocrinology, 2001, 142(12): 5050-5.
The research progress of type 2 diabetes osteoporosis
LIU Guo-jing1,2,HU Xiao-lei1,2, He Fa-zhong1,2, ZHANG Wei1,2
(1.DeptofClinicalPharmacology,XiangyaHospital,CentralSouthUniversity,Changsha410008,China;2.InstituteofClinicalPharmacology,CentralSouthUniversity,HunanKeyLaboratoryofPharmacogenetics,Changsha410078,China)
Diabetes is a kind of metabolic syndrome, always happening in the case of insufficient secretion of insulin or insulin resistance, inducing the increase of blood glucose. While, diabetic osteoporosis is a kind of chronic diabetic complications, which happens when insulin secretion is absolutely or relatively insufficient and then the insufficiency induces imbalance of hormone, calcium phosphorus metabolic disorders, thus leading to the decline of bone mineral density and change of bone microstructure. The overnutrition, less exercise and the environment change lead to the increased incidence of diabetes. For all the diabetes, type 2 diabetes accounts for about 90%. Patients with type 2 diabetes show the increasing risk of fracture. This review summarizes the recent advances in the influence of type 2 diabetes on bones.
2 diabetes; osteoporosis; high glucose; insulin; drugs; Inflammatory cytokine
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.002.html
2016-06-07,
2016-08-20
国家自然科学基金资助项目(No 81273595);国家高技术研究发展计划(863计划)资助项目(No 2012AA02A518)
刘帼静(1991-),女,硕士,研究方向:临床药理学、遗传药理学和药物基因组学,E-mail:liuguojing1024@126.com;
张伟(1977-),男,博士,教授,博士生导师,研究方向:遗传药理学与药物基因组学、临床药理学、药物代谢动力学,通讯作者,E-mail:yjsd2003@163.com
10.3969/j.issn.1001-1978.2016.10.001
A
1001-1978(2016)10-1333-04
R-05;R336; R587.1;R681
