N-端二硫键及芳香族氨基酸对木聚糖酶XynZF-2热稳定性的影响
2016-09-26李同彪周晨妍朱新术王燕
李同彪,周晨妍,朱新术,王燕
(新乡医学院 生命科学技术学院,河南 新乡,453003)
N-端二硫键及芳香族氨基酸对木聚糖酶XynZF-2热稳定性的影响
李同彪,周晨妍*,朱新术,王燕
(新乡医学院 生命科学技术学院,河南 新乡,453003)
为提高GH11家族中温木聚糖酶XynZF-2的热稳定性,将其N-端替换成GH11家族的耐热性木聚糖酶EvXyn11的相应序列,并在该段序列引入芳香族氨基酸残基(P9Y、H14F),构建杂合木聚糖酶基因xynEV-34,将木聚糖酶基因xynZF-2和xynEV-34分别在E.coliBL21中表达,并分析温度和pH对酶活性的影响。结果表明,杂合木聚糖酶XynEV-34的最适温度为48 ℃,相比原酶XynZF-2提高了8 ℃。在40 ℃保温1 h,原酶XynZF-2残余酶活性下降到44.36%,而突变酶Xyn34残余酶活性为77.96%。在45 ℃,突变酶XynEV-34的半衰期t1/245℃为23 min,较重组酶XynZF-2(t1/245℃=7 min)提高了16 min。同时,两种酶的最适pH均为5.0,但pH稳定性由原来的4.4~9.0扩增到了3.0~9.0。由此表明,二硫键以及芳香族氨基酸的引入,对该酶的热稳定性以及pH稳定性都有明显改善。
木聚糖酶;二硫键;芳香族氨基酸;热稳定性
木聚糖是由木糖、阿拉伯半乳聚糖以及葡甘聚糖等组成的含量丰富的细胞壁多糖,是半纤维素的主要成分,其主链是由β-1,4糖苷键连接的D-木糖残基组成[1]。木聚糖酶(EC 3.2.1.8)是一种糖苷类水解酶,可以随机内切木聚糖的β-1,4糖苷键产生还原性的低聚木糖[2]。目前,已经发现木聚糖酶在糖苷类水解酶5、7、8、10、11和43等家族分布广泛,根据结构、理化特性以及催化模式的不同,主要分为F10和GH11家族[3]。F10家族的木聚糖酶蛋白结构呈桶状型[4],而GH11家族的木聚糖酶呈右手半握状[3]。
木聚糖酶可以提高半纤维素原料的工业利用率以及饲料利用率,同时,可以用于纸浆漂白、食品加工、纺织、生物燃料等多个领域[5]。然而,随着木聚糖酶工业用途的不断拓展,其工业适用性越来越受到低热稳定性的限制[6]。因此,改善木聚糖酶的热稳定性已成为广泛研究的焦点。表面带电残基、盐桥、氢键、芳香族氨基酸、N-端和α-螺旋处二硫键的引入可以增加木聚糖酶局部结构的稳定性,从而可以有效改善木聚糖酶的热稳定性[7]。如WANG等利用Swiss-PdbViewer分析来源于T.lanuginosusDSM10635的木聚糖酶TLX,在N-端引入一个二硫键(Q1C-Q24C),在大肠杆菌BL21中基因表达发现,二硫键突变酶最适温度提高了10 ℃,在pH 8.0和70 ℃条件下,二硫键突变酶的半衰期提高了20倍。通过圆二色谱测定解链温度发现,解链温度从66 ℃增加到了74 ℃。因此,N-端二硫键的引入使得动力学和热力学稳定性大幅度提高[8]。
木聚糖酶基因xynZF-2是由本实验室从黑曲霉(Aspergillusniger)XZ-3S中分离获得,该酶属于中温木聚糖酶,最适温度为40 ℃,高温条件下热稳定性较差难以满足工业要求[9]。本研究利用生物信息学比对木聚糖酶XynZF-2基因序列(GenBank Accession No.JQ700382)与耐热木聚糖酶EvXyn11基因序列(GenBank Accession No.EU591347)的同源性,通过N-端替换引入二硫键,并在替换的N-端区域引入芳香族基酸,增加芳香族氨基酸含量以期望提高木聚糖酶XynZF-2热稳定性。
1 材料与方法
1.1材料
EscherichiacoliBL21(DE3)、pET-28a均购自Novagen公司,重组质粒pET-28a-xynZF-2由本实验室构建在E.coliBL21上并保存;TaqDNA聚合酶、DL1000 DNA Marker、限制性内切酶、T4DNA Ligase、X-gal、IPTG及购自TaKaRa公司;DNA片段回收试剂盒和质粒提取试剂盒购自Sangon公司;蛋白分子量标准购自碧云天生物技术有限公司;桦木木聚糖购自Sigma公司;其他试剂为国产或进口分析纯。
1.2木聚糖酶初级结构比对分析以及三维建模
通过The ProtParam program (http://web.expasy.org/protparam/) 分析木聚糖酶的理化性质[10],BLAST和DNAMAN6.0同源序列比对与木聚糖酶XynZF-2同源性较高的耐热木聚糖酶基因,PROSITE (http://prosite.expasy.org)预测木聚糖酶功能位点,利用Phyre2 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对木聚糖酶XynZF-2建模,同时,并通过DS ViewerPro6.0分析木聚糖酶的三维结构。
1.3N-端替换区域基因合成
将XynZF-2的N-端48个氨基酸替换成EvXyn11 N-端相应的34个氨基酸,以EvXyn11 N-端的34个氨基酸为模板,与来源于褐色高温单孢菌(Thermomonosporafusca)的耐热木聚糖酶TfxA的N-端区域比对,在EvXyn11 N-端的34个氨基酸中引入芳香族氨基酸,依据大肠杆菌密码子偏爱性,设计重组的EvXyn11 N-端的34个氨基酸基因序列Ev34,根据Ev34和xynZF-2基因序列设计引物(表1),并由金唯智生物科技有限公司合成。
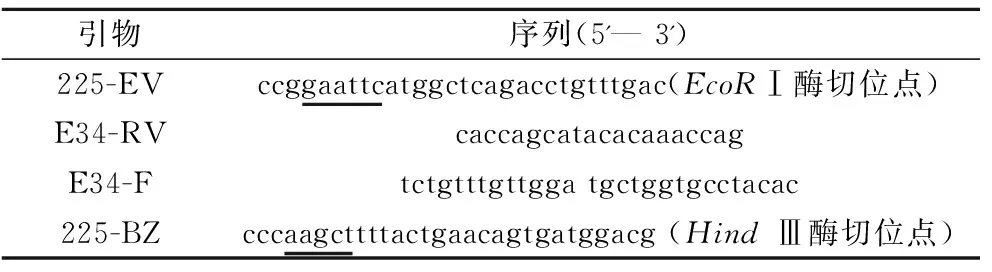
表1 引物序列
注:下划线为酶切位点。
1.4突变基因的扩增与重组载体的构建
以pET-28a-xynZF-2为模板,采用重叠延伸PCR法扩增突变基因xynEV-34,反应条件见参考文献[9],双酶切突变基因xynEV-34和质粒pET-28a,T4DNA Ligase连接双酶切产物,16 ℃过夜,构建表达载体pET-28a-xynEV-34,转化E.coliBL21(DE3),经含有Kan抗性的平板筛选出单克隆菌落,提取重组质粒pET-28a-xynEV-34,经双酶切验证后,送金唯智生物科技有限公司测序。
1.5重组木聚糖酶的诱导表达与纯化
突变基因测序后,重组菌株BL21/pET-28a-xynZF-2和BL21/pET-28a-xynEV-34,经IPTG诱导表达,采用超声波细胞破碎等方法提取粗酶液[11]。利用镍金属螯合层析柱纯化含有His标签蛋白的重组木聚糖酶XynEV-34和XynZF-2,纯化后样品经SDS-PAGE蛋白电泳(15%分离胶和5%浓缩胶)检测[9]。
1.6木聚糖酶酶活性测定
采用DNS法测定木聚糖酶活性[9]。1.5 mL 0.5%桦木木聚糖溶液(pH 4.6)与1 mL适当稀释的酶液,40 ℃下反应15 min,加入2.5 mL DNS溶液,沸水浴7 min显色,冷却后加入5 mL蒸馏水,测定OD540值。在上述条件下,以每分钟产生1 μmol还原糖所需的酶量定义为1个单位(U)。
1.7酶学性质分析
通过最适温度、热稳定性、最适pH以及pH稳定性等酶学性质对比研究纯化后的原酶XynZF-2和突变酶XynEV-34,具体操作方法见参考文献[9]。
1.8统计学处理
每个实验进行3次重复,取其平均值,最终实验数据均用SPSS11.0软件进行处理,并绘制出相应的图形。
2 结果与分析
2.1重组木聚糖酶结构分析
BLAST比对木聚糖酶XynZF-2和EvXyn11氨基酸序列同源性为63%,且两者均属于GH11家族木聚糖酶。同时,对耐热性木聚糖酶EvXyn11三维同源建模发现,EvXyn11 N-端区域含有一个二硫键(Cys5-Cys32)。因此,以木聚糖酶XynZF-2为母本,将N-端的48个氨基酸替换成耐热性木聚糖酶EvXyn11相应的34个氨基酸。同时,木聚糖酶EvXyn11的N-端34个氨基酸与耐热木聚糖酶TfxA的N-端区域的氨基酸残基比对分析,如图1所示,EvXyn11与TfxA 的N-端芳香族氨基酸位点分布基本相同,为提高EvXyn11 N-端芳香族氨基酸含量,在第9、14位点引入芳香族氨基酸(P9Y、H14F),构建杂合木聚糖酶XynEV-34。以相似性最高,PDB号分别为1TE1(68%相似与XynZF-2)和2VUL(73%相似与XynEV-34)的木聚糖酶的3D结构为模板对XynZF-2和XynEV-34同源建模。建模结果表明,XynZF-2和XynEV-34模型与原序列相似度分别为91%和99%,置信度均为100%,符合建模要求。突变酶与原酶结构相似,都属于GH11家族,由一个简单的α-螺旋以及两个反向的β-折叠片层组成,呈右手半握状结构。然而,原酶XynZF-2活性中心位点(Glu103和Glu194)与突变酶(Glu89和Glu194)不一致,这是由于N-端替换导致氨基酸数量减少所致(图2、图3)。
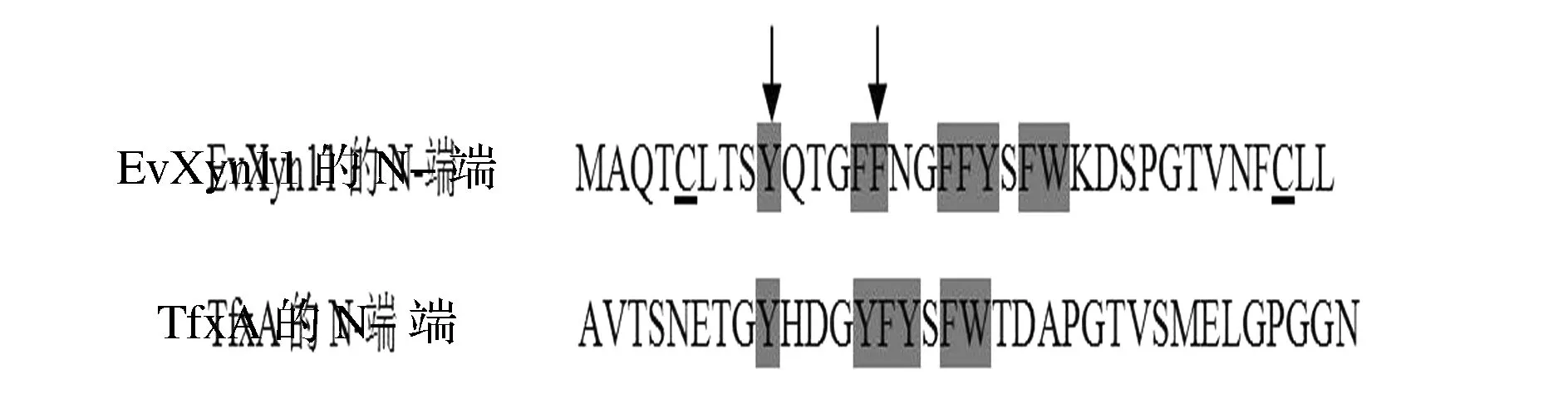
图1 耐热木聚糖酶EvXyn11和TfxA 的N-端区域序列比对Fig.1 N-terminal amino acid alignment of EvXyn11 with TfxA(注:下划线为二硫键位点,箭头为突变位点,阴影部分为芳香族氨基酸)
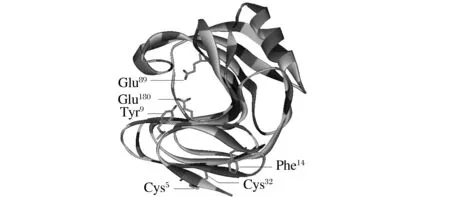
图2 杂合木聚糖酶XynEV-34三维结构Fig.2 The 3D structure of the hybrid xylanase XynEV-34
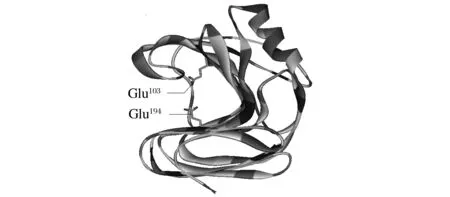
图3 木聚糖酶XynZF-2三维结构Fig.3 The 3D structure of the xylanase XynZF-2
2.2杂合木聚糖酶基因的扩增与表达载体的构建
由金唯智合成的N端基因序列Ev34约112bp,构建在pUC57载体上。以pUC57-Ev34为模板,通过PCR扩增得到目的片段Ev34,如图4所示。利用重叠延伸PCR技术扩增杂合木聚糖酶基因xynEV-34,如图5所示,杂合木聚糖酶基因xynEV-34电泳条带明显低于原酶基因xynZF-2。双酶切(EcoRⅠ、HindⅢ)杂合基因xynEV-34和质粒pET-28a,构建重组表达载体pET-28a-xynEV-34,转化大肠杆菌BL21,基因测序结果显示杂合基因与预期结果一致。
M-DNA marker;1-Ev34的PCR产物图4 Ev34的PCR扩增Fig.4 PCR amplification of Ev34

M-DNA marker;1-xynZF-2的PCR产物;2-xynEV-34的PCR产物图5 xynZF-2和xynEV-34的PCR扩增Fig.5 PCR amplification of xynZF-2 and xynEV-34
2.3杂合木聚糖的表达与纯化
经IPTG诱导的重组菌株BL21/pET-28a-xynZF-2和BL21/pET-28a-xynEV-34,通过超声波破碎,高速离心得到粗酶液,并通过镍金属螯合层析柱纯化粗酶液,SDS-PAGE电泳检测如图6所示。另外,通过The ProtParam program (http://web.expasy.org/protparam/) 分析计算重组酶XynZF-2和XynEV-34的分子质量发现,突变酶XynEV-34分子质量相对原酶XynZF-2(32 kDa),仅仅减少了1 kDa左右。因此,图6显示的纯化后两种木聚糖酶条带相差不明显。

M-蛋白质Marker;1-纯化后的XynZF-2;2-纯化后的XynEV-34图6 重组木聚糖酶XynZF-2 and XynEV-34的SDS-PAGE分析Fig.6 SDS-PAGE analysis of the recombinant xylanase XynZF-2 and XynEV-34
2.4酶学性质分析
2.4.1重组木聚糖酶最适温度以及热稳定性的分析
对纯化后的重组木聚糖酶酶学性质分析发现,如图7所示,突变酶XynEV-34最适温度为48 ℃,相比原酶XynZF-2的40 ℃,最适温度提高了8 ℃。温度对重组木聚糖酶热稳定性的影响如图8所示,原酶XynZF-2热稳定性较差,在40 ℃条件下保温60 min,残余酶活性下降到44.36%,而突变酶XynEV-34保温60 min,残余酶活性为77.96%。由此可见,40 ℃条件下,突变酶XynEV-34热稳定性明显提高。在45 ℃条件下,原酶XynZF-2与突变酶XynEV-34分别保温60 min,如图8所示,原酶XynZF-2的半衰期t1/245℃为7 min,突变酶XynEV-34的t1/245℃半衰期为23 min,提高了16 min;保温20 min后,原酶XynZF-2基本丧失酶活性,而突变酶XynEV-34残余酶活性仍高达57.92%。通过N-端替换引入的二硫键和芳香族氨基酸使木聚糖酶XynZF-2的热稳定性明显改善。
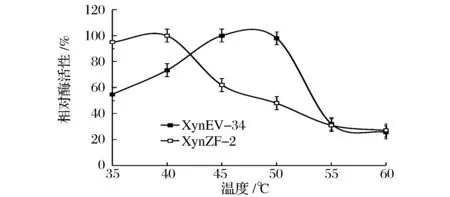
图7 重组木聚糖酶酶最适温度比较Fig.7 Comparison of the optimum temperature of the recombinant xylanases
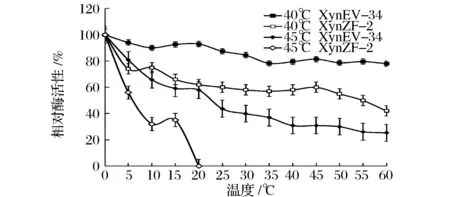
图8 重组木聚糖酶XynEV-34和XynZF-2热稳定性比较Fig.8 Comparison of the thermostability between the recombinant xylanase XynEV-34 and XynZF-2
2.4.2重组木聚糖酶最适pH以及pH稳定性的分析
测定pH对重组木聚糖酶酶活性的影响发现,原酶XynZF-2与突变酶XynEV-34的最适pH都在5.0左右,基本没有改变(图9)。同时,将原酶XynZF-2与突变酶XynEV-34在不同pH的缓冲液中保温1 h,测定各自相对酶活性发现,由图10可见,原酶XynZF-2在pH4.5~9.0之间的相对酶活性在50%以上,而突变酶Xyn34在pH3.0~9.0之间的相对酶活性在50%以上,由此可见,突变酶XynEV-34的pH稳定区间相比原酶XynZF-2明显扩大。由此可以推断,N-端替换可能使得木聚糖酶XynEV-34局部结构更加稳定,从而使得该酶pH稳定性增强。

图9 重组木聚糖酶最适pH比较Fig.9 Comparison of the optimum pH of the recombinant xylanases
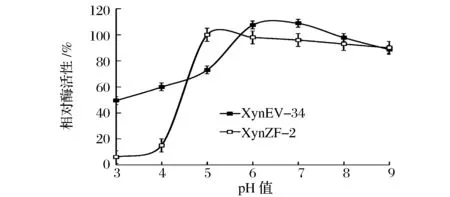
图10 重组木聚糖酶pH稳定性比较Fig.10 Comparison of the pH stability of the recombinant xylanases
3 讨论
研究表明,通过中温和耐热木聚糖酶的氨基酸序列比对,可以有效确定与木聚糖酶耐热性相关的氨基酸残基以及结构区域[12]。另外,在木聚糖酶结构中理性的引入二硫键,可以明显改善木聚糖酶的热稳定性,二硫键主要作用在蛋白的折叠区域,降低蛋白去折叠状态的熵值以稳定蛋白构象,从而提高木聚糖酶的热稳定性[13]。
本研究通过同源序列分析,将木聚糖酶XynZF-2的N-端48个氨基酸替换成木聚糖酶EvXyn11 N-端含有二硫键(Cys5-Cys32)相应的34个氨基酸,增强β-折叠片之间的稳定性。同时,EvXyn11的N-端的34个氨基酸与耐热木聚糖酶TfxA的N-端区域的氨基酸残基比对及结构分析,在EvXyn11 N-端的β链B1上引入芳香族氨基酸(P9Y、H14F),增强β链B1与内部结构之间的疏水作用,稳定N-端局部结构,进而提高整个酶分子的稳定性。同时,构建对突变酶XynEV-34酶学性质分析发现,突变酶最适温度为48 ℃,相比原酶提高了8 ℃;相比原酶XynZF-2,突变酶XynEV-34的t1/245℃半衰期提高了16 min。由此可以得出,木聚糖酶XynZF-2的N-端引入二硫键以及芳香族氨基酸使得其热稳定性明显改善。这种通过同源序列比对以及结构分析来改造木聚糖酶的热稳定性,为其他木聚糖酶的分子改造提供了思路和方法,同时也为木聚糖酶工业用途的拓展奠定了基础。
[1]GOSWAMI G K,KRISHNAMOHAN M,Nain V,et al.Cloning and heterologous expression of cellulose free thermostable xylanase from Bacillus brevis[J]. Springer Plus, 2014, 3(20): 2-6.
[2]ZHANG H M,LI JF, WANG J Q,et al.Determinants for the improved thermostability of a mesophilic family 11 xylanase predicted by computational methods[J].Biotechnology for Biofuels,2014,7(3):1-10.
[3]LI H,VOUTILAINEN S,OJAMO H,et al.Stability and activity ofDictyoglomusthermophilumGH11 xylanase and its disulphide mutant at high pressure and temperature[J].Enzyme and Microbial Technology,2015,70:66-71.
[4]WANG J Q,TAN Z B,WU M C,et al.Improving the thermostability of a mesophilic family 10 xylanase,AuXyn10A,from Aspergillus usamii by in silico design[J].Journal of Industrial Microbiology & Biotechnology,2014,41(8):1 217-1 225.
[5]SATYANARAYANA D V T.Improvement in thermostability of metagenomic GH11 endoxylanase (Mxyl) by site-directed mutagenesis and its applicability in paper pulp bleaching process[J]. Journal of Microbiology and Biotechnology,2013,40(12):1 373-1 381.
[6]QIAN C L,LIU N,YAN X,et al.Engineering a high-performance,metagenomic-derived novel xylanase with improved soluble protein yield and thermostability[J].Enzyme and Microbial Technology,2015,70:35-41.
[7]YIN X,LI J F,WANG J Q,et al.Enhanced thermostability of a mesophilic xylanase by N-terminal replacement designedby molecular dynamics simulation[J].Journal of the Science of Food and Agriculture,2013,93(12):3 016-3 023.
[8]WANG Y W,Fu Z,HUANG H Q,et al.Improved thermal performance ofThermomyceslanuginosusGH11 xylanase by engineering of an N-terminal disulfide bridge[J].Bioresource Technology,2012,112:275-279.
[9]FU GH,WANG Y T,WANG D D,et al.Cloning,expression, and characterization of an GH11 xylanase fromAspergillusnigerXZ-3S[J].Indian Journal of Microbiology,2012,52(4):682-688.
[10]YIN X,GONG Y Y,WANG J Q,et al.Cloning and expression of a family 10 xylanase gene (Aoxyn10) fromAspergillusoryzaeinPichiapastoris[J].Journal of General and Applied Microbiology,2013,59:405-415.
[11]李同彪,周晨妍,朱新术,等.V1C定点突变木聚糖酶XynZF-2对酶热稳定性的影响[J].食品与发酵工业,2015,41(4):167-171.
[12]柏文琴,杨鲁红,马延和.通过N端引入芳香族氨基酸提高木聚糖酶热稳定性[J].生物工程学报,2014,30(8):1 217-1 224.
[13]刘晓彤,邬敏辰,殷欣,等.二硫键对提高木聚糖酶AoXyn11热稳定性的作用[J].食品与生物技术学报,2014,33(10):1 038-1 043.
Effect of N-terminal disulfide bridge and aromatic residues on the thermal stability of xylanase XynZF-2
LI Tong-biao, ZHOU Chen-yan*,ZHU Xin-shu, WANG Yan
(School of Life Science and Technology, Xinxiang Medical University, Xinxiang 45300, China)
In order to improve the thermostability of a mesophilic family GH11 xylanase XynZF-2, the N-terminus of xylanase XynZF-2 was substituted with the corresponding sequence of a hyperthermostability family GH11 xylanase EvXyn11. The aromatic residues (P9Y and H14F) were introduced into this corresponding sequence of xylanase EvXyn11 to construct the hybrid xylanase genexynEV-34. XynZF-2- and XynEV-34-encoding genes were expressed inE.coliBL21, respectively, and effects of pH and temperatures on the activity of xylanase were analyzed. Compared to the optimum temperature of XynZF-2, the optimum temperature of XynEV-34, increasing by 8 ℃, was 48 ℃. In addition, the Xyn34 and XynZF-2 respectively retained about 77.96% and 44.36% of activity after treatment at 40℃ for 60 min. Compared to XynZF-2 witht1/245℃of 7 min,t1/245℃of XynEV-34 was increased to 23 min. Optimum pH values of the XynZF-2 and XynEV-34 did not change notably. However, the pH range for stability of XynEV-34 was broadened from 4.4~9.0 to 3.0~9.0. This study demonstrated that the introduction of a disulfide bridge and aromatic residues could improve the thermostability and pH stability of the XynZF-2 notably.
xylanase; disulfide bridge; aromatic residues; thermostability
10.13995/j.cnki.11-1802/ts.201601005
硕士研究生(周晨妍副教授为通讯作者,E-mail:zhouchenyan2008@163.com)。
河南省教育厅科学技术研究重点项目(13A180861;14A180018);河南省高等学校青年骨干教师资助计划项目(2011GGJS-125);新乡医学院科研项目培育基金(2013ZD113);新乡医学院研究生科研创新支持计划资助项目(YJSCX20434Y)
2015-07-01,改回日期:2015-09-08
