紫外-等离子体复合诱变红曲霉产胞外多糖
2016-09-26蒋汶张庆庆汤文晶程亚运
蒋汶,张庆庆,汤文晶,程亚运
(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000)
紫外-等离子体复合诱变红曲霉产胞外多糖
蒋汶,张庆庆*,汤文晶,程亚运
(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000)
以红曲霉ZL307为出发菌株,采用紫外结合常压室温等离子体的复合诱变方法对其进行诱变。紫外诱变条件为:照射距离15 cm,功率15 W,时间90 s。等离子体诱变条件为:照射距离3 mm,注入气体氦气,气流量10 L/min,功率200 W,时间180 s。筛选得到具有良好遗传稳定性的菌株ZJ307-3,与原始菌株相比,发酵周期没有发生明显的改变,7 d时多糖产量达到550.07 mg/L,提高61.18%。复合诱变菌株多糖产量较单紫外诱变菌株提高27.58%,较单等离子体诱变菌株提高12.55%。
红曲霉;胞外多糖;紫外诱变;等离子体诱变
红曲霉是具有我国传统特色的丝状真菌[1],在我国已有1000多年药食两用的历史。红曲多糖作为红曲霉在生长过程中分泌的代谢产物,具有抗氧化、抗肿瘤、提高免疫力[2]等多种生物活性。
改良菌种的常用方法有诱变法和分子生物学法。常用诱变方法有物理诱变(如紫外线、X射线、γ射线、快中子)和化学诱变(如碱基类似物诱变剂、移码突变剂、烷化剂)[3]。紫外诱变具有方法简便、效果好、危险性小的特点[4],能使碱基转换、颠换、移码突变或缺失[5]是其诱导微生物产生突变的主要原因。常压室温等离子体诱变(Atmospheric and Room Temperature Plasma,ARTP)是近年来利用在大气压下产生的,温度在25~40 ℃之间,具有高活性粒子浓度的等离子体射流的新型诱变技术[6],具有操作简便、设备简单、条件温和、安全性高、诱变快速等优良特性。它的主要作用机理[7]是等离子体中的活性离子能使微生物细胞壁、膜的结构及通透性发生改变,并引起基因损伤,进而使微生物基因序列及其代谢网络发生显著变化,最终导致微生物发生突变。
目前关于紫外结合常压室温等离子体的复合诱变方法的研究较少,本文采用紫外-常压室温等离子体的复合诱变方法,对红曲霉进行诱变筛选,以期获得理想的红曲霉产胞外多糖菌株。
1 材料与方法
1.1材料与仪器
红曲霉ZL307(MonascusZL307),安徽工程大学实验室保藏菌种;斜面培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然;种子培养基(g/L):葡萄糖60,蛋白胨5,MgSO41,KH2PO42.5,NaNO33,pH 6.0;发酵培养基(g/L):葡萄糖25,蛋白胨15,pH 6.0;无水乙醇、苯酚、H2SO4等,国药集团化学试剂有限公司。
ARTP-II型常压室温等离子体诱变系统,北京思清源生物科技有限公司;TD5Z台式低速离心机,湖南凯达科学仪器有限公司;HH-4超净工作台,金坛市杰瑞尔电器有限公司;QHZ-123B组合式全温度振荡培养箱,太仓市华美生化仪器厂;LDZ-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;L5紫外分光光度计,上海仪电分析仪器有限公司;旋转蒸发仪,上海亚荣生化仪器厂。
1.2实验方法
1.2.1菌种选育
出发菌株→制备孢子悬浮液→稀释→诱变处理→涂平板→挑取单菌落斜面培养→摇瓶复筛→测定多糖产量
1.2.2培养条件
菌株斜面活化:30 ℃恒温培养7 d。种子摇瓶培养:100 mL种子液,30 ℃,150 r/min,3 d。发酵摇瓶培养:100 mL发酵液液,30 ℃,150 r/min,7 d。
1.2.3苯酚硫酸法测定红曲霉胞外多糖产量
1.2.3.1苯酚硫酸法标准曲线的制作[8]
准确称量105 ℃烘干至恒重的葡萄糖配制成0.1 mg/mL 的葡萄糖标准溶液,精密量取0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8,2.0 mL分别置于具塞比色管中,补加蒸馏水至2.0 mL。各加入体积分数为5%的苯酚溶液1.0 mL,摇匀后,加入浓硫酸5 mL,立即摇匀。置沸水浴中煮沸10 min,冷却至室温。以0号管调零点,在波长490 nm测定吸光值。以葡萄糖质量浓度(mg/mL)为横坐标,490 nm下的吸光值为纵坐标,线性回归求得总糖的曲线方程。
1.2.3.2胞外多糖的测定
发酵液经4 000 r/min离心5 min后,过滤除去菌丝体。真空蒸发浓缩至原体积的1/5,加入3倍体积的无水乙醇,3 ℃静置醇沉24 h。3 500 r/min离心10 min后,取沉淀60 ℃烘干至恒重。用蒸馏水溶解,弃去不溶物,定容至50 mL。量取2 mL多糖溶液于10 mL具塞试管中,加入体积分数为5%的苯酚溶液1 mL,摇匀。迅速滴加浓硫酸5 mL,充分摇匀。沸水浴中反应10 min,取出迅速冷却至室温,在490 nm处测定吸光值。对照标准曲线计算多糖浓度。
1.2.4诱变方法
1.2.4.1孢子悬浮液的制备
取斜面保藏的菌种接种到新的斜面中30 ℃活化培养7 d,取活化后的菌种接种至平板培养,30 ℃培养7 d。用无菌生理盐水将平板培养后的红曲菌孢子轻轻洗脱,充分振荡后过滤,制备成均匀的孢子悬液。用血球计数板测定制备的孢子悬浮液浓度,将孢子悬浮液用无菌生理盐水稀释至106~107个/mL备用。
1.2.4.2紫外诱变
取制备的孢子悬浮液15 mL加入无菌培养皿中,在搅拌子作用下置于15 W紫外灯前15 cm处进行照射。分别照射0,15,30,45,60,75,90,105和120 s后取出100 μL孢子悬浮液,将对照孢子悬液和诱变孢子悬液分别稀释至10-4。分别取0.1 mL涂布至平板上,30 ℃避光培养5 d,观察并记录菌落数,计算致死率[9]。
致死率/%=(对照生长菌落数-各诱变时间生长的菌落数/对照生长菌落数)×100
从平板上挑取与出发菌株相比,菌落直径较大、周边呈稠厚状者接种斜面培养基,并进行摇瓶复筛测定多糖产量[8],计算正突变率。
正突变率/%=(不同诱变时间组正突变株数目/突变株总数)×100
1.2.4.3等离子体诱变
等离子器照射条件:距离3 mm;注入气体为氦气;气流量10 L/min;照射功率200 W。取制备的孢子悬浮液10 μL涂布于直径0.5 cm的不锈钢载片上,处理时间依次为0,60,120,150,180,210,240 s。将载片放入装有 1 mL生理盐水的EP活化培养2 h,再以10 倍梯度稀释至10-4。分别取0.1 mL涂布至平板上,30 ℃避光培养5 d,观察并记录菌落数,计算致死率。从平板上挑取与出发菌株相比,菌落直径较大、周边呈稠厚状者接种斜面培养基,并进行摇瓶复筛测定多糖产量,计算正突变率。
1.2.4.4紫外与等离子体复合诱变
取制备的孢子悬浮液15 mL加入无菌培养皿中,在磁力搅拌下置于15 W紫外灯前15 cm处进行照射一定时间。取出100 μL孢子悬浮液,将此孢子悬浮液10 μL涂布于直径 0.5 cm 的不锈钢载片上,用等离子体处理一定时间。将载片放入装有1 mL生理盐水的EP活化培养2 h,再以10 倍梯度稀释至10-4。取0.1 mL涂布至平板上,30 ℃避光培养5 d,观察并记录菌落数,计算致死率。从平板上挑取与出发菌株相比,菌落直径较大、周边呈稠厚状者接种斜面培养基,并进行摇瓶复筛测定多糖产量,计算正突变率。
1.2.4.5诱变菌株的选育
按照最佳的诱变条件,选取诱变后多糖产量较高的红曲霉菌株连续传代5次测定其多糖产量。
1.2.5红曲霉诱变菌株与原始菌株产胞外多糖曲线的测定
将原始菌株和诱变菌株活化培养14 d,每隔24 h测定1次胞外多糖的产量。
2 结果与分析
2.1苯酚硫酸法标准曲线
对苯酚硫酸法标准曲线进行回归,得到葡萄糖含量(x)与吸光度(Y)之间的线性回归方程为:y=14.779x-0.031 4,相关系数R2=0.999 3。表明当其他条件不变,葡萄糖含量在0.01~0.10 mg/mL范围内变化时,吸光度与葡萄糖含量之间呈良好的线性关系。
2.2紫外(UV)诱变
由图1可知,随着紫外照射时间的延长,红曲霉孢子致死率由13%逐渐增加至93%,在75~105 s红曲霉孢子的致死率为70%到73%,较为稳定。而正突变率由7.2%逐渐增加至90 s的14.5%最高值后,90 s后的正突变率又逐渐下降。对致死率曲线进行回归,得到紫外线诱变时间(x)与孢子致死率(Y)之间的回归方程为:y=-0.004 1x2+1.203 6x+0.138 2 (R2=0.979 3)。当紫外功率和照射距离为定值时,紫外线强度一定,诱变时间长短反映了诱变剂量大小。从方程可知,紫外诱变剂量与孢子致死率之间在一定范围内存在复杂的多项式关系。

图1 不同紫外照射时间的致死率和正突变率Fig.1 The death rate and positive mutation rate of different UV irradiation time
随着照射时间的增加,菌株的突变优良可能性就越大,但是菌株的致死率也在不断上升,突变的优良菌株也有可能因此致死,不利于筛选。为了得到有利于生产上应用的正突变型菌株,往往采用致死70%~80%的诱变剂量[10]。在75~105 s,红曲霉菌株的致死率较稳定,均保持在70%左右,且菌株的正突变率在此照射区间内也相对较高。为了得到较稳定的突变株和获得较高的正突变率,确定90 s为红曲霉的最佳紫外诱变时间。
通过紫外诱变90 s,筛选得到5株多糖产量较高的菌株,命名为U1,U2,U3,U4,U5,如图2所示,发酵培养后测定其多糖产量分别为425.63,437.81,431.28,427.25、433.62 mg/L,相较于原始菌株分别提高24.73%,28.31%,26.38%,25.21%,27.07%。在此紫外诱变条件下,红曲霉产胞外多糖的能力产生了有了一定的提高,其产量均值提高26.33%。
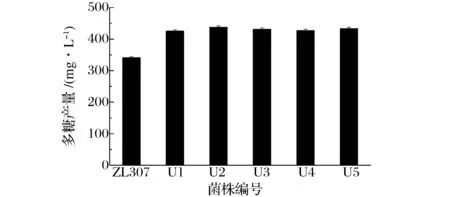
图2 紫外诱变菌株与原始菌株多糖产量的比较Fig.2 Comparison of the UV mutant strain and original strain on polysaccharide production
2.3等离子体(ARTP)诱变
由图3可知,随着诱变时间的延长,红曲霉孢子的致死率曲线呈直线上升,诱变时间达到180 s后,致死率已增至93%,当时间达到240 s时,致死率已达到100%。而正突变率由4.2%逐渐增加至180 s的16.5%,180 s后的正突变率又开始下降,不利于筛选优良的红曲霉突变菌株。对致死率曲线进行回归,得到等离子体诱变时间(x)与孢子致死率(Y)之间的回归方程为:y=-0.002 1x2+0.884 4x+5.048 5(R2=0.988 4)。当等离子流强度和照射距离为定值时,孢子接受等离子体剂量和诱变时间成正比,诱变时间长短反映了诱变剂量大小。从方程可知,等离子体诱变剂量与孢子致死率之间在一定范围内存在复杂的多项式关系。
通过与紫外诱变的结果对比分析可知,在相同的诱变时间下,等离子体诱变条件下的红曲霉致死率更低,红曲霉孢子对等离子体的耐受性更好。为了保持较适合的致死率和较高的正突变率,确定180 s为红曲霉最佳的等离子体诱变时间。

图3 不同等离子体诱变时间的致死率和正突变率Fig.3 The death rate and positive mutation rate of different ARTP mutation time
通过等离子体诱变180 s,筛选得到6株多糖产量较高的菌株,分别命名为A1、A2、A3、A4、A5、A6。如图4所示,发酵培养后测定其多糖产量分别为491.01,487.28,491.34,485.79,486.98,489.65 mg/L,相较于原始菌株分别提高43.89%,42.80%,43.99%,42.36%,42.71%,43.49%。在此等离子体诱变条件下,红曲霉产胞外多糖的能力产生了较为明显的改善,其产量均值提高43.21%。与紫外诱变相比,等离子体对提高红曲霉产胞外多糖的能力有着更好的效果。
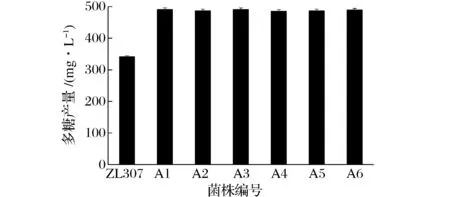
图4 等离子体诱变菌株与原始菌株多糖产量的比较Fig.4 Comparison of the ARTP mutant strain and parent strain on polysaccharide production
2.4紫外-等离子体复合诱变
由表1可知,相较于紫外诱变和等离子体诱变,复合诱变的致死率明显升高,均达到90%以上。当紫外诱变105 s,等离子体诱变210 s时,致死率已达到100%。
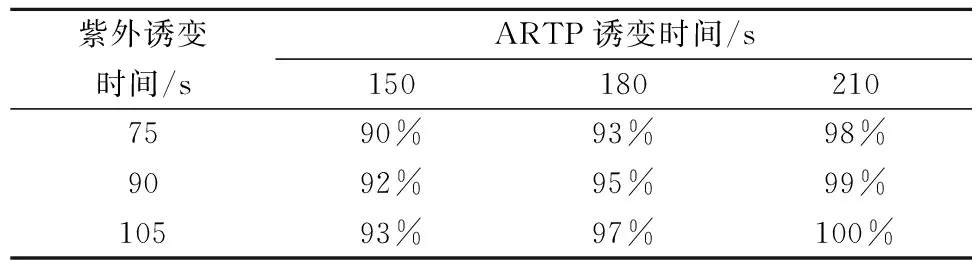
表1 不同紫外-等离子体复合诱变时间的致死率
由表2可知,相较于紫外诱变和等离子体诱变,复合诱变的正突变率也有较明显的提升。当紫外诱变90 s,等离子体诱变180 s时,正突变率达到最高值19.3%,而此时菌株的致死率为95%,在所有的复合诱变条件中较为温和。因而确定复合诱变的最佳条件为紫外诱变90 s,等离子体诱变180 s。
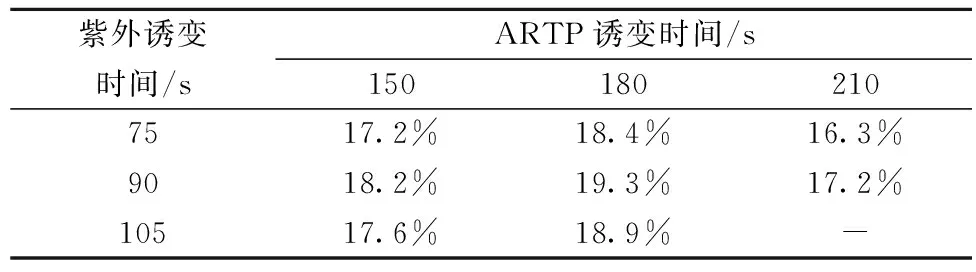
表2 不同紫外-等离子体复合诱变时间的正突变率
通过复合诱变筛选得到3株多糖产量较高的菌株,分别命名为ZJ307-1,ZJ307-2,ZJ307-3。由图5可知,其多糖产量分别为545.24,558.65,551.92 mg/L,较原始菌株分别提高59.78%,63.71%,61.74%,红曲霉产胞外多糖的能力有着较稳定的提高。其产量均值较紫外诱变菌株提高28.02%,较等离子体诱变菌株提高12.95%。可知将紫外与等离子体相结合应用于红曲霉产胞外多糖的诱变是可行的,比单一的诱变手段效果更加明显。

图5 诱变菌株与原始菌株的多糖产量比较Fig.5 Comparison of the mutant strain and parent strain on polysaccharide production
将突变菌株连续传代培养测定多糖含量,其遗传稳定性结果如图6所示。随着传代次数的增加,诱变菌株ZJ307-1、ZJ307-2的多糖产量均有所下降,产生了回复突变。ZJ307-3多糖产量出现了小幅波动,但基本维持在550 mg/L左右,遗传稳定性较好,较原始菌株其多糖产量提高61.18%,较紫外诱变菌株多糖产量提高27.58%,较等离子体诱变菌株多糖产量提高12.55%。实验结果表明ZJ307-3菌株多糖产量较高,并且具有良好的遗传稳定性。

图6 诱变菌株遗传稳定性实验Fig.6 Mutant strain genetic stability experiment
2.5红曲霉诱变菌株与原始菌株产胞外多糖曲线的测定
由图7可知,红曲霉诱变菌株ZJ307-3和原始菌株ZL307表现出相同的产胞外多糖特性。0~7 d,红曲霉胞外多糖产量不断升高,至发酵7 d时,多糖产量达到341.24 mg/L、550.07 mg/L,随后开始逐渐下降。原始菌株ZL307在7~9 d胞外多糖产量基本保持稳定,10 d后开始较为缓慢的下降。而诱变菌株ZJ307-3在发酵7 d达到最高值后,多糖产量开始迅速下降,至发酵后期多糖产量已接近原始菌株ZL307。诱变菌株ZJ307-3与红曲霉原始菌株ZL307相比,其发酵周期并没有发生明显的改变,最优产胞外多糖时间为7 d。

图7 红曲霉诱变菌株与原始菌株产胞外多糖曲线Fig.7 Extracellular polysaccharides production curve of the Monascus mutant strain and parent strain
2.6紫外-等离子体复合诱变红曲霉产胞外多糖的相关讨论
CARMEN等人[11]认为,胞外多糖是微生物在胞内合成后,分泌到细胞外的一类多糖,如荚膜多糖和生物被膜多糖[12]。当细胞壁和细胞膜的存在时,ARTP 产生的活性粒子并不能够直接作用于细胞内的生物大分子[13]。Rebenkov 等人[14]认为常压室温等离子体可以改变细胞膜的通透性。推测将紫外线与ARTP相结合应对红曲霉进行复合诱变,能充分利用紫外线对遗传物质的直接作用,改变红曲霉的遗传特性;同时结合ARTP对细胞整体特性的诱变效应,改变红曲霉细胞膜的通透性,从而提高了红曲霉胞外多糖的产量。将紫外与等离子体结合诱变红曲霉,对提高其胞外多糖的产量是可行的。
3 结论
本文以紫外和等离子体作为主要的诱变手段,探讨紫外-等离子体复合诱变红曲霉的可能性及最佳条件,以期获得理想的红曲霉菌株。实验结果表明:
将紫外与等离子体结合,对红曲霉进行复合诱变,以提高其胞外多糖的产量是可行的。这与沈小静[15]应用于筛选红霉素高产菌株、章丽[16]应用于筛选四羟基环孢菌素衍生物高产菌株的研究结果相一致。复合诱变中紫外诱变条件为:照射距离15 cm,功率15 W,时间90 s。等离子体诱变条件为:照射距离3 mm,注入气体氦气,气流量10 L/min,功率200 W,时间180 s。
通过复合诱变筛选得到具有良好遗传稳定性的菌株ZJ307-3。与原始菌株相比,其发酵周期没有发生明显的改变,7d时多糖产量达到550.07 mg/L,提高61.18%。张建[17]将紫外与微波结合应用于灰树花的诱变,多糖产量提高42.58%;祝子坪[18]将激光-紫外应用于桑黄菌的诱变,多糖产量提高36.88%。与已报道的研究结果相比,本文采用的紫外-等离子体的复合物理诱变方法更有优势。
复合诱变菌株的多糖产量,较单紫外诱变菌株提高27.58%,较单等离子体诱变菌株提高12.55%。与单一紫外诱变与等离子体诱变相比,紫外-等离子体复合诱变可以得到更好的效果。
物理诱变采用辐射中的各种射线为诱变源[19]对生物靶进行诱变,具有突变谱宽、操作简单的特点。然而物理诱变的实验操作通常需要一定仪器设备的支持,同时诱变处理的条件受到仪器设备自身的限制。物理诱变的回复率也较高,虽然本文所得的复合诱变菌株稳定性尚佳,但后续是否有变化仍有待进一步的实验观察。
[1]李雪梅,沈兴海,段震文,等.红曲霉代谢产物的研究进展[J].中草药,2011,42(5):193-200.
[2]汪鹏荣.一株高产胞外多糖红曲霉发酵和提取工艺及抗氧化活性研究[D].金华:浙江师范大学,2012.
[3]李鸿梅,苗琇岩,魏明,等.紫外与亚硝基胍复合诱变选育高产多糖罗耳阿太菌[J].食品工业科技,2014,35(20):244-247;262.
[4]刘延国.侧耳菌紫外诱变选育及发酵玉米秸秆营养价值的评定[D].哈尔滨:东北农业大学,2013.
[5]刘辉,张庆庆,吕闻闻.复合诱变选育高产γ-氨基丁酸菌株[J].安徽工程大学学报,2011,26(3):1-3.
[6]LU Y,WANG L,MA K,et al.Characteristics of hydrogen production of anEnterobacteraerogenesmutant generated by a new atmospheric and room temperature plasma (ARTP)[J].Biochemical Engineering Journal,2011,55(1):17-22.
[7]张雪.Rahnellasp.R3的诱变及其低温乳糖酶的分离纯化与性质研究[D].无锡:江南大学,2014.
[8]张建峰.红曲多糖高产菌株的诱变筛选及其提取纯化免疫活性研究[D].长春:吉林农业大学,2005.
[9]张帝,张庆庆,汤文晶,等.He-Ne激光对红曲霉ZL307的诱变育种[J].安徽工程大学学报,2013,28(4):4-7.
[10]王丽宁,赵妍,张宝粉,等.利用原生质体紫外诱变技术选育耐高温香菇菌株[J].微生物学通报,2014,41(7):1 350-1 357.
[11]IGLESIAS-de la cruz C,RUIZ-TORRES P,DELMORAL RG,et al.Age-related progressive renal fibrosis in rats and its prevention with ACE inhibitors and taurine[J].American Journal of Physiology-renal Physiology,2000,278(1): 122-129.
[12]郭守东.微生物胞外多糖的结构及其抗氧化活性研究[D].青岛:中国海洋大学,2010.
[13]张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2 676-2 684.
[14]RYBENKOV VV,VOLOGODSKII AV,COZZARELLI NR.The effect of ionic conditions on dna helical repeat,effective diameter and free energy of supercoiling[J].Nucleic Acids Research,1997,25(7):1 412-1 418.
[15]沈小静,张萍,石彦鹏.常压室温等离子体结合紫外诱变筛选红霉素高产菌株[J].中国兽药杂志,2015,49(1): 19-23.
[16]章丽,戴梦,郑桂珍,等.等离子体-紫外复合诱变选育四羟基环孢菌素衍生物高产菌株[J].微生物学杂志,2014,34(1):68-71.
[17]张建.物理法诱变灰树花液体发酵米糠麸皮产多糖的研究[D].镇江:江苏大学,2010.
[18]祝子坪.桑黄菌的物理诱变与发酵研究[D].镇江:江苏大学,2007.
[19]汪杏莉,李宗伟,陈林海,等.工业微生物物理诱变育种技术的新进展[J].生物技术通报,2007(2):114-118.
Research on screening and breeding ofMonascuson the production of extracellular polysaccharides by UV-ARTP composite mutagenesis
JIANG Wen,ZHANG Qing-qing*, TANG Wen-jing, CHENG Ya-yun
(Biochemical Engineering College, Anhui Polytechnic University, Wuhu 241000, China)
The parent strainMonascusZL307 was mutated by UV-ARTP composite mutagenesis. The UV mutation conditions were as follows: the distance was 15 cm and the time of irradiation was 90 s with a 15 W ultraviolet lamp. The ARTP mutation conditions were as follows: the distance was 3 mm, the injected gas was helium with a rate of 10 L/min, the irradiation power was 200 W and the time was 180 s. ZJ307-3, a higher production of polysaccharide strain,was obtained. The genetic stability of this strain was well. There were no significant changes during its fermentation period. Its polysaccharide production reached 550.07 mg/L on day 7. Its polysaccharide production was 61.18% higher than that of parent strain. The polysaccharide production of the composite mutant strain was 27.58% higher than that of the UV mutant strain and 12.55% higher than that of the ARTP mutant strain.
Monascus; extracellular polysaccharide; UV mutagenesis; ARTP mutagenesis
10.13995/j.cnki.11-1802/ts.201601012
硕士研究生(张庆庆教授为通讯作者,E-mail:zhangqq@ahpu.edu.cn)。
安徽高校省级自然科学研究重点项目(KJ2009A034);芜湖市重点科技项目(芜科计字[2009]190号)
2015-08-13,改回日期:2015-10-09
