人参多糖检测方法及提取工艺优选
2016-09-25肖志伟乐智勇朱国雪梁生旺
肖志伟,乐智勇,朱国雪,梁生旺*
(1.广东药学院 国家中医药管理局中药数字化质量评价技术重点研究室,广东 广州 510006;2.康美(北京)药物研究院有限公司,北京 102629;3、广东药学院,广东 广州 510006)
人参多糖检测方法及提取工艺优选
肖志伟1,乐智勇2,朱国雪3,梁生旺1*
(1.广东药学院 国家中医药管理局中药数字化质量评价技术重点研究室,广东 广州510006;2.康美(北京)药物研究院有限公司,北京102629;3、广东药学院,广东 广州510006)
目的:优选人参多糖检测方法和最佳提取工艺。方法:对比几种检测人参多糖方法的结果,优选人参多糖检测方法;采用正交试验法,以多糖提取率为考察指标,以加水量、提取时间、提取次数为考察因素,优选人参多糖提取工艺。结果:人参最佳检测方法为苯酚-硫酸法;最佳提取工艺为加水量12倍,每次提取1h,提取3次。结论:苯酚-硫酸法检测人参多糖含量准确性高,方法稳定可行;优选工艺操作简单,提取率高,稳定可行。
多糖检测;人参多糖;水提工艺;正交试验
人参为五加科植物人参PanaxginsengC.A.Mey.的干燥根。具有大补元气、复脉固脱、补脾益肺、生津、安神之功能[1]。人参主要化学成分为多种人参皂苷、糖类、挥发油、氨基酸、有机酸及酯、维生素以及多种微量元素等[2]。现代药理研究表明,人参皂苷具有增强免疫力[3]、抗肿瘤、抗衰老、抗病毒、保护心肌细胞[4]等作用;人参多糖在机体免疫调节[5]、降血糖[6]、抗氧化[7]、抗辐射[8]等方面亦具有显著的药理作用。由于人参多糖的活性、相对分子量、溶解度和结构的不同,不同的处理方法对其含量检测的影响比较大。近年人参提取多为单一类成分的提取,利用率偏低。因此,本文对人参多糖检测方法和人参醇提后的药渣水提的提取工艺进行研究,为提高人参多糖检测准确性和人参的利用率提供参考。
1 仪器与材料
1.1仪器
UV-2401PC型紫外分光光度计(杭州库仑科技有限公司);AL204型电子天平[梅特勒-托利多仪器(上海)有限公司];XW-80A型旋涡混合仪(上海五九自动化设备有限公司);低速台式离心机800B(上海安亭科学仪器厂);DHG-9001-1s型电热恒温鼓风干燥箱(成都浩驰仪器有限公司)。
1.2材料
人参购自康美(毫州)世纪国药中药有限公司;亚甲蓝(国药集团化学试剂有限公司,批号:20150317);D-无水葡萄糖(中国食品药品检定研究院,批号:110833-201205,含量≥99.5%);无水乙醇、浓硫酸、苯酚、磷酸氢二钠、磷酸二氢钠、蒽酮、硫酸铜、酒石酸钾钠、氢氧化钠、亚铁氰化钾均为分析纯;水为双蒸水。
2 方法与结果
2.1人参药材预处理
取人参药材,加10倍量浓度为70%的乙醇水溶液,提取3次,每次提取3h,滤过,回收提取人参皂苷后的残留物,烘干备用。
2.2葡萄糖对照品溶液的制备
准确称取105℃干燥至恒重的D-无水葡萄糖0.5g,加水溶解,并定容至50mL,此溶液质量浓度为10mg·mL-1,用前稀释100倍(质量浓度为0.1mg·mL-1)。
2.3供试品溶液的制备
称取预处理过的人参药材50g,加入15倍量的水,100℃水浴提取3次,每次3h[9],滤过,合并滤液,浓缩,加无水乙醇调浓度至80%,4℃冷藏,静置4h。离心,弃去上清液,沉淀烘干作粗多糖样品备用。精密称取粗多糖样品50mg,用蒸馏水溶解,并定容于50mL容量瓶中,制成一定浓度的多糖储备液,备用。精密量取多糖储备液2mL于25mL容量瓶中,用蒸馏水稀释到刻度,备用。
2.4多糖检测方法研究
2.4.1苯酚-硫酸法 精密量取供试品溶液2mL于25mL比色管中,加入5%苯酚溶液1.0mL,在旋涡混合器上混匀,小心加入浓硫酸10mL,在旋涡混合器上小心混匀,置沸水浴中2min,冷却至室温。以蒸馏水为空白参比,在200~800nm波长范围进行扫描,确定最大吸收波长[10]。
准确吸取葡萄糖对照品溶液0.10、0.20、0.40、0.60、0.80、1.00mL,置于25mL比色管中,加水至2.0mL,按2.4.1方法测定吸光度值(A)。以葡萄糖质量为横坐标,吸光度值(A)为纵坐标进行线性回归。
2.4.2蒽酮-硫酸法 精密量取供试品溶液2mL于25mL比色管中,加入0.1%蒽酮-硫酸溶液6mL,在旋涡混合器上混匀,沸水浴加热10min,取出,在流水中冷却20min。以蒸馏水为空白参比,在400~900nm波长范围进行扫描,确定最大吸收波长[10]。
准确吸取葡萄糖对照品溶液0.10、0.20、0.40、0.60、0.80、1.00mL置于25mL比色管中,加水至2.0mL,按2.4.2方法测定吸光度值(A)。以葡萄糖质量为横坐标,吸光度值(A)为纵坐标进行线性回归。
2.4.3碱性酒石酸铜滴定法 精密量取供试品溶液1.5mL于10mL离心管中,加入15mL浓盐酸,沸水浴加热2h,冷却,用氢氧化钠溶液调pH至6.8~7.2,移至200mL容量瓶中,加水定容,滤纸滤过,滤液作为待测液备用。
标定碱性酒石酸铜液:用定量移液管吸取碱性酒石酸铜液甲、乙各5mL于150mL锥形瓶中,加10mL蒸馏水及数粒玻璃珠。用滴定管加入9.0mL葡萄糖对照品溶液于锥形瓶中,并将锥形瓶放在电炉上于2min内加热至沸腾,并保持微沸状态。用葡萄糖对照品溶液滴定溶液至蓝色刚褪去为终点,记录消耗葡萄糖对照品溶液的体积。平行3次,取平均值[10]。
供试品溶液测定:按2.4.3方法,用供试品溶液滴定终点。平行3次,取平均值。
2.4.4多糖含量检测结果 见表1。

表1 多糖含量检测结果
2.4.5 检测方法重复性研究 按上述方法测定供试品溶液多糖含量,分别重复测定6次。3种检测方法RSD值见表2。

表2 检测方法重复性
由以上的结果可知苯酚-硫酸法准确率高,稳定可行,因此以下研究选择苯酚-硫酸法作为人参多糖的检测方法。
2.5苯酚-硫酸法方法学研究
2.5.1人参多糖最大吸收波长的选择 精密量取供试品溶液2mL于25mL比色管中,加入5%苯酚溶液1.0mL,在旋涡混合器上混匀,小心加入浓硫酸10mL,在旋涡混合器上混匀,置沸水浴中2min,冷却至室温。以蒸馏水为空白参比,在200~800nm波长范围进行扫描,确定最大吸收波长为486nm。
2.5.2标准曲线的制备 准确吸取葡萄糖对照品溶液0.10、0.20、0.40、0.60、0.80、1.00mL(分别相当于葡萄糖0.01、0.02、0.04、0.06、0.08、0.10mg)置于25mL比色管中,加水至2.0mL,按2.4.1项下方法测定吸光度值(A)。以葡萄糖质量为横坐标,吸光度值(A)为纵坐标进行线性回归,得线性回归方程Y=5.1159X+0.0068,r=0.9994。结果表明,葡萄糖进样浓度在9.422~99.924μg·mL-1线性关系良好。
2.5.3精密度试验 精密吸取葡萄糖对照品溶液0.80mL于具塞试管中,按苯酚-硫酸法测定A值,重复测定6次,结果A值的RSD为0.978%,表明该方法精密度良好。
2.5.4稳定性试验 精密吸取供试品溶液1.0mL于具塞试管中,按苯酚-硫酸法测定A值,每隔10min测定一次,测定2h。然后每隔20min测定一次,测定2h。再每隔30min测定一次,测定2h。结果A值RSD为0.952%,表明供试品溶液在6h内稳定性良好。
2.5.5重复性试验 取一批样品,按2.3项下方法平行制备6份供试品溶液,分别精密吸取供试品溶液1.0 mL于具塞试管中,按苯酚-硫酸法测定A值,结果A值的RSD为1.984%,表明该方法重复性良好。
2.5.6 加样回收率试验 精密量取0.5 mL葡萄糖对照品溶液,加入0.5 mL供试样品溶液,平行6份,按苯酚-硫酸法测定A值,计算回收率。结果平均回收率为101.34%,RSD值为1.638%[11]。
3 正交试验优化水提工艺
3.1试验方案设计
以多糖提取率为考察指标,采用L9(34)正交试验对加水量(A)、提取时间(B)、提取次数(C)3个因数进行考察。因素水平见表3。
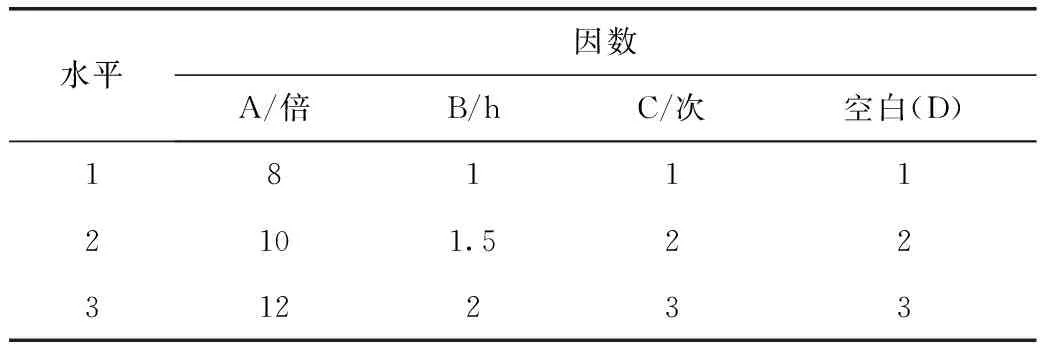
表3 L9(34)因素水平表
3.2样品溶液制备
取9份经过预处理的人参药渣,每份50g,按正交设计方案提取,过滤,滤液浓缩,加无水乙醇调浓度至80%,4℃冷藏静置4h,离心,弃去上清液,沉淀,用蒸馏水溶解,定容,备用。
3.3样品溶液含量测定
吸取上述溶液稀释至合适浓度,按苯酚-硫酸法测定A值,计算多糖提取率。正交试验结果见表4,方差分析结果见表5。

表4 L9(34)正交试验设计与结果
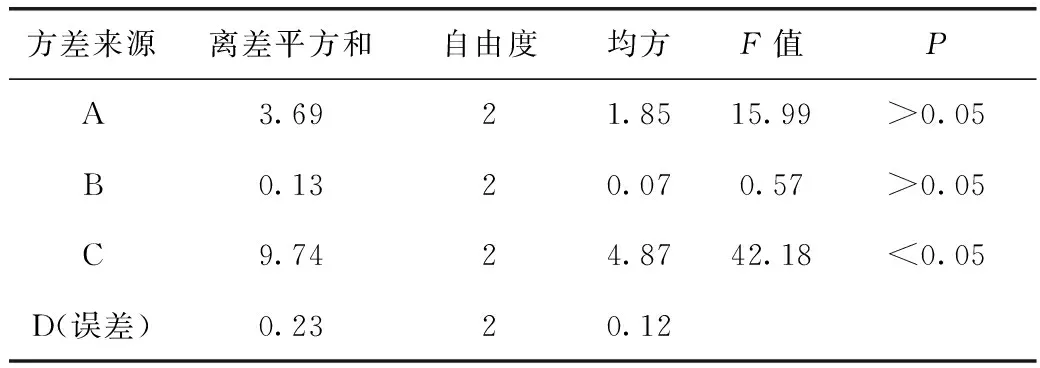
表5 方差分析表
注:F0.05(2,2)=19;F0.01(2,2)=99;P<0.05。
由表4可知各因素对多糖提取率的影响排序为C>A>B。由表5方差分析可知3个因素中提取次数(C)差异有统计学意义(P<0.05),其余各因素差异无统计学意义(P>0.05)。结合实际情况确定最佳提取条件为A3B1C3,即12倍加水量,每次提取1 h,提取3次。
3.4最佳工艺验证试验
取3批平行样品,按最佳工艺提取,测定多糖含量,计算提取率,结果见表6,表明该工艺稳定可行。
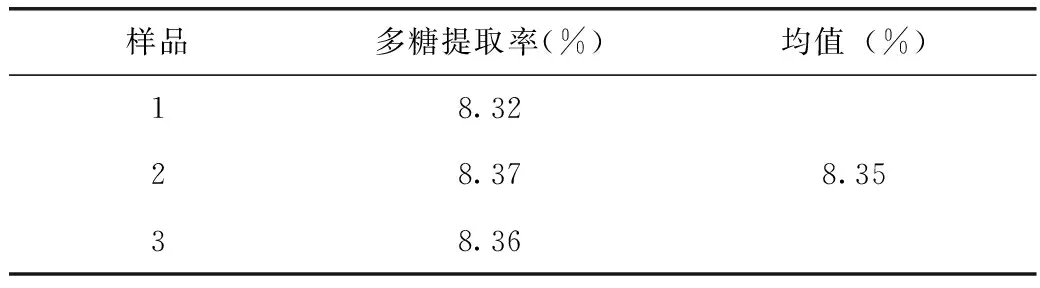
表6 最佳工艺验证结果
4 讨论
人参多糖的检测方法很多,过去研究多为某单一方法的研究,并未对几种检测方法进行对比研究,对人参药材醇提后水提的多糖是否适用也没有研究。本试验对苯酚-硫酸法、蒽酮-硫酸法、碱性酒石酸铜滴定法3种方法进行对比研究,优选出最佳的方法,并对选择的方法进行方法学考察,确定其适用于醇提后人参药渣水提的多糖检测。
人参糖类物质成分复杂,有单糖、低聚糖和多糖,经乙醇沉淀纯化的多糖是可溶于水、不溶于醇的极性大分子化合物。蒽酮-硫酸法准确率高,但对纯化过程要求高,重复性较差;碱性酒石酸铜滴定法需要将大分子多糖酸解成单糖标定,对操作过程要求高,准确率与重复性都不足;苯酚-硫酸法操作简单、准确率高、重复性良好,是检测多糖优选的方法。
本试验以经过70%乙醇水溶液提取3次,每次3h,然后烘干的人参为样品,通过正交试验考察,得到人参经过醇提后多糖水提的最佳工艺:加水量为12倍,每次提取时间为1h,提取3次。在最佳提取条件下,人参多糖的提取率约为8.35%,充分提取了人参药材的多糖,提高了人参药材的利用率。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010.
[2] 郑宏钧,詹亚华.现代中药材鉴别手册[M].北京:中国医药科技出版社,2001.
[3] 马肃,王北辰,吕俊华,等.人参茎叶皂苷对小鼠免疫功能的影响[J].中国病理生理杂志,1991,7(2):126-128.
[4] 何道同,王兵,陈珺明,等.人参皂苷药理作用研究进展[J].辽宁中医药大学学报,2012,14(7):118-121.
[5] 宋卫岗,郭实士,易有年.人参多糖对小鼠免疫功能的影响[J].湖南医科大学学报,1991,16(2):107.
[6] 南敏伦,赵昱玮,吕娜,等.人参多糖的化学结构及其降血糖活性研究进展[J].中国药房,2014,25(17):4506-4508.
[7] 潘延啟,文全泰,黄礼德,等.土人参多糖的抗氧化活性研究[J].时珍国医国药,2014,25(1):30-31.
[8]HanY,SonS,AkhalaiaM,etal.Modulationofradiation-induceddisturbancesofantioxidantdefensesystemsbyginsan[J].EvidBasedComplementAlternatMed,2005,2(4):529.
[9] 宋利华,萧伟,鹿丽丽,等.正交试验优选人参多糖的提取工艺[J].中草药,2012,2(43):283-287.
[10] 白鸿.保健食品功效成分检测方法[M].北京:中国中医药出版社,2011.
[11] 王丹,吕永磊,徐丽媛,等.人参多糖含量测定方法研究[J].中华中医药杂志,2011,26(4):774-776.
OptimizationofDetectionMethodandExtractionTechnologyofGinsengPolysaccharides
XIAOZhiwei1,LEZhiyong2,ZHUGuoxue3,LIANGShengwang1*
(1.GuangdongPharmaceuticalUniversity,KeyLaboratoryofDigitalQualityEvaluationTechniqueofTraditionalChineseMedicine(TCM),StateAdministrationof(TCM),Guangzhou510006,China;2.BeijingKangmeiPharmaceuticalResearchInstituteCo.Ltd,Beijing102629,China;3.GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Objective:To optimize the detection method and extraction technology of ginseng polysaccharides.Methods:The ginseng polysaccharide detection method was optimized by comparing the results of several detection methods.The extraction technology of polysaccharide fromPanaxginsengwas optimized by orthogonal test with amount of water,extraction time and extraction times as factors and with the content of polysaccharide as index.Results:The best detection method of ginseng polysaccharides was the method of phenol vitriol,the optimal condition of extraction technology was as following:12-folds water,extraction time of1.0h,extraction times of three times.Conclusion:The method of phenol vitriol is high accuracy and the extraction technology is simple,stable and practical with high extraction rate.
Polysaccharide detection;ginseng polysaccharide;water-extraction technology;orthogonal test
10.13313/j.issn.1673-4890.2016.1.015
2015-10-20)
*
梁生旺,教授,研究方向:中药质量控制;Tel:(020)39352172,E-mail:swliang371@163.com