人参锈腐菌Cylindrocarpondestructans侵染对人参生理指标的影响△
2016-09-25高原丁万隆龙期良李勇
高原,丁万隆,龙期良,李勇
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
人参锈腐菌Cylindrocarpondestructans侵染对人参生理指标的影响△
高原,丁万隆,龙期良,李勇*
(中国医学科学院 北京协和医学院 药用植物研究所,北京100193)
人参锈腐菌Cylindrocarpondestructans是为害人参的重要病原菌之一,在东北三省人参产区每年造成人参减产35%左右,损失极大。本文通过研究接种锈腐菌0d,0.25d,0.5d,1d,4d,7d和12d后人参叶片中丙二醛和脯氨酸含量及人参根系活力生理指标变化情况,了解锈腐菌的侵染过程对人参生长的影响。试验结果表明,人参叶片中丙二醛和脯氨酸含量变化与锈腐菌侵染进程正相关,根系活力变化与侵染过程无明显相关关系。
人参锈腐菌;丙二醛;脯氨酸;根系活力
人参PanaxginsengC.A.Meyer为五加科人参属多年生药用植物,常用于治疗气虚、心神不定、惊悸健忘等,具有极高的药用价值[1]。但是,人参由野生变栽培后病害发生加剧,其中人参锈腐菌Cylindrocarpondestructans是为害最为严重的病害之一,整个生长季均可导致病害发生[2]。人参遭受锈腐菌侵染后,参苗会做出应答反应,某些生理指标也会发生相应变化。植物体内的膜系统对维持代谢平衡起到重要作用,病原菌产生的代谢产物会破坏寄主植物细胞膜蛋白结构进而导致膜系统损伤[3]。脯氨酸是植物抵御逆境胁迫的一类渗透调节物质,大量研究证明,脯氨酸积累与逆境胁迫程度正相关[4]。根系最先感受到胁迫,并迅速将胁迫信号传导至整个植株,以便各个器官做出相应的防御反应。此外,根系活力也是衡量逆境胁迫的重要指标。根系的健康状况和活力水平直接对植物地上部分的营养状况和代谢平衡产生影响[5-6]。为此,本文研究了锈腐菌侵染对人参苗叶片中脯氨酸含量、丙二醛含量和根系活力生理指标变化的影响,为深入研究抗病机理,控制人参锈腐菌为害提供理论依据。
1 材料与方法
1.1供试材料
1.1.1植物材料 供试植物材料为三年生健康人参苗,取自中国医学科学院药用植物研究所实验基地。
1.1.2供试菌株 人参锈腐菌C.destructans由课题组分离保存。
1.1.3供试培养基 PDA培养基:鲜土豆200g,葡萄糖20g,琼脂17g,蒸馏水1L,pH7.0。
1.2方法
1.2.1病原菌鉴定 病原菌形态观察:将病原菌接种到PDA培养基上,25℃恒温培养7d后,显微镜观察菌落形态。病原菌致病性:采用室内盆栽接种。将病原菌孢子悬浮液接种到室内盆栽的健康三年生人参苗根部,接种浓度为5.25×106cfu·mL-1,接种量40mL,对照接种等量无菌水,接种后的植株继续在室内花盆中生长,定期观察发病情况。病原菌rDNA-ITS序列分析:挑取足量病原菌菌丝体,在液氮冷却状态下磨成粉末,用真菌基因组DNA提取试剂盒提取DNA,DNA提取液直接用于PCR扩增。用真菌rDNA-ITS区段通用引物ITS1(5’-TCCGTAGGT-GAACCTGCGG-3’)、ITS4(5’-TCCTCCGCTTATTG-ATATGC-3’)扩增病原菌基因组DNA。扩增程序为94℃预变性5min,94℃变性1min,55℃退火30s,72℃延伸1min,32个循环;最后72℃延伸10min[7]。扩增产物经过纯化测序,测序结果经BLAST与NCBI数据库中已知序列进行比对,结合形态学特征,参照《真菌鉴定手册》进行鉴定。
1.2.2植物材料接种方法及样品采集 选取三年生的健康人参苗,用50%多菌灵溶液浸泡灭菌10min,再用蒸馏水冲洗3次。将人参苗移栽到装有无菌石英砂的塑料盒中,每盒36株,在16h光照/8h黑暗,25℃室温环境下培养,霍格兰营养液[8]为人参苗提供营养。待人参苗叶片完全展开后,处理组接种浓度为3.9×107cfu·mL-1的病原菌孢子悬浮液250mL,对照组只接种等量霍格兰营养液。分别从对照组和处理组采集0h,6h,12h,1d,4d,7d和12d的人参叶片和须根,每个处理设3次重复。
1.2.3测定方法 人参叶片丙二醛含量测定采用硫代巴比妥酸法[9]:称取叶片样品1g,加入少量石英砂和10%三氯乙酸2mL,研磨至匀浆,再加8mL10%三氯乙酸进一步研磨,匀浆以4000×g离心10min。吸取上清液2mL,加入2mL0.6%硫代巴比妥酸溶液,混匀后在沸水浴中反应15min,迅速冷却后再离心。取上清液分别在波长532nm、600nm和450nm处比色,以空白试验作参比测定吸光度,根据标准曲线计算丙二醛含量。
人参叶片脯氨酸含量测定采用酸性茚三酮法[10]:称取叶片样品0.5g,用3%磺基水杨酸溶液研磨提取,磺基水杨酸最终体积为5mL。匀浆转入玻璃离心管中,在沸水浴中提取10min。冷却后过滤,滤液即为脯氨酸提取液。吸取2mL提取液,加入2mL冰醋酸和2mL酸性茚三酮溶液,在沸水浴中显色30min。冷却后,加入4mL甲苯萃取红色物质。静置后,吸取上层红色液体于比色杯中,以甲苯为空白对照,用分光光度计在波长520nm处比色,根据标准曲线计算脯氨酸含量。
人参根系活力测定采用TTC法[11]:称取根尖样品0.5g,放入小烧杯中,加入0.4%TTC溶液和磷酸缓冲液的等量混合液10mL,把根充分浸没在溶液内,在37℃下暗保温1~2h,之后立即加入1mol·L-1硫酸2mL,终止反应。把根取出,吸干水分,放入研钵中,加乙酸乙酯3~4mL充分研磨。将研磨液移入试管,并用少量乙酸乙酯洗涤残渣3次,最后加乙酸乙酯至总量为10mL,用分光光度计在波长485nm下比色,以空白试验作参比测出吸光度,查标准曲线,可求出TTC还原量,进而计算根系活力。
2 结果与分析
2.1病原菌鉴定
病原菌形态:观察培养的病原菌菌落呈深褐色。显微镜下观察发现,病原菌孢子为圆柱形,两端钝圆,有隔膜,与人参锈腐菌形态一致[12]。
病原菌致病性:接种14d后观察发现,人参苗根部出现病斑,症状与田间发病的人参相同。将发病部位病原菌进行分离,可得到与原接种菌一致的病原菌。
病原菌分子鉴定:病原菌基因组DNA经ITS1和ITS4扩增后得到长度为518bp的扩增条带,通过与已知序列比对发现,扩增得到的条带与人参锈腐菌C.destructans(GenBank:EF607078)的ITS序列同源性为99%,综合形态学观察、致病性测定及ITS分析结果,最终确定本研究所用病原菌为人参锈腐菌C.destructans。

图1 病原菌菌丝及孢子形态特征

图2 病原菌序列与人参锈腐菌C.destructans比对结果
2.2人参锈腐菌侵染后人参叶片丙二醛含量变化
由图3可知,对照组人参叶片丙二醛含量变化不大,而处理组人参叶片丙二醛含量变化显著。接种12h后,丙二醛含量稍有降低,接种4d后,丙二醛含量开始逐渐升高,并在接种12d后达到峰值。此时处理组人参叶片开始出现发黄,萎蔫等现象。
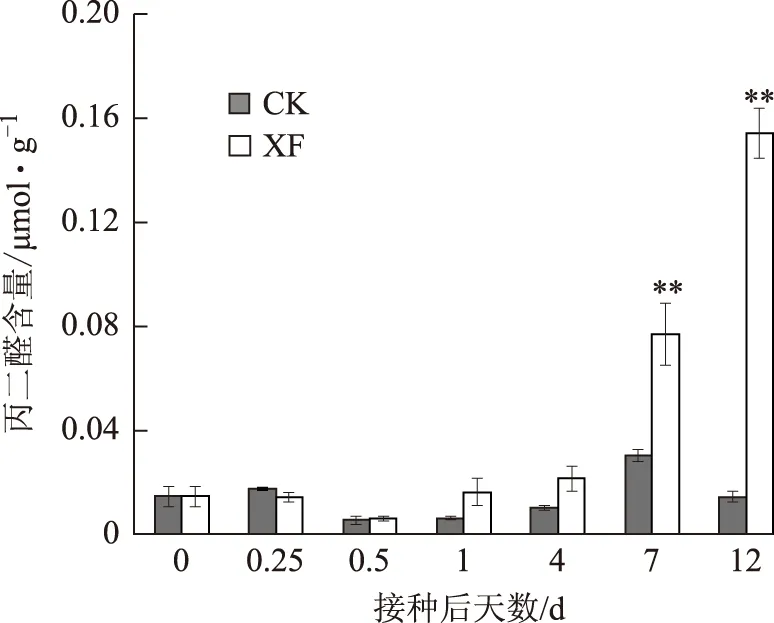
CK:对照组人参叶片丙二醛含量;XF:处理组人参叶片丙二醛含量**与0点对照相比在P<0.01水平存在极显著差异,下同图3 人参叶片丙二醛含量随病菌接种时间的变化
2.3人参锈腐菌侵染后人参叶片脯氨酸含量变化
由图4可知,对照组人参叶片脯氨酸含量无明显变化。处理组人参叶片脯氨酸含量与丙二醛含量的变化趋势类似,在接种12h后脯氨酸含量稍有降低,从接种4d后脯氨酸含量开始明显上升,在接种后7d达到峰值,接种后12d时叶片脯氨酸含量与7d时相当。
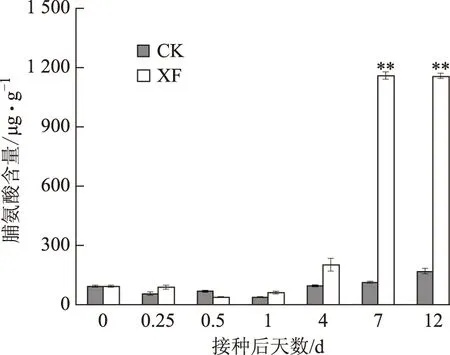
CK:对照组人参叶片脯氨酸含量;XF:处理组人参叶片脯氨酸含量图4 人参叶片脯氨酸含量随病菌接种时间的变化
2.4人参锈腐菌侵染后人参根系活力变化
由图5可知,不同于丙二醛和脯氨酸,对照组与处理组人参根系活力均有明显变化。对照组人参根系活力在12h时降低,从1d时开始升高至4d时达到峰值,之后略有下降。处理组在接种6h后根系活力明显升高,接种12h后急剧下降,接种1d后升高达到峰值,至接种12d缓慢降低。
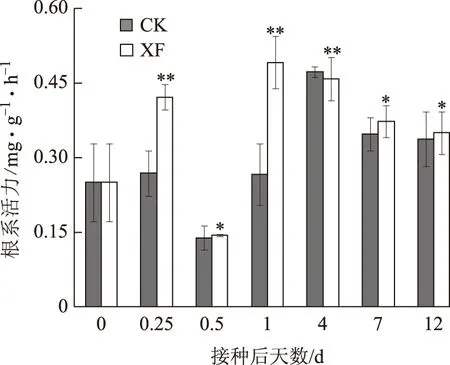
CK:对照组人参苗不同时期根系活力;XF:处理组参苗不同时期根系活力;*:与0点对照相比在P<0.05水平存在显著差异图5 人参苗根系活力随病菌接种时间的变化
3 讨论
丙二醛是植物体内膜质过氧化的产物,对植物有一定危害。丙二醛含量变化能反映植物受胁迫的程度[13]。本研究中处理组人参苗在接种12h后丙二醛含量略有降低,说明此时人参根细胞感受到病菌侵染,且已启动防御反应。随着接种时间延长,人参体内代谢平衡被破坏,活性氧累积导致人参内膜系统损伤。因此,接种4d后丙二醛含量开始上升,至12d达到最大值,人参叶片外观出现明显发黄萎蔫现象,已无法进行正常的代谢活动。
脯氨酸是植物内一种调节物质,其含量变化能一定程度上反映植物对逆境的适应性[14]。另外,脯氨酸在植物体内有束水能力,对维持酶活性及细胞膜透性、稳定蛋白质特性有重要作用[15]。本实验结果表明,处理组人参苗叶片脯氨酸含量在接种7d后达到最大值,表明人参苗已感受到环境的严重胁迫,因此大量合成脯氨酸来调节自身代谢以抵抗病原菌侵染[16-17]。接种7~12d后人参叶片脯氨酸含量基本未发生变化,说明脯氨酸仅能在一定范围内起调节作用,这与张景云等[18]的研究结论一致。
根系作为植物与外界环境直接接触的器官,在植物响应环境胁迫中至关重要。保持较高根系活力是植物响应逆境胁迫的体现[19]。本研究中不论对照组还是处理组,人参根系活力变化都相对复杂,主要因为根系最早感应逆境,并做出有利自身的防御反应[20-21]。处理组在接种早期(6~24h)根系活力显著提高,并在接种4d后根系活力达到最大值,说明人参在接种早期就能够感受到病原菌侵染,并迅速做出防御反应。接种12h后对照组和处理组根系活力均急剧降低,推测可能是接种时对照组与处理组分别浇灌250mL霍格兰营养液和锈腐菌孢子悬浮液,对人参苗根系形成了轻微的淹水胁迫。连洪燕等[22]通过实验证实植物根系活力随着淹水胁迫时间延长而下降,因此两组参苗的根系活力有所降低。处理组在接种4d后根系活力逐渐减弱,推测可能是逆境造成叶片损伤,向根部输送的光合产物减少,导致根部生理功能减弱[23]。结合丙二醛、脯氨酸含量变化以及外观形态的变化情况,我们发现锈腐菌侵染人参后,人参根系活力变化要迟于叶片生理指标变化,表明生理指标变化存在差异可能与植物抵抗病原菌侵染机制密切相关。
[1] 李珊珊,金银萍,姚春林,等.人参多糖的结构与活性研究进展[J].中国中药杂志,2014,39(24):4709-4715.
[2] 刘延硕,郜玉钢,王南,等.人参锈腐菌侵染参根后防御酶变化的分析[J].特产研究,2011,(1):50-54.
[3] 梁喜龙,郑殿峰,左豫虎,等.病害逆境下寄主植物生理生化指标的研究现状与展望[J].安徽农业科学,2006,34(15):3576-3578,3581.
[4] 焦蓉,刘好宝,刘贯山,等.论脯氨酸累积与植物抗渗透胁迫[J].中国农学通报,2011,27(7):216-221.
[5] 左文博,吴静利,杨奇,等.干旱胁迫对小麦根系活力和可溶性糖含量的影响[J].华北农学报,2010,25(6):191-193.
[6] 杨传杰,罗毅,孙林,等.水分胁迫对覆膜滴灌棉花根系活力和叶片生理的影响[J].干旱区研究,2012,29(5):802-810.
[7] 李勇,刘时轮,杨成民,等.北京地区柴胡根腐病的病原菌鉴定[J].植物病理学报,2009,39(3):314-317.
[8] 陈超,赵丽丽,任登鸿,等.不同营养液对香根草生长的影响[J].贵州农业科学,2014,42(5):86-88.
[9]DraperHH,SquiresEJ,MahmoodiH,etal.Acomparativeevaluationofthiobarbituricacidmethodsforthedeterminationofmalondialdehydeinbiologicalmaterials[J].FreeRadicBiolMed,1993,15(4):353-363.
[10]RienthM,RomieuC,GreganR,etal.Validationandapplicationofanimprovedmethodfortherapiddeterminationofprolineingrapeberries[J].JAgricFoodChem,2014,62(15):3384-3389.
[11] 郑坚,陈秋夏,金川,等.不同TTC法测定枫香等阔叶树容器苗根系活力探讨[J].浙江农业科学,2008,(1):39-42.
[12] 严雪瑞,傅俊范.柱孢属(Cylindrocarpon)真菌和参类锈腐病的研究历史与现状[J].沈阳农业大学学报,2002,33(1):71-75.
[13] 史俊卿,张浩,于红威,等.立枯丝核菌毒素对人参防御酶活性及丙二醛含量的影响[J].湖南农业大学学报(自然科学版),2010,36(4):434-436.
[14] 武永军,何国强,史艳茹,等.不同pH值缓冲液处理下蚕豆叶片相对含水量、脯氨酸及丙二醛含量的变化[J].干旱地区农业研究,2009,27(6):169-172.
[15] 李海燕,刘惕若,甄艳.辣椒品种对疫病的抗性研究——脯氨酸、丙二醛与可溶性糖在抗病中的作用[J].中国农学通报,2006,22(11):315-317.
[16] 宋敏丽.茄子嫁接抗黄萎病与叶片叶绿素含量、相对电导率和游离脯氨酸含量的关系[J].山西农业科学,2007,35(4):51-53.
[17] 郭红莲,陈捷,高增贵,等.游离脯氨酸在玉米灰斑病抗性机制中作用的研究[J].玉米科学,2003,11(1):83-85.
[18] 张景云,白雅梅,缪南生,等.盐胁迫对不同耐盐性二倍体马铃薯叶片质膜透性、丙二醛和脯氨酸含量的影响[J].作物杂志,2013(4):75-80.
[19] 董守坤,赵坤,刘丽君,等.干旱胁迫对春大豆叶绿素含量和根系活力的影响[J].大豆科学,2011,30(6):949-953.
[20]WuB,LongQ,GaoY,etal.Comprehensivecharacterizationofatime-coursetranscriptionalresponseinducedbyautotoxinsinPanaxginsengusingRNA-Seq[J].BMCGenomics,2015,16(1):1010.
[21] 孔涛,姜飞,丁永发,等.嫁接番茄不同生育期抗病性及其与根际环境的关系[J].山东农业科学,2014,46(1):94-96.
[22] 连洪燕,权伟,芦建国.淹水胁迫对石楠幼苗根系活力和光合作用影响[J].林业科技开发,2009,23(2):51-54.
[23] 宋慧,冯佰利,高小丽,等.不同品种小豆根系活力与叶片衰老的关系[J].西北植物学报,2011,31(11):2270-2275.
InfluenceofCylindrocarpondestructansInfectiononPhysiologicalCharactersofPanaxginseng
GAOYuan,DINGWanlong,LONGQiliang,LIYong*
(InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100193,China)
Cylindrocarpondestructansis a destructive pathogen that causing severely rust rot ofPanaxginseng.In northeast region of China,C.destructanscause significantly yield decline approximately35% annually.In the present work,leaves and fibrous roots ofP.ginsengthat infected byC.destructans0,0.25,0.5,1,4,7and12days after inoculation were sampled,and changes on the content of malondialdehyde,proline,and root activity of them were examined.Results showed that the content variation of malondialdehyde and proline in leaves ofP.ginsengwere improved along with the inoculating time,while there has no obvious correlation between variation of root activity andC.destructansinfection.
Cylindrocarpondestructans;malondialdehyde;proline;root activity
10.13313/j.issn.1673-4890.2016.1.011
2015-12-12)
中医药行业科研专项(201407005);协和青年基金项目(3332013113)
*
李勇,副研究员,研究方向:药用植物病害生物防治关键技术研究;Tel:(010)57833360,E-mail:liyong@implad.ac.cn