猪FoxN1基因转录变异体亚细胞定位研究
2016-09-24张冬杰
张冬杰,李 苓,汪 亮,刘 娣,
(1.黑龙江省农业科学院畜牧研究所,哈尔滨 150086;2.东北农业大学动物科学技术学院,哈尔滨 150030)
猪FoxN1基因转录变异体亚细胞定位研究
张冬杰1,李苓2,汪亮1,刘娣1,2
(1.黑龙江省农业科学院畜牧研究所,哈尔滨150086;2.东北农业大学动物科学技术学院,哈尔滨150030)
FoxN1基因主要表达于胸腺上皮细胞和皮肤角质细胞,在胸腺发育、T细胞增殖、毛发生长、指甲发育等方面发挥重要作用。FoxN1基因存在多种转录变异体,人类FoxN1基因已发现18种转录变异体。转录变异体的存在使基因差异表达和蛋白质多样性存在可能。为深入研究转录变异体生物学功能,研究将前期发现的猪FoxN1基因3种转录变异体分别连入pEGFP-N1载体内,构建各自融合蛋白,转入猪PK15细胞,利用荧光显微镜观察转录变异体亚细胞定位情况。结果表明,pEGFP-N1空载体转染表达绿色荧光蛋白在PK15细胞核和细胞质均匀分布,而重组载体pEGFP-N1-FoxN1(a/b/c)表达的融合蛋白仅在细胞核内均匀分布。结果可为3种转录变异体后续功能研究奠定基础。
猪;FoxN1基因;转录变异体;细胞定位
网络出版时间2016-8-24 15:04:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1504.014.html
张冬杰,李苓,汪亮,等.猪FoxN1基因转录变异体亚细胞定位研究[J].东北农业大学学报,2016,47(8):55-59.
Zhang Dongjie,Li Ling,Wang Liang,et al.Research on the subcellular localization of pig transcriptional variants ofFoxN1 gene[J].Journal of Northeast Agricultural University,2016,47(8):55-59.(in Chinese with English abstract)
裸鼠(Nude mouse)是医学研究领域中重要实验动物模型,主要表现为无毛及先天性胸腺缺陷。Frank等研究发现,造成该表型主要原因是一个被称作FoxN1(Forkhead box protein N1)的基因发生突变,导致该基因功能丧失[1]。Prowse和Lee等研究表明,FoxN1是叉头框蛋白家族一员,该基因家族是一类DNA结合区具有翼状螺旋结构的转录因子,目前已有17个亚族。失去FoxN1蛋白活性的人和小鼠会出现少发、免疫缺陷(胸腺和T细胞缺失)及皮肤缺损[2-3]。Corbeaux等研究发现,FoxN1基因仅在多层上皮细胞结构组织内表达,如胸腺和皮肤,FoxN1对胸腺内T细胞发育起决定性作用[4]。皮肤中,FoxN1主要在滤泡上皮细胞和毛囊内表达[5]。小鼠皮肤基底层细胞第一层和一些表皮基底细胞均表达FxoN1。FoxN1表达模式与角质细胞形成与分化一致,过表达或缺失FoxN1功能将导致分化畸形。且FoxN1控制滤泡上皮细胞和毛囊细胞增殖与分化平衡。此外,角质细胞表达的FoxN1还可促进成纤维细胞生长因子2(Fibroblast growth factor 2,Fgf2)分泌,Fgf2可激活生黑色素细胞释放色素,且可作为一种促细胞分裂剂促进上皮细胞周围细胞增殖。
FoxN1基因有多重转录变异体,目前已知人有18种转录变异体(Gene ID:8456),小鼠有5种(Gene ID:15218),牛有5种(Gene ID:516724),鸡有3种(Gene ID:417570),石斑鱼有2种(Gene ID:266748)。真核生物前体mRNA(pre-mRNA)选择性剪切是控制基因表达和产生蛋白质多样性重要机制[6]。每种转录变异体均会行使相似或不同生物学功能。本课题组在前期研究中发现,猪FoxN1基因存在3种转录剪切变异体[7]。为深入了解这3种不同剪切变异体是否行使不同生物学功能,本研究拟利用pEGFP-N1真核表达系统,对FoxN1基因3种转录剪切变异体亚细胞定位。为后续开展生物学功能研究奠定基础。
1 材料与方法
1.1材料
新生民猪仔猪5头,购自黑龙江省农业科学院畜牧研究所民猪保种场。断颈屠宰后,取胸腺组织100 mg,置于无RNA酶1.5 mL EP管内,液氮保存带回实验室,用于后续RNA提取。
1.2RNA提取及反转录
使用Invitrogen公司生产Trizol试剂,按照李红然等方法[8],提取胸腺组织内总RNA。1%琼脂糖凝胶电泳检测RNA完整性,严格按照罗氏反转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit)说明书合成cDNA,反应结束后,cDNA置于-20℃保存备用。
1.3PCR扩增与序列测定
将反转录合成的5头民猪胸腺组织cDNA等体积混合,构建成1个cDNA池。以cDNA池为模板,参照李苓等设计引物序列[7],两端分别引入HindⅢ和Bam HⅠ酶切位点,引物序列如下:F:5'AAGCTTATGGTGTCACTACTCCCGCCACAGT 3' R:5'GGATCCCAAGCGAGGGCCATGGGCTTGGAG 3'(下划线为引入酶切位点序列),扩增猪FoxN1基因完整编码区。因为存在剪切变异,预期会获得3条条带,长度分别为1 941 bp(a)、1 677 bp(b)和1 944 bp(c)。扩增结束后,利用天根生化科技有限公司生产胶回收试剂盒分别回收上述3条条带,连入pGM-T载体,分别构建pGM-T-Foxn1(a/b/c)3种连接产物,将连接产物转化入大肠杆菌DH5α感受态细胞,过夜培养后,挑取阳性克隆菌株,LB液体培养基活化后,送吉林库美公司测序。
1.43种变异体重组质粒构建
将测序结果正确的3个重组质粒pGM-T-FoxN1 (a/b/c)和pEGFP-N1载体分别用HindⅢ和Bam HⅠ两种内切酶双酶切。50 μL酶切反应体系如下:质粒25.0 μL,HindⅢ和Bam HⅠ各4.0 μL,Buf⁃fer 25.0 μL,H2O 12.0 μL。37℃恒温培养箱过夜酶切。反应结束后取2 μL酶切产物琼脂糖凝胶电泳,进一步确定目的条带大小是否与预期位置一致。剩余产物用于胶回收。酶切产物经回收纯化后得到目的片段和线性pEGFP-N1载体。按如下体系连接:pEGFP-N1 1.0 μL,目的片段4.0 μL,10×Li⁃gase Buffer 1.0 μL,T4DNA Ligase 0.8 μL,H2O 3.2 μL。上述反应混合液16℃过夜连接。连接产物转化入大肠杆菌DH5α感受态细胞,过夜培养后,挑取阳性克隆菌株,LB液体培养基活化后,送吉林库美公司测序。选取测序结果正确质粒,重新转化与单克隆培养,LB液体培养基活化后,按照天根生化科技有限公司生产高纯度质粒小提中量试剂盒(TIANpure Midi Plasmid Kit)说明书提取高纯度质粒。
1.5PK15细胞培养
从液氮中取出冻存PK15细胞冻存管立即投入37℃水浴,快速晃动直至管中液体完全溶解。将细胞冻存液吹匀后转移至离心管中,1 mL DMEM吹洗冻存管1~2次后将液体转移至离心管中。1 000 r·min-1离心5 min。弃上清,以4 mL体系补全培养基后转移至培养皿中,37℃、5%CO2培养箱中培养;24 h后用新鲜完全培养基给细胞换液,继续培养。经2~3次细胞传代,待细胞生长旺盛,适应培养环境时,转染。
1.6融合载体瞬时转染与检测
参照Invitrogen公司Lipofectamine 2000TM转染说明试验,确定适合PK15细胞转染最佳质粒与转染试剂比例。具体步骤如下:转染前一天用胰蛋白酶消化细胞,将细胞接种于24孔板内,接种细胞的细胞数量以第二天融合度能达到80%~90%为宜。将待转染质粒(μg)与转染试剂(μL)比例定为1 ϑ 1~1 ϑ 3,各组待转染质粒浓度不变,转染试剂依次递增0.2 μL。取0.8 μg pEGFP-N1空质粒稀释于无血清DMEM培养液内,终体积为50 μL,温和混匀,室温孵育5 min。取相应体积转染试剂分别稀释于无血清DMEM培养液内,终体积为50 μL,温和混匀,脂质体孵育时间<5 min。将稀释质粒溶液与对应转染试剂溶液温和混匀,总体积为100 μL,室温孵育20 min。弃去24孔板内原细胞培养液,DMEM清洗各孔细胞2次,向每孔内添加400 μL无血清DMEM培养液。20 min孵育结束后,将100 μL混合液加入各孔内,混匀。将转染细胞置于37℃,5%CO2培养箱内培养4~6 h后换液,更换为含20%血清DMEM培养液,24 h后荧光倒置显微镜下检测各组细胞转染效率。
筛选确定PK15细胞转染最佳质粒与转染试剂比例后,瞬时转染。按照Lipofectamine 2000TM转染说明操作。转染24 h后,PBS清洗细胞3次,加ADPI(1 ϑ 50,PBS稀释,避光操作),孵育30 min;PBS洗3遍,每孔加入1 mL PBS(防止细胞死亡);荧光倒置显微镜下选取形态良好细胞,观察记录pEGFP-N1空质粒与pEGFP-FoxN1融合蛋白绿色荧光并观察与记录。
2 结果与分析
2.1pGM-T-FoxN1(a/b/c)质粒和pEGFP-N1质粒双酶切结果
pGM-T-FoxN1(a/b/c)质粒和pEGFP-N1质粒同时Bam HⅠ和HindⅢ双酶切,并检测酶切产物琼脂糖凝胶电泳。经紫外凝胶成像系统观察,pGM-T-FoxN1(a/b/c)重组质粒和pEGFP-N1质粒双酶切后分别得到1 941、1 677、1 944 bp两端带有酶切位点的FoxN1基因片段和pEGFP-N1空载体片段,如图1所示。
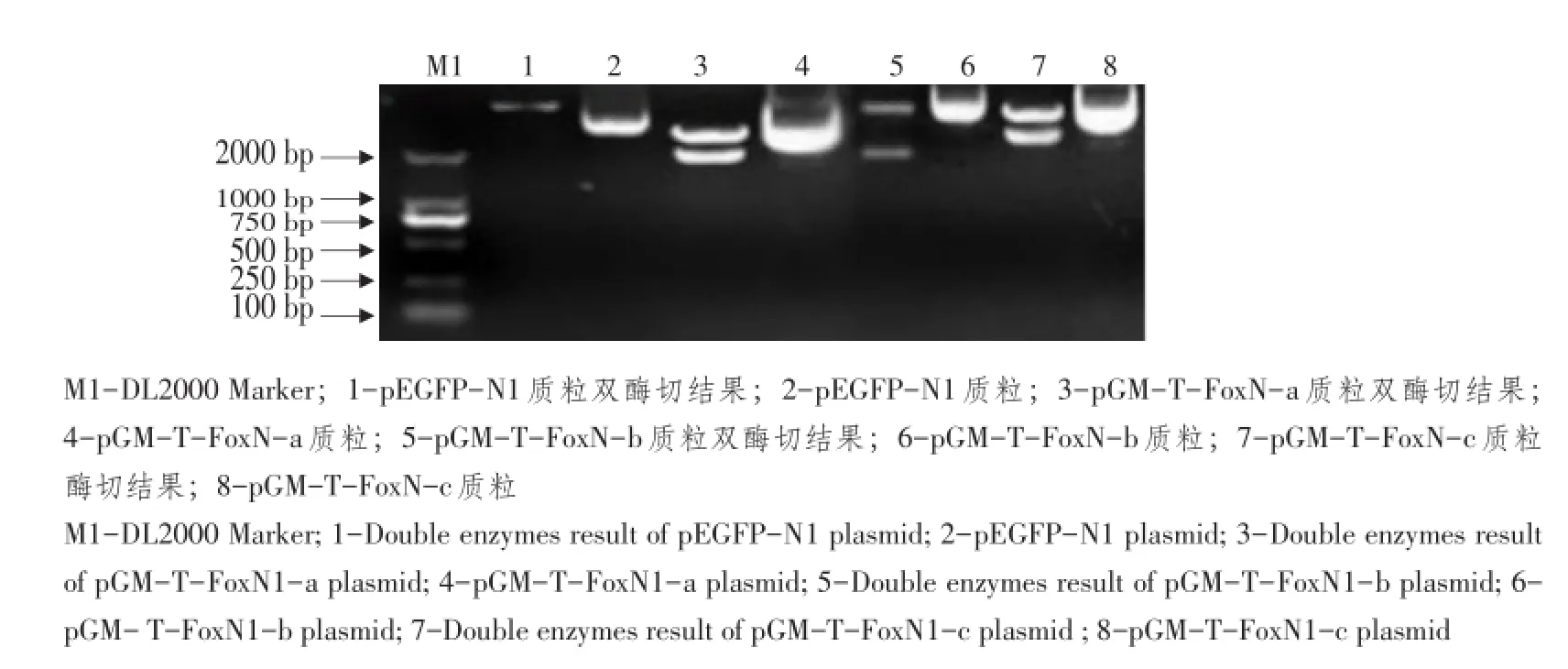
图1 pEGFP-N1质粒和pGM-T-FoxN1(a/b/c)质粒双酶切结果Fig.1 Double enzymes results of pEGFP-N1 plasmid and pGM-T-FoxN1(a/b/c)plasmid
2.2构建pEGFP-N1-FoxN1(a/b/c)重组质粒
连接转化纯化回收FoxN1(a/b/c)基因片段与pEGFP-N1质粒片段,构建pEGFP-N1-FoxN1(a/ b/c)重组质粒,以LB固体培养基生长阳性克隆菌落为模板PCR,琼脂糖凝胶电泳检测,分别在1 941、1 677和1 944 bp位置获得单一DNA条带,结果见图2。证明pEGFP-N1-FoxN1(a/b/c)重组质粒构建成功。
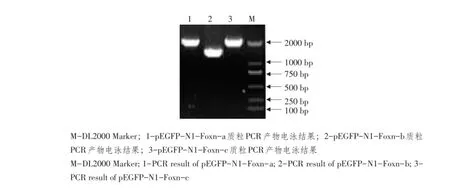
图2 pEGFP-N1-FoxN1(a/b/c)重组质粒PCR鉴定结果Fig.2 PCR identification results of pEGFP-N1-FoxN1(a/b/c)recombinant plasmid
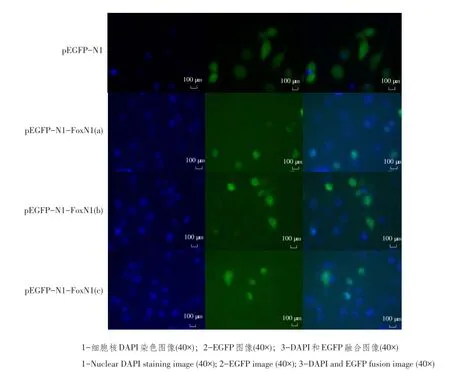
图3 瞬时转染24 h后pEGFP-N1-FoxN1(a/b/c)亚细胞定位结果(40×)Fig.3 Subcellular location results of pEGFP-N1-FoxN1(a/b/c)through transient transfection for 24 h(40×)
2.3瞬时转染重组质粒pEGFP-N1-FoxN1(a/b/c)亚细胞定位结果
瞬时转染pEGFP-N1空质粒和pEGFP-N1-FoxN1 (a/b/c)重组质粒24 h后,显微镜下观察到pEGFPN1空载体转染细胞发出绿色荧光信号定位于整个细胞中(主要包括细胞核和细胞质)。融合蛋白pEGFPN1-FoxN1(a/b/c)产生的绿色荧光信号全部定位于细胞核,细胞质无绿色荧光信号,且在细胞核内,绿色荧光呈斑点样分布,不同变异体间无差异。说明FoxN1蛋白是一种核表达蛋白(见图3)。
3 讨论与结论
FoxN1是一个保守的转录因子,在皮肤中调节角蛋白表达。FoxN1一旦缺失或发生突变,会导致毛干由于角质化缺陷而在毛囊中卷曲,无法穿透表皮形成正常毛发。同时,依赖于角蛋白的皮肤和指甲也会出现明显发育缺陷。胸腺中主要功能分为胚胎期和出生后两个阶段,胚胎期主要调控胸腺上皮细胞增殖,促进胸腺上皮前体细胞向皮质和髓质上皮细胞分化;出生后主要维持胸腺生理功能[8]。目前,关于FoxN1基因功能的研究还在继续深入[9-10],但对其不同转录变异体研究鲜有报道。从NCBI数据库中已提交数据获悉,很多物种FoxN1基因存在多种转录变异体。
转录变异体在mRNA前体经5'戴帽、剪接和3'加尾等修饰为成熟mRNA过程中产生,可由一个基因产生若干具有独特结构和功能的蛋白异构体,极大提高一因多效功能。研究表明,约94%人类基因会发生选择性剪切,形成大量不同转录变异体,出现不同甚至是完全相反功能。虽然各种生物基因组存在大量转录变异体,但研究集中在医学肿瘤疾病方面。已知不同转录变异体对肿瘤形成、治疗及预后关系存在不同效应[11-13]。
目前针对FoxN1基因不同转录变异体是否具有不同生物学功能尚未见报道,但FoxN1基因是一个具有明显组织表达特异性的基因,目前已知仅在胸腺、皮肤和舌中表达,且对其生长、发育起重要调控作用。表达有限性、功能重要性及结构复杂性,说明对该基因还需开展更深入研究。本研究仅从亚细胞定位角度分析猪FoxN1基因3种转录变异体,发现3种转录变异体均位于细胞核中,尚无法区分三者间是否存在功能差异。今后需从转录水平及功能分析等角度开展深入研究。
[1]Frank J,Pignata C,Panteleyev AA,et al.Exposing the human nude phenotype[J].Nature,1999,398(6727):473-474.
[2]Prowse D M,Lee D,Weiner L,et al.Ectopic expression of the nude gene induces hyperproliferation and defects in differentia⁃tion:implications for the self-renewal of cutaneous epithelia[J]. Dev Biol,1999,212(1):54-67.
[3]Lee D,Prowse D M,Brissette J L.Association between mouse nude gene expression and the initiation of epithelial terminal dif⁃ferentiation[J].Dev Biol,1999,208(2):503-515.
[4]Corbeaux T,Hess I,Swann J B,et al.Thymopoiesis in mice de⁃pends on a Foxn1-positive thymic epithelial cell lineage[J].Proc Natl Acad Sci USA,2010,107(38):16613-16618.
[5]Weiner L,Han R,Scicchitano B M,et al.Dedicated epithelial re⁃cipient cells determine pigmentation patterns[J].Cell,2007,130 (5):932-942.
[6]党万太,周京国,谢文光.基因转录剪接体:潜在的病变位点[J].中华临床医师杂志:电子版,2013,7(23):10846-10849.
[7]李苓,张冬杰,汪亮,等.民猪FoxN1基因的克隆及生物信息学分析[J].中国畜牧兽医,2016,43(4):928-933.
[8]李红然,张连军,赵勇.Foxn1在胸腺上皮细胞发育分化中的关键调控作用[J].细胞与分子免疫学杂志,2010,26(11):1161-1163.
[9]O'Neill K E,Bredenkamp N,Tischner C,et al.Foxn1 is dynami⁃cally regulated in thymic epithelial cells during embryogenesis and at the onset of thymic involution[J].PLoS One,2016,11(3): e0151666.
[10]Gao Y,Wang X,Yan H,et al.Comparative Transcriptome anal⁃ysis of fetal skin reveals key genes related to hair follicle morpho⁃genesis in cashmere goats[J].PLoS One,2016,11(3):e0151118.
[11]左波,李玫,刘玉兰,等.G蛋白偶联受体34转录变异体在结肠癌中的表达及其潜在意义[J].中华临床医师杂志:电子版,2013, 7(8):3377-3383.
[12]周永柏,张亚历,王继德,等.XAF1转录变异体在胃肠道肿瘤细胞株中的表达及意义[J].胃肠病学和肝病学杂志,2015,24 (11):1380-1383.
[13]孟化,戴德坚,陆才德.Survivin转录变异体在胃癌组织中的表达及其与预后的关系[J].中华胃肠外科杂志,2005,8(3):234-236.
Research on the subcellular localization of pig transcriptional variantsofFoxN1 gen e
/ZHANG Dongjie1,LI Ling2,WANG Liang1,LIU Di1,2(1.Institute of Animal Husbandry,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China;2.School of Animal Science and Technology,NortheastAgricultural University,Harbin 150030,China)
FoxN1 gene was mainly expressed in thymic epithelial cell and skin keratinocytes.It played important roles in thymus development,T cell proliferation,hair growth and nail development.There were many transcriptional variants in theFoxN1 gene.It had been found 18 transcriptional variants in human FoxN1 gene.The presence of transcriptional variants made it possible of gene differential expression and protein diversity.In previous study,three transcriptional variants of pigFoxN1 gene were found.In order to deep research on the functional of every transcriptional variant,three transcriptional variants of pigFoxN1 gene were connected with pEGFP-N1 vector.Fusion protein of everyone was constructed and transfected in PK15 cell.The results showed that,only EGFP expression could be detected in PK15 cell nucleus and cytoplasm.Three fusion proteins only could be detected in cell nucleus.This result could prove the basic knowledge for further research on pigFoxN1 gene.
pig;FoxN1 gene;transcript variant;cellular localization
S828;Q343.1+7
A
1005-9369(2016)08-0055-05
2016-05-27
国家自然科学基金项目(31301955);国家生猪产业体系岗位科学家项目(CARS-36);黑龙江省自然科学基金项目(C201312)
张冬杰(1980-),女,副研究员,博士,研究方向为猪分子遗传育种。E-mail:djzhang8109@163.com
刘娣,教授,博士生导师,研究方向为猪遗传育种。E-mail:nkyliudi2016@163.com
