一株DBP高效降解菌的筛选及降解特性研究
2016-09-24王丽华陈艺洋周长健付嘉伟范新会
张 颖,王丽华,陈艺洋,王 蕾,周长健,付嘉伟,范新会
(东北农业大学资源与环境学院,哈尔滨 150030)
一株DBP高效降解菌的筛选及降解特性研究
张颖,王丽华,陈艺洋,王蕾,周长健,付嘉伟,范新会
(东北农业大学资源与环境学院,哈尔滨150030)
邻苯二甲酸二丁酯(DBP)属邻苯二甲酸酯(PAEs),DBP与基质间非共价键连接,是环境污染物。由于DBP性质相对稳定,微生物降解是其降解主要途径。试验从荒废污染设施土壤中成功筛选一株DBP高效降解菌,经16S rRNA比对与剑菌(Ensifer sp.)相似度为99%,将其命名为DNB-S2。经研究发现DNB-S2最适生长条件为:温度35℃;pH 7.0;DBP浓度500 mg·L-1;转速125 r·min-1。DNB-S2能利用高浓度DBP,在500 mg·L-1DBP浓度下,48 h内降解率达95%。底物广谱性研究发现DNB-S2可降解PAEs家族中其他污染物邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)。为PAEs污染的生物降解提供理论基础和技术支持。
邻苯二甲酸酯(PAEs);邻苯二甲酸二丁酯(DBP);降解菌;广谱性
网络出版时间2016-8-24 15:04:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1504.012.html
张颖,王丽华,陈艺洋,等.一株DBP高效降解菌的筛选及降解特性研究[J].东北农业大学学报,2016,47(8):46-54.
Zhang Ying,Wang Lihua,Chen Yiyang,et al.Study on isolation and identification of a Di-n-butyl phthalate(DBP)-degrading strain and its degradation characteristics[J].Journal of Northeast Agricultural University,2016,47(8):46-54.(in Chinese with English abstract)
邻苯二甲酸酯(Phthalate ester,PAEs),又称酞酸酯,是工业生产中塑料增塑剂。PAEs广泛应用于化妆品、汽车内饰、家具、食品包装、医疗器械、手套、儿童玩具生产等[1-2]。邻苯二甲酸二丁酯(DBP)是PAEs中重要化合物,是工业产品(柔性PVC材料)和家居产品(油漆、胶水、农用塑料薄膜等)重要添加剂[3-4]。DBP除具有生殖毒性。神经毒性外,还具有致癌、致畸、致突变毒性,目前,中国、美国等国家和国际机构将DBP列为环境优先控制污染物[5-8]。
由于DBP与PVC树脂间并非以共价键而以范德华力连接,DBP在塑料制品中呈游离状态,在塑料生产和使用过程易于扩散到环境中[9],成为一种普遍环境污染物。目前,DBP导致的环境污染及对人类健康造成危害已受到广泛关注。DBP是一种持久性有机污染物,在自然条件下光解和水解缓慢。微生物降解被认为最重要的PAEs类污染物降解方式[10]。目前,国内外研究者已筛选出大量DBP降解菌,如节杆菌(Arthrobacter sp.)[6]、假单胞菌(Pseudomonas sp.)[11]、抗辐射菌(Deinococcus sp.)[12]、粘质沙雷氏菌C9(Serratia marcescens C9)[13]、红球菌(Rhodococcus sp.)[14-15]、分枝杆菌(Mycobacterium sp.)[16]、大头茶菌(Gordonia sp.)[17]、农杆菌(Agro⁃bacterium sp.)[18]等。关于剑菌属细菌(Ensifer sp.)降解DBP的研究尚未见报道。
本研究在污染较为严重荒废设施土壤中分离鉴定一株DBP高效降解菌,分析其生长及降解特性,通过株降解广谱性研究,了解该菌株实际修复适用范围,为PAEs污染的生物降解提供理论基础和技术支持,为污染环境的生物修复和清洁生产提供新方法。
1 材料与方法
1.1材料
1.1.1供试土壤
黑龙江省哈尔滨市郊区荒废污染的设施土壤中,取5~20 cm深土壤样品200 g,盛入已灭菌防水纸袋内,取回后于-80℃冰箱保存。
1.1.2供试培养基
无机盐液体培养基(g·L-1):K2HPO4·3H2O 1.0 g,MgSO4·7H2O 0.4 g,NaCl,1.0 g,CaCl2·2H2O 0.075 g,FeCl3·6H2O 0.01 g,NH4NO30.5 g,pH 7.0,121℃(1.05 MPa)条件下灭菌20 min;LB液体培养基(g·L-1):牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,pH 7.0,121℃(1.05 MPa)条件下灭菌20 min。固体培养基分别在上述液体培养基中加琼脂15~20 g·L-1。
1.1.3主要仪器与设备
HZS-H恒温水浴摇床(哈尔滨东联公司);万分之一电子天平(北京赛多利斯);灭菌锅(上海申安公司);UV-1800型紫外可见分光光度计(日本岛津公司);Microfμge 22R低温离心机(德国Beck⁃man公司);LC-20ADXR型液相色谱仪(日本岛津公司);PCR仪(北京东胜)。
1.2方法
1.2.1DBP降解菌富集分离
DBP降解菌分离参照耿印印等方法[19]。取土样100 g于已灭菌大三角瓶中,在瓶中加入新鲜塑料碎屑。加入适量无菌水使土壤含水量保持在50%,放入恒温箱中富集两周,定期通气,并定期加水搅拌保证土壤湿度不变。称取富集土壤样品10 g,置于已灭菌150 mL三角瓶中,加入100 mL无菌水,放置于150 r·min-1摇床中震荡20 min,制成菌悬液。采用梯度压力驯化法培养,配置以DBP作为唯一碳源和能源固体无机盐培养基,通过稀释涂平板法初筛,选择生长状态良好,形态不同菌落,多次平板划线法复筛,直至分离得到单菌落。
1.2.216S rRNA基因序列PCR扩增、测序及分析
1.2.2.1降解菌株DNA提取
采用无机盐培养基培养菌株24 h,10 000 r·min-1离心3 min,去除上清液,收集菌体,重复2~3次,获得足够菌体。加入450 μLTEN、0.25 mol·L-1EDTA(pH 8.0)50 μL,振荡均匀,加入50 μL 10% SDS,5 μL蛋白酶K(20 mg·L-1),混匀后置于37℃恒温水浴锅水浴1 h。加入100 μL(5 mol·L-1)NaCl,80 μL CTAB/NaCl溶液混匀,置于65℃水浴锅水浴10 min。加入相同体积酚/氯仿/异戊醇(25 ϑ24 ϑ1)混合液,混匀后12 000 r·min-1离心5 min,取上清液。加入0.6倍体积异丙醇后混匀,室温放置10 min后,再12 000 r·min-1离心10 min。70%乙醇洗涤沉淀,12 000 r·min-1离心5min,弃去上清液,吹干乙醇,溶于25 μL TE缓冲液中,获取最终DNA,0.6%琼脂糖凝胶电泳检测结果。
1.2.2.216S rRNA的PCR扩增
PCR反应体系如下:DNA模板1 μL;引物各1 μL;dNTP(10 mmol·L-1)1 μL;10×Taq buffer 5 μL;DNA Taq聚合酶1 μL;加双蒸水(ddH2O)至50 μL。
选用16s通用引物:27f:5'AGA GTT TGA TCC TGG CTC AG 3';1522r:5'AAG GAG GTG ATC CAG CCG CA 3'。PCR扩增程序如下:95℃预变性5 min;94℃变性1 min;50℃退火1 min;72℃延伸1 min;设置25个循环;72℃延伸10 min;4℃保存30 min。1%琼脂糖电泳检测扩增反应产物,产物片段大小约1 400 bp。PCR产物由上海生物工程技术服务有限公司测序。
1.2.2.3测序分析
将测序得到长度为1 430 bp序列与GenBank数据库中16S rRNA基因序列作比较,选取比对结果最高菌株。将测序获得序列与相关文献中已报道的PAEs降解菌序列运用MEGE 5.0构建系统发育树。
1.2.3细菌生理生化试验
LB琼脂平板划线接种,35℃恒温培养24 h,观察细菌生长情况及菌落特征,生理生化试验参照文献[20-21]鉴定,主要包括甲基红试验、淀粉水解试验及部分生化鉴定等。
1.2.3.1细菌生长量测定
以蒸馏水作对照,采用紫外可见分光光度计在600 nm波长下测定培养液光密度值。
1.2.3.2DBP含量测定
向待测菌液中加入等量正己烷分层萃取,漩涡振荡器充分摇匀后,超声提取20~30 min,离心后取上清液,经0.45 μm滤膜过滤后收集滤液,采用液相质谱(LC-MS)法测定DBP含量。
LC-MS条件:色谱柱:Kinetex C18(150 mm× 3.0 mm,2.6 μm,100 A);流动相:甲醇(0.1%FA);流速:200 μL·min-1;进样量10 μL。
1.2.4不同环境因素对菌株生长及降解DBP影响
将分离纯化得到菌株接种于LB培养基中,培养12 h后收集菌体,无机盐培养基重悬,调整菌悬液OD600=1.0,作为种子液备用。以3%接菌量将种子液接种于30 mL无机盐培养基中,以接种灭活菌株为对照,分别设定不同培养温度、初始pH、初始DBP浓度及摇速。每隔3 h取样,测定细菌生长量OD600,并用LC-MS法检测溶液中DBP残留浓度,每个试验数据重复3次,取平均值,DBP降解率计算公式如下:
DBP降解率(%)=(DBP初始浓度-DBP残留浓度)/DBP初始浓度×100%
温度设定(℃):20、25、30、35、40;pH设定:5、6、7、8、9、10;DBP浓度(mg·L-1):100、200、500、800、1 000、2 000;摇速设定(r·min-1):100、125、150、200、250。
通过单因素试验,应用正交试验方法确定菌株最佳生长及降解培养条件。
1.2.5菌株对不同PAEs降解情况
将3%菌株种子液接种于30 mL无机盐培养基中,分别加入500 mg·L-1的DBP、DMP、DEP和DEHP,125 r·min-1、35℃摇床培养72 h,按上述方法测定比较菌株对不同PAEs底物及500 mg·L-1DBP培养基中生长及降解情况。
2 结果与分析
2.1菌株DNB-S2生理生化特征
菌株革兰氏染色显示为阴性菌。菌株生理生化特性测定结果如表1所示,淀粉、明胶水解试验,甲基红试验,V-P反应均为阳性,硫化氢、尿素、吲哚、柠檬酸盐试验均为阴性,可利用DBP为唯一碳源和能源生长繁殖。
2.2菌株16S rRNA基因序列相似性分析
以菌株DNB-S2基因组DNA为模板作PCR扩增,然后琼脂糖凝胶电泳,产物经回收、T/A克隆后送至上海生物工程技术服务有限公司测序,获得长度为1 446 bp的16S rDNA基因片段,NCBI上进行Blast同源性比对,发现该菌株基因序列与剑菌属细菌(Ensifer sp.)同源性为99%,将其命名为DNB-S2。将DNB-S2与几种常见PAEs降解菌株构建系统发育树,如图1所示。
系统发育树上可看出降解菌共分为3大支,分别是变形菌门(Proteobacteria)、厚壁菌门(Fir⁃micutes)和放线菌(Actinobacteria),DNB-S2归为变形菌门。
2.3菌株生长及对DBP降解特性研究
2.3.1培养温度对菌株生长及降解DBP影响
培养温度对DNB-S2降解DBP影响情况如图2所示,当培养温度为30~40℃时,菌株生长和DBP降解情况较好,35℃时达到最高菌株生长量和DBP降解率,48 h可降解91.4%以上DBP;而当培养温度低于25℃或高于45℃时,菌株生长明显受抑制,菌株对DBP降解能力明显降低。

表1 供试菌株生理生化试验Table 1 Physiological and biological characterizations of strains
2.3.2初始pH对菌株生长及降解DBP影响
初始pH对DNB-S2降解DBP影响情况如图3所示,菌株较适宜培养pH为6.0~8.0,当pH为7.0时,菌株对DBP降解效果最佳,降解率可达92.3%以上,当培养液初始pH小于5.0或大于9.0时,菌株生长缓慢,DNB-S2对DBP降解能力受抑制。
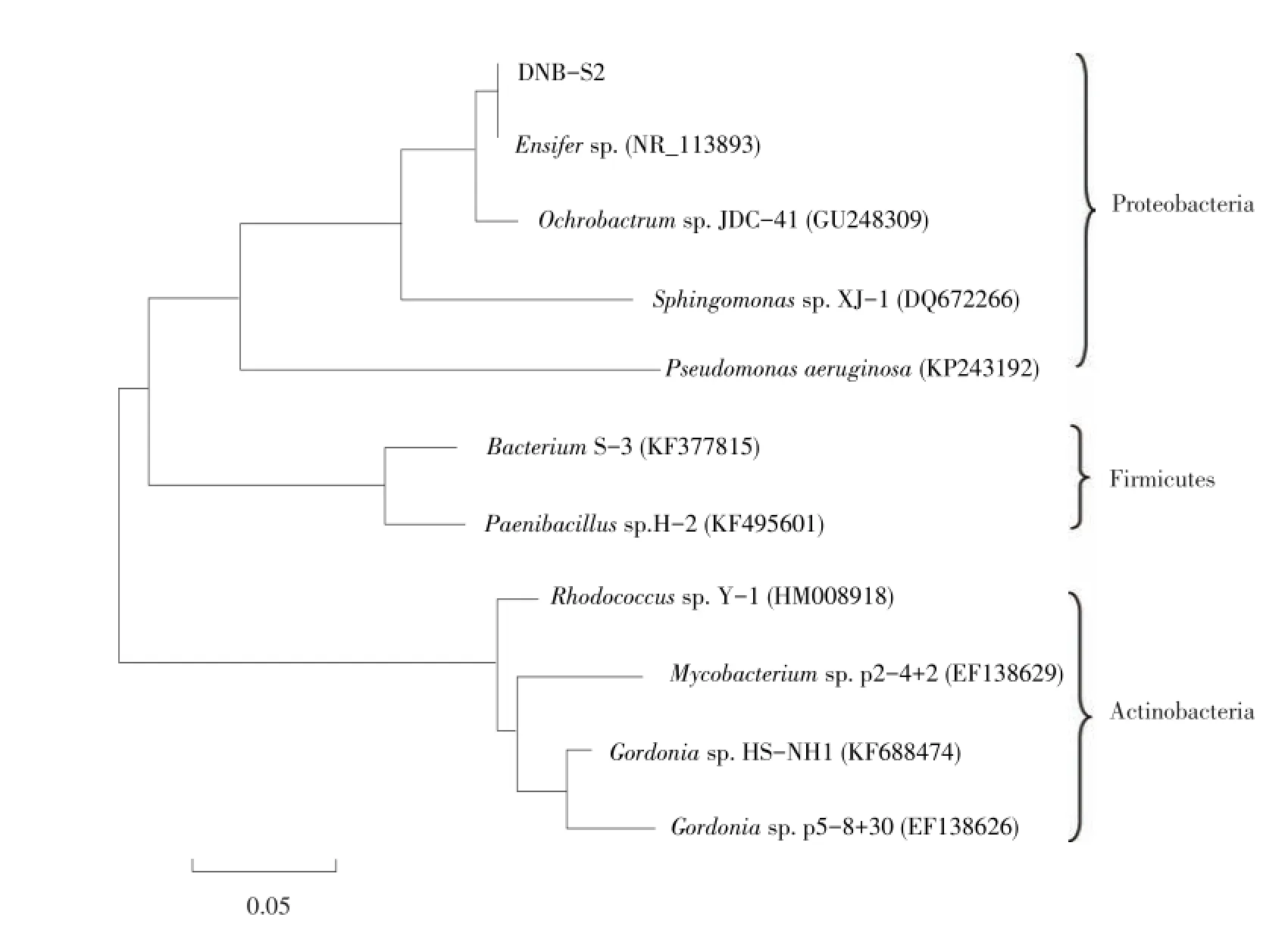
图1 菌株DNB-S2 16S rDNA基因序列与其他PAEs降解菌系统发育进化树Fig.1 Phylogenetic tree based on the 16S rDNA gene sequences of strain DNB-S2 and other PAEs degradation bacteria
2.3.3初始DBP浓度对菌株生长及降解DBP影响
初始DBP浓度对DNB-S2降解DBP影响情况如图4所示。
由图4可知,随底物浓度增加,生长曲线和降解曲线均呈先增后减趋势。当底物浓度小于500 mg·L-1时,DNB-S2生长和降解能力较弱,当底物浓度为500~1 000 mg·L-1时,生长量达最高值,细菌生长量为0.89~0.91,此时降解率在500 mg· L-1时达最大值95%。底物浓度为800、1 000 mg· L-1时,虽然菌株生长量达最大值,但底物初始浓度较大,对应降解率大幅下降。当底物浓度达2 000 mg·L-1时,菌株仍可生长,但生长受抑制,降解率降到最低。
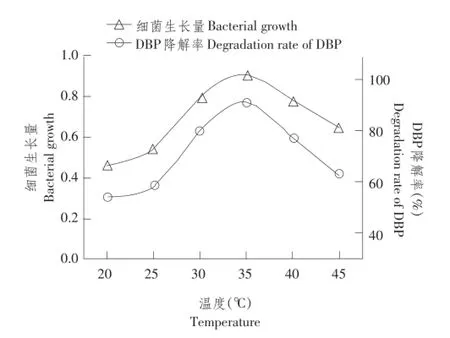
图2 温度对菌株DNB-S2生长及DBP降解率影响Fig.2 Effect of temperature on the growth and DBP degradation rate of DNB-S2
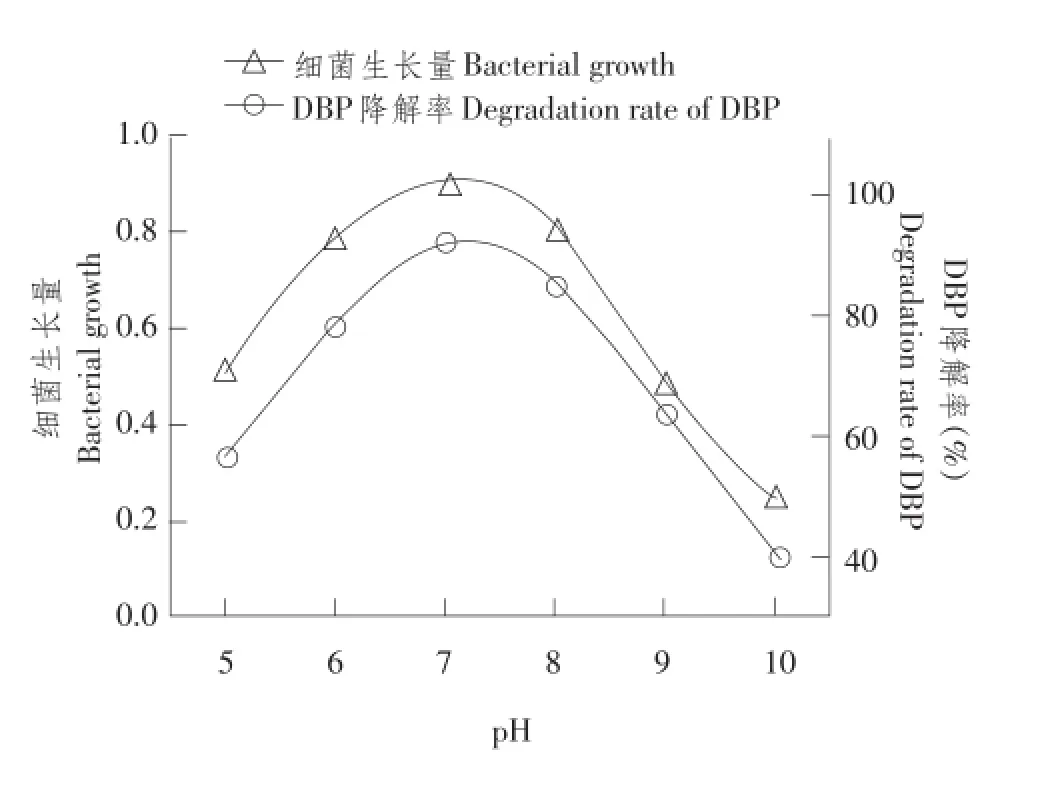
图3 pH对菌株DNB-S2生长及DBP降解影响Fig.3 Effect of pH on the growth and DBP degradation rate of DNB-S2
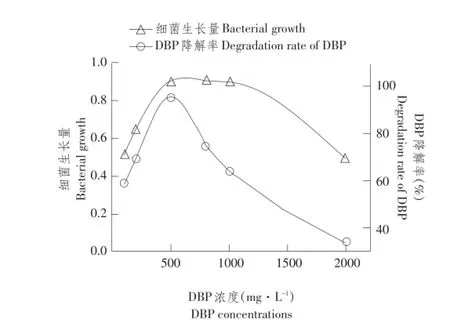
图4 初始DBP浓度对菌株DNB-S2生长及DBP降解影响Fig.4 Effect of DBP conccentration on the growth and DBP degradation rate of DNB-S2
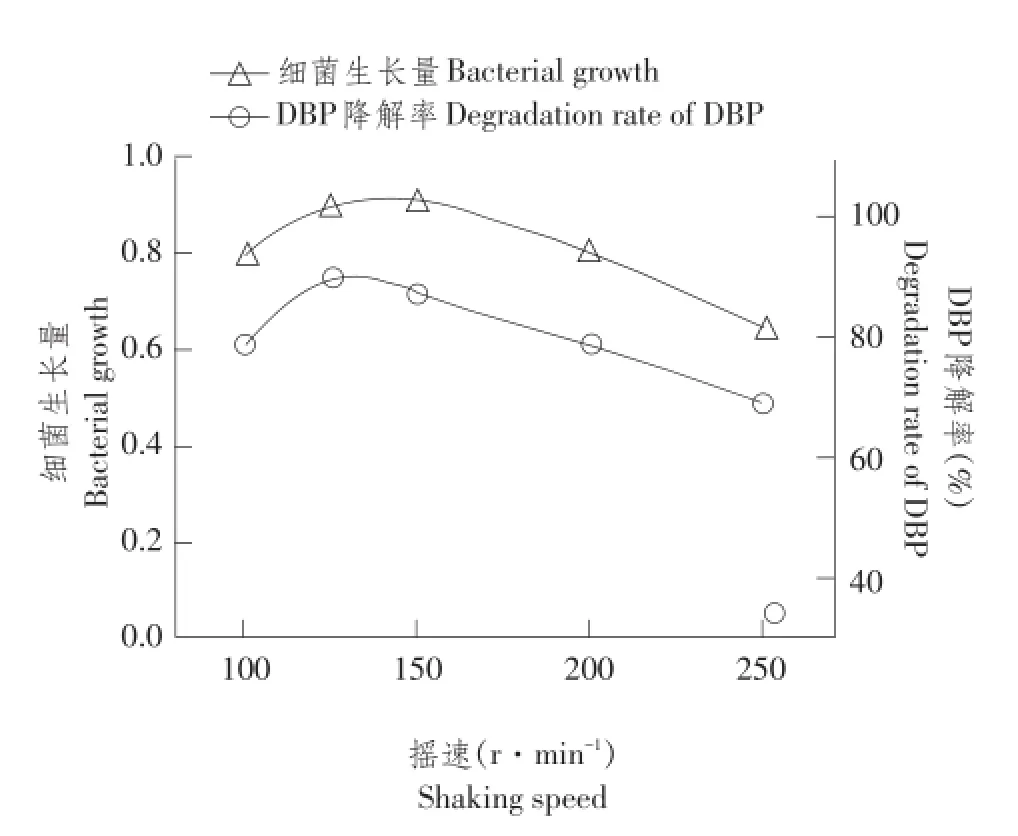
图5 摇速对菌株DNB-S2生长及DBP降解影响Fig.5 Effect of shaking speed on the growth and DBP degradation rate of DNB-S2
2.3.4摇速对菌株生长及降解DBP影响
摇速对菌株降解DBP影响情况如图5所示,相对于初始pH、温度及初始DBP浓度,摇速对菌株生长量及降解率影响最弱,摇速在100~250 r· min-1时,培养48 h后菌株细菌生长量达0.64~0.90,菌株对DBP降解率达68.9%~89.4%,摇速为125 r·min-1时,菌株生长量及对DBP降解率达到峰值。
2.3.5菌株DNB-S2最佳降解曲线
在单因素试验基础上,为确定菌株最佳降解曲线,进行四因素三水平L9(34)正交试验,选择不同温度、pH、初始DBP浓度及摇速为组分,以菌株对DBP降解率为考查目标,优化降解条件。正交试验设计见表2。
由表3可知,各因素对菌株降解DBP效率均有一定影响。根据极差值(R),各因素对DBP降解率影响程度排序为:初始DBP浓度(C)>温度(A)>pH (B)>摇速(D)。根据污染物降解效果确定固定化成球最佳组合为A2B2C2D2,即菌株最佳降解条件:温度35℃、pH 7.0、初始DBP浓度500 mg·L-1、摇速125 r·min-1。
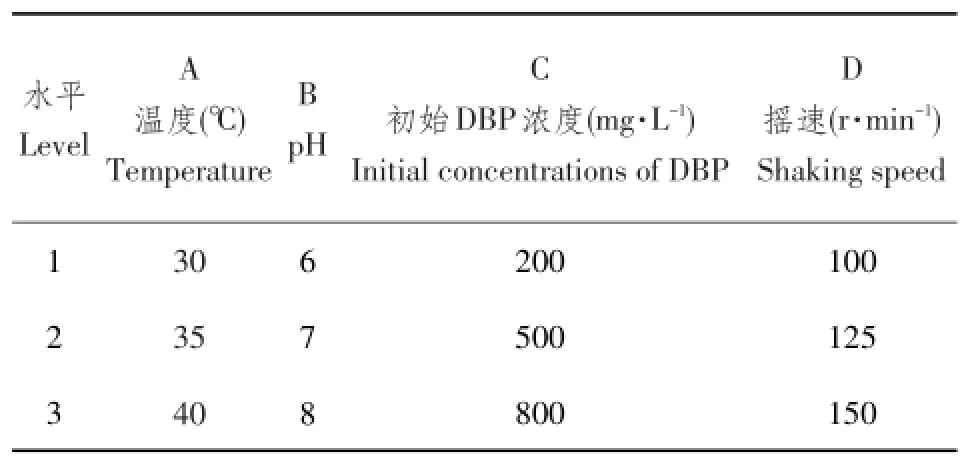
表2 菌株DNB-S2正交试验设计Table 2 DNB-S2 strain orthogonal design
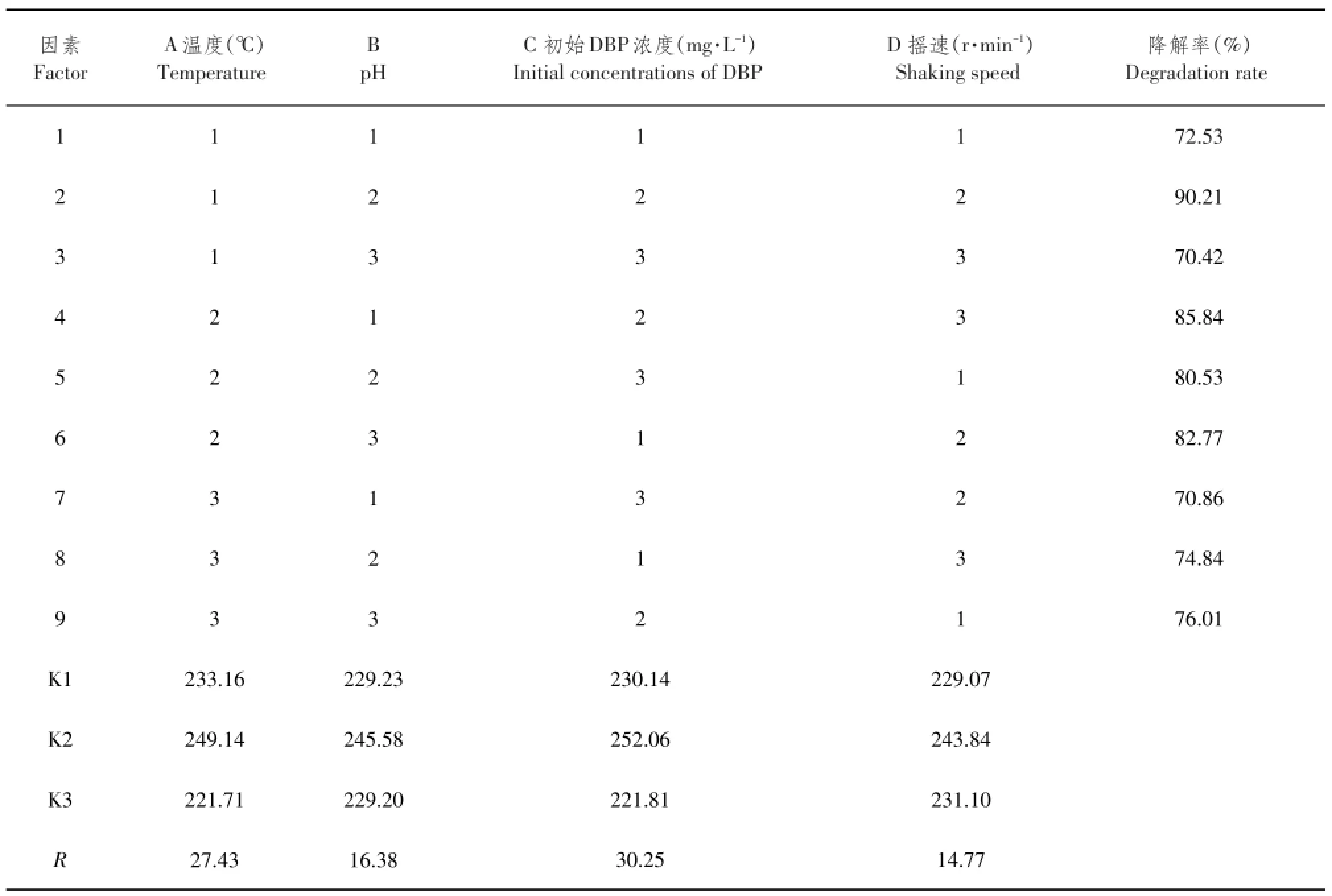
表3 菌株DNB-S2正交设计结果Table 3 Orthogonal design results of DNB-S2
以最佳降解条件培养菌株,测定菌株生长量及对DBP降解率,以时间为横坐标,细菌生长量及DBP浓度为纵坐标,绘制生长及降解曲线,如图6所示。菌株生长量与降解能力呈一定正相关,从整体来看生长曲线呈S型,符合一般群落结构生长趋势;从降解曲线整体来看,在DBP降解过程中,其浓度和时间对数之间具有良好线性关系,48 h可将500 mg·L-1的DBP去除95%以上。
2.3.6菌株对不同PAEs降解情况分析
菌株对DMP、DEP、DBP和DEHP降解情况如表4所示,表明菌株亦可利用其他几种常见PAEs类化合物生长,对DMP、DEP和DBP利用情况较好,对DEHP利用情况稍弱,因DEHP烷基碳链较长,菌株对其利用情况不如对烷基碳链较短的DMP、DEP或DBP降解效果。
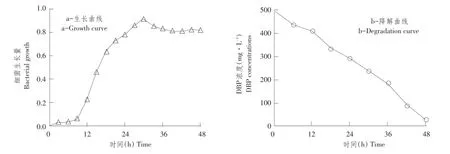
图6 菌株DNB-S1生长及降解曲线Fig.6 Growth and degradation curve of strain DNB-S1

表4 菌株邻苯二甲酸酯利用广谱性Table 4 PAEs substrate diversity of strain DNB-S2
3 讨论与结论
DBP的辛醇-水分配系数(Kow)较高,水溶性低,属于亲脂性有机污染物,易溶于有机溶剂,因此其易于向固体沉积物和生物体转移,在土壤中积累,威胁人类健康。DBP在自然环境中光解、水解速度缓慢。因此,微生物降解是DBP降解主要方式。研究表明,DBP好氧降解比厌氧降解更有效[3]。目前,已有大量降解菌从土壤、沉积物、活性污泥、红树林中分离,DBP刺激土著微生物抗胁迫能力。PAEs降解菌中,高效降解菌并不常见,大量降解菌仅能降解单一污染物,降解菌株在生物修复中具有局限性。因此,筛选具有高效降解能力且降解多种污染物的菌株具有重要意义。
本研究筛选的高效降解菌可在高浓度DBP存在下生长,500 mg·L-1DBP浓度下,48 h内降解量超过95%,最高耐受DBP浓度达2 000 mg·L-1。本研究对菌株DNB-S2与已报道的几种常见PAEs降解菌作系统发育进化树比较其亲缘关系。进化树分析发现,进化树共分三支,分别是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌(Actinobacteria)[22-25],而DNB-S2属于变形菌门(Proteobacteria)剑菌属(Ensifer),剑菌属能降解多种污染物,如农药(苯醚甲环唑[26-27]、乙草胺[28]),杀虫剂(甲拌磷[29]、噻虫嗪[30]),同时可降解石油[31]、尼古丁[32]和二苯亚胂酸[33]等物质。
本试验底物广谱性试验表明,DNB-S2菌株除有效降解DBP外,对其他3种常见PAEs类污染物DMP、DEP和DEHP降解作用明显。菌株生长情况良好,证明PAEs类污染物对菌株无毒害作用,菌株对DEHP降解效果不如对烷基碳链较短的DBP、DMP或DEP降解效果,这可能是因DEHP具有更低水溶性、烷基碳链较长,具有更高的辛醇-水比(logKow=7.5)[10],与陈湖星等研究结果一致[34],其筛选出一株能以邻苯二甲酸丁苄酯(BBP)为唯一碳源生长的不动杆菌(Acinetobacter)命名为HS-B1,该菌能在以DMP、DEP、DBP、DEHP等PAEs类化合物为唯一碳源无机盐培养基中生长,HS-B1菌株对烷基碳链较短的DMP、DEP、DBP利用较快,而对长链DEHP利用较慢。关于DBP降解菌报道较多,如周洪波等从底泥中筛选出能以DBP为唯一碳源生长的鞘氨醇菌(Sphingomonas)命名为XJ1,该菌株虽可利用DMP等一系列PAEs类化合物生长,但降解能力有限[35]。金雷等在长期受垃圾污染的土壤中筛选到一株类芽胞杆菌(Paenibacillus sp.)的DBP降解菌,命名为S-3,该菌株降解速率及能力较弱,在5 d内对100 mg·L-1DBP降解率达82.7%[36]。Wu等首次报道农杆菌(Agrobacterium sp.)降解DBP,将其命名为JD-49,可降解DBP浓度最大为300~400 mg·L-1,48 h内降解率达96%,但未提及该降解菌广谱性降解能力[18]。与以往DBP降解菌相比,本研究筛选得到的DNB-S2是具有降解广谱性的高效降解菌株。
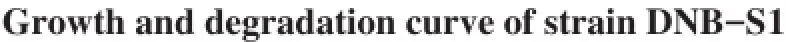
图6 菌株DNB-S1生长及降解曲线Fig.6 Growth and degradation curve of strain DNB-S1
本研究筛选的DBP高效降解菌经16S rRNA基因片段NCBI比对,鉴定为剑菌(Ensifer sp.),命名为DNB-S2。该菌株生理生化特性测定结果为:淀粉、明胶水解试验、甲基红试验、V-P反应均为阳性,硫化氢、尿素、吲哚、柠檬酸盐试验均为阴性。DNB-S2的最佳降解条件为:温度35℃、pH 7.0、初始DBP浓度500 mg·L-1、摇速125 r·min-1,在该培养条件下,降解菌48 h对500 mg·L-1DBP降解率高达95%以上。同时DNB-S2具有广谱降解性能,除可降解高浓度DBP,也可降解DMP和DEP,对长链DEHP也有一定降解作用。本研究首次发现剑菌属能高效利用PAEs,丰富PAEs降解菌数据库,在PAEs污染生物修复方面具有应用潜力。
[1]Erythropel H C,Maric M,Nicell J A,et al.Leaching of the plasti⁃cizer di(2-ethylhexyl)phthalate(DEHP)from plastic containers and the question of human exposure[J].Applied Microbiology& Biotechnology,2014,98:1-15.
[2]Zolfaghari M,Drogui P,Seyhi B,et al.Occurrence,fate and ef⁃fects of di(2-ethylhexyl)phthalate in wastewater treatment plants [J].Environmental Pollution,2014,194:281-293.
[3]Liao C S,Chen L C,Chen B S,et al.Bioremediation of endocrine disruptor di-n-butyl phthalate ester by Deinococcus radiodurans and Pseudomonas stutzeri[J].Chemosphere,2010,78(3):342-346.
[4]Chandra S,Kumar V,Prakash A,et al.Environments and health hazards of phthalate(Di-n-butyl phthalate)present in plastics[J]. Eurasian Journal of Toxicological Sciences,2012,4(4):170-174.
[5]Lee J,Lee J H,Kim C K,et al.Childhood exposure to DEHP, DBP and BBP under existing chemical management systems:A comparative study of sources of childhood exposure in Korea and in Denmark[J].Environment International,2014,63(3):77-91.
[6]Wen Z D,Gao D W,Wu W M.Biodegradation and kinetic analy⁃ sis of phthalates by an Arthrobacter strain isolated from construct⁃ed wetland soil[J].Applied Microbiology&Biotechnology,2014, 98(10):4683-4690.
[7]Zhang Y,Wang P J,Wang L,et al.The influence of facility agri⁃culture production on phthalate esters distribution in black soils of northeast China[J].Science of the Total Environment,2015, 506-507:118-125.
[8]鄂勇,张晓琳,宋秋霞.环境内分泌干扰物及其潜在威胁[J].东北农业大学学报,2008,39(11):135-139.
[9]刘敏,林玉君,曾锋,等.城区湖泊表层沉积物中邻苯二甲酸酯的组成与分布特征[J].环境科学学报,2007,27(8):1377-1383.
[10]Wang J,Chen G C,Christie P,et al.Occurrence and risk assess⁃ment of phthalate esters(PAEs)in vegetables and soils of subur⁃ban plastic film greenhouses[J].Science of the Total Environment, 2015,523:129-137.
[11]王琳,罗启芳.邻苯二甲酸二丁酯降解优势菌的筛选和特性研究[J].卫生研究,2004,33(2):137-139.
[12]Yang C F,Wang C C,Chen C H.Di-n-butyl phthalate removal by strain Deinococcus sp.R5 in batch reactors[J].International Biodeterioration&Biodegradation,2014,95:55-60.
[13]Li C.Biodegradation of an endocrine-disrupting chemical di-nbutyl phthalate by Serratia marcescens C9 isolated from activated sludge[J].African Journal of Microbiology Research,2012,6(11): 2686-2693.
[14]Yi L,Fei T,Ying W,et al.Biodegradation of dimethyl phthalate, diethyl phthalate and di-n-butyl phthalate by Rhodococcus sp.L4 isolated from activated sludge[J].Journal of Hazardous Materials, 2009,168(S2-3):938-943.
[15]Jin D C,Liang R X,Dai Q Y,et al.Biodegradation of di-n-butyl phthalate by Rhodococcus sp.JDC-11 and molecular detection of 3,4-phthalate dioxygenase gene.[J].Journal of Microbiology& Biotechnology,2010,20(10):1440-5.
[16]Wang J L,Liu P,Qian Y.Microbial degradation of di-n-butyl phthalate[J].Chemosphere,1995,31(9):4051-4056.
[17]Wu X,Liang R,Dai Q,et al.Complete degradation of di-n-butyl phthalate by biochemical cooperation between Gordonia sp.strain JDC-2 and Arthrobacter sp.strain JDC-32 isolated from activated sludge[J].Journal of Hazardous Materials,2010,176(1-3):262-268.
[18]Wu X,Wang Y,Liang R,et al.Biodegradation of an endocrinedisrupting chemical di-n-butyl phthalate by newly isolated Agro⁃bacterium sp.and the biochemical pathway[J].Process Biochemis⁃try,2011,46(5):1090-1094.
[19]耿印印,王旭梅,王红旗,等.污染土壤中耐镉菌株的筛选、鉴定及吸附试验研究[J].东北农业大学学报,2010,41(11):59-65.
[20] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].第8版,北京:科学出版社,1984:922-934.
[21] 东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001: 370-412.
[22]胡培磊.Sphingomonas sp.XJ1降解DBP的研究[D].长沙:中南大学,2008.
[23]段淑伟.邻苯二甲酸二丁酯降解菌DNB-S1的筛选和其酶制剂的初步应用[D].哈尔滨:东北农业大学,2015.
[24]Xu X R,Li H B,Gu J D.Biodegradation of an endocrine-disrupt⁃ing chemical di-n-butyl phthalate ester by Pseudomonas fluore⁃scens B-1[J].International Biodeterioration&Biodegradation, 2005,55(1):9-15.
[25]王洋洋.三株DBP降解菌的筛选及其降解特性的相关研究[D].长沙:中南大学,2011.
[26]黄亚丽,何宪科,张丽萍,等.农药污染土壤的微生物修复研究进展[J].现代化农业,2011(9):1-4.
[27] 郑金伟,何健,王哲,等.苯醚甲环唑降解菌B2的分离、鉴定及其降解特性[J].中国环境科学,2009,29(1):42-46.
[28]董滨,王凤花,林爱军,等.乙草胺降解菌A-3的筛选及其降解特性[J].环境科学,2011,32(2):542-547.
[29]宋柯群.甲拌磷降解菌的筛选及其降解特性研究[D].沈阳:东北大学,2008.
[30]周广灿.微生物代谢烟碱类杀虫剂噻虫啉和噻虫嗪的研究[D].南京:南京师范大学,2012.
[31]周楚莹,吴秉奇,刘淑杰,等.近海柴油降解菌群的构建及其对柴油的降解特性[J].微生物学通报,2015,42(12):2308-2320.
[32]魏海雷.烟草尼古丁降解细菌多样性与假单胞杆菌尼古丁代谢相关基因的研究[D].昆明:中国科学院昆明植物研究所, 2009.
[33]高木和广,原田直树.具有二苯亚胂酸降解能力的新微生物[P].中国:101501181,2009-08-05.
[34]陈湖星,杨雪,张凯.1株高效BBP降解菌的分离与特性研究[J].环境科学,2013,34(7):2882-2888.
[35]周洪波,胡培磊,刘飞飞,等.DBP降解菌株XJ1的分离鉴定及其降解特性[J].生物技术,2008,18(2):64-67.
[36]金雷,严忠雍,施慧,等.邻苯二甲酸二丁酯DBP降解菌S-3的分离、鉴定及其代谢途径的初步研究[J].农业生物技术学报, 2014,22(1):101-108.
Study on isolation and identification of a Di-n-butyl phthalate(DBP)-degrading strain and its degradation characteristics/
ZHANG Ying,WANGLihua,CHEN Yiyang,WANG Lei,ZHOU Changjian,FU Jiawei,FAN Xinhui(School of Resources and Environmental Sciences,NortheastAgricultural University,Harbin 150030,China)
Di-n-butyl phthalate(DBP),which belonged to the family of PAEs,was widely used as one of plasticizers.As DBP was not chemically bonded with the resin,so DBP had become ubiquitous in the environment.However,metabolic breakdown of DBP by microorganisms played a major role in the environmental degradation of DBP because of its low environmental hydrolysis and photolysis rates.In the present study,an efficient bacterial strain was isolated from PAEs-contaminated soil,which was identified as Ensifersp.with the highest 16S rDNA gene similarity of 99%.The optimal growth condition of DNB-S2 was as following:temperature 35℃,pH 7.0,DBP concentration 500 mg·L-1,shaking speed 125 r·min-1.Strain DNB-S2 was able to degrade 500 mg·L-1DBP by more than 95%within 48 h.The results of substrate diversity indicated that DNB-S2 could also degrade DMP,DEP and DEHP.The search not only provided important basic data and technical support for the biodegradation of PAEs pollution,but also offered a new direction for bioremediation of contaminated environments and clean production.
PAEs;DBP;degradation bacteria;substrate diversity
X172
A
1005-9369(2016)08-0046-09
2016-03-21
国家自然科学基金项目(31470550)
张颖(1972-),女,教授,博士,博士生导师,研究方向为环境污染生物修复。E-mail:zhangyinghr@hotmail.com
