甜菜根系分泌物对大豆化感作用研究
2016-09-24李彩凤马凤鸣盖志佳王玉波
李彩凤,陈 明,马凤鸣,盖志佳,郭 剑,王玉波
(东北农业大学农学院,哈尔滨 150030)
甜菜根系分泌物对大豆化感作用研究
李彩凤,陈明,马凤鸣,盖志佳,郭剑,王玉波
(东北农业大学农学院,哈尔滨150030)
以甜菜为供体,大豆为受体,研究甜菜根系分泌物对大豆生长发育化感作用。结果表明,根系分泌物对大豆种子萌发抑制性化感作用随根系分泌物浓度升高而增大。检测出甜菜根系分泌物有31种,其中烷烃类4种(1.44%),酯类12种(62.62%),酚类1种(11.80%),酸类5种(10.33%),烯烃类1种(3.22%),醇类2种(1.23%),萘类4种(7.44%),酮类1种(0.43%),醛类1种(0.67%),其他(0.82%)。在甜菜根系分泌物中,2,6-二叔丁基对甲酚和邻苯二甲酸为大豆主要化感物质,表现为抑制作用。甜菜根系分泌物对大豆产生化感作用,抑制其生长发育,在大豆幼苗期、始花期、盛荚期、鼓粒期四个时期,降低叶片净光合速率,化感作用IR(抑制率:Inhibitory rate)分别为-13.9%、-14.2%、-11.7%和-10.4%;同时降低叶片硝酸还原酶(NR)活性,化感作用IR分别为-2%、-11%、-15%和-18%;对大豆株高、每株节数、每株荚数、每荚粒数,每株粒数、百粒重、单株籽粒产量和生物产量化感作用IR分别为-8.4%、-8.7%、-8.6%、-11.7%、-18.4%、-1.7%、-19.3%、-8.0%,平均抑制率为-10.6%,即抑制性化感作用潜力为10.6%。
甜菜;化感作用;根系分泌物;大豆;种子萌发
网络出版时间2016-8-24 15:04:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1504.006.html
李彩凤,陈明,马凤鸣,等.甜菜根系分泌物对大豆化感作用研究[J].东北农业大学学报,2016,47(8):21-30.
Li Caifeng,Chen Ming,Ma Fengming,et al.Study on allelopathy of sugar beet root exudates on soybean[J].Journal of Northeast Agricultural University,2016,47(8):21-30.(in Chinese with English abstract)
化感作用(Allellopathy)是指植物或微生物代谢分泌物对环境中其他植物或微生物产生的直接或间接刺激作用[1-2]。化感物质可影响种子发芽和幼苗生长,周艳丽等研究表明,两个大蒜品种根系分泌物对莴苣种子发芽和幼苗生长均表现为低浓度促进、高浓度抑制[3]。研究植物间化感作用,可从本质上明确植物生长调节和代谢过程作用机制,应用于植物高效保护、作物快速增产、轮作体系构建。
甜菜(Beta vulgaris L.)是我国北方特有糖料作物,因其需肥量大、吸肥力强、地力消耗严重,后茬作物难续。大豆是环境友善型作物,根瘤菌可与大豆根系共生固氮,有益于改善后茬作物土壤肥力。但甜菜对大豆是否存在化感作用研究少,作物领域区分化感作用与种间资源竞争研究不足[4-6]。因此,本试验以甜菜为供体,大豆为受体,通过试验装置使资源竞争与化感作用分离,探讨甜菜根系分泌物对大豆化感影响,明晰甜菜对大豆化感作用,为大豆作为甜菜后茬作物影响提供理论基础,为作物之间化感作用研究提供新方法。
1 材料与方法
1.1材料
选用标准型甜菜品种甜研309为供体材料,大豆品种东农42为受体材料。
1.2方法
1.2.1甜菜根系分泌物对大豆种子发芽势及发芽率化感作用
采用1/3 Hogland营养液培养甜菜幼苗(播种后25 d左右),以50 mL去离子水收集幼苗期根系分泌物溶液为基准浓度(H)溶液,再以添加去离子水方法配置成H、1/2 H、1/4 H、1/8 H浓度甜菜根系分泌物。选取均一、饱满大豆籽粒,次氯酸钠溶液(2%)消毒种子15 min,清水反复冲洗3次。每个铺有双层湿润滤纸的培养皿(9 cm),放入50粒大小均一,健康饱满大豆种子,设5个处理,分别是蒸馏水、H、1/2 H、1/4 H、1/8 H,每个处理15 mL,3次重复。种子25℃暗培养7 d,每天使种子保持湿润,且统计发芽种子数(以破胸为标志),3 d后计算发芽势,7 d后计算发芽率。
1.2.2幼苗期甜菜根系分泌物成分鉴定
收集:参照沈荔花等溶液培养法[7],略有改进。收集分泌物同时称根重,以0.6 g·mL-1根系分泌物为原液,真空冷冻干燥机浓缩至2.0 g·mL-1,密置于4℃冰箱中备用。
萃取法分离:取浓度为2.0 g·mL-1根系分泌物100 mL用乙酸乙酯按体积比2 ϑ1比例萃取3次后,将上述各4种组分经无水硫酸钠干燥后,减压浓缩,溶于5 mL甲醇中,放入-20℃冰箱备用,待生物检测。
成分鉴定:对有化感潜力组分,过树脂柱、硅胶柱等处理,以气质联用(GC-MS)法,鉴定出具体化感物质。
1.2.3甜菜根系分泌物主成分对大豆种子萌发和幼苗化感作用模拟试验
种子萌发试验:在直径为9 cm培养皿中,平放双层定性滤纸,分别加入2,6二叔丁基对甲酚,邻苯二甲酸,邻苯二甲酸二丁酯三种物质,每种物质4个浓度,分别是0、50、100、150 μmol·L-1。在培养皿内溶剂挥发完全后,加入8 mL蒸馏水,每个培养皿50粒种子,12%H2O2消毒3 min,选取饱满均一种子放置培养皿滤纸内,封盖,5次重复,24℃恒温箱中培养,3~7 d后,每天统计种子发芽数,计算发芽率。
大豆幼苗化感作用试验:大豆经消毒和催芽,选萌发良好一致种子播种在10 L盆中,出苗后,开始用同发芽测定的不同浓度三种物质处理,每个处理5次重复,20 d后测定大豆叶片叶绿素含量和净光合速率。
1.2.4盆栽试验
试验设计见表1。

表1 试验设计Table 1 Test design
1.2.4.1栽培装置
试验装置(见图1):直径32 cm、高30 cm小有机玻璃圆缸,缸底直径3 mm打孔,孔桥距9 mm,缸底内衬尼龙网。将小有机玻璃圆缸内嵌入直径34 cm、高32 cm,底部打孔(孔径等同上)和不打孔大有机玻璃圆缸中,大、小缸壁间距离1 cm。套嵌的两个有机玻璃圆缸底部之间通过3块(2 cm×2 cm×2 cm)间隔等距有机玻璃块粘合在一起,并使大、小有机玻璃圆缸粘结为一体,3个有机玻璃块支撑小有机玻璃圆缸悬空于大有机玻璃圆缸内,称之为大缸底部有孔和无孔“双套筒中空有机玻璃圆缸”。
黑龙江省年均降雨量约600 mm,60%集中在7、8月份。试验按自然实际周降雨量,每7 d浇1次水。
预备试验证明,这种自制装置可使小有机玻璃圆缸内甜菜根系分泌物随土壤溶液经小、大有机玻璃圆缸之间的“中空无土壤”路径,流渗入大圆玻璃缸以外盆中土壤,形成有化感、无竞争的地下部化感与地下部竞争分离试验设计。
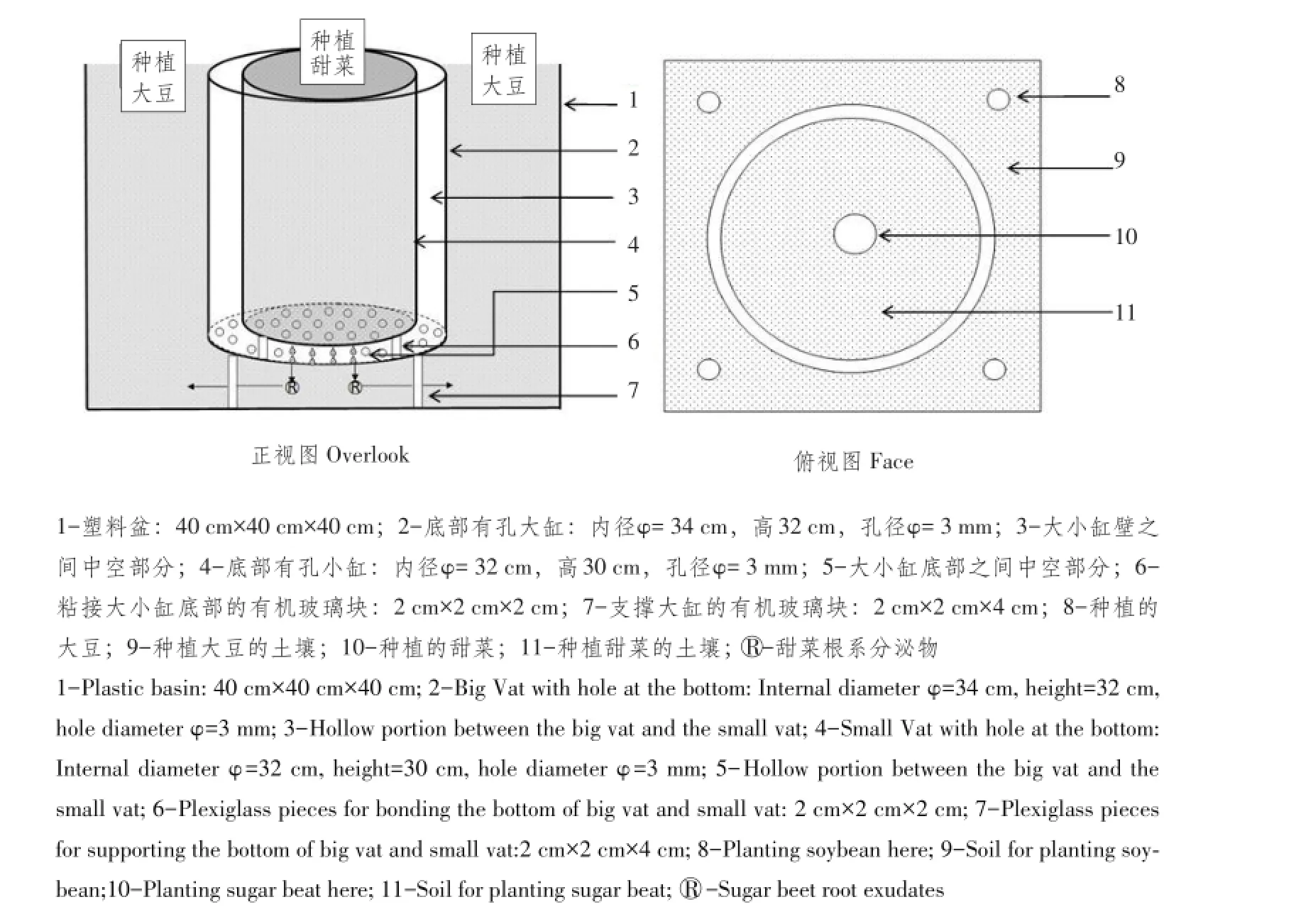
图1 试验装置俯视与正视Fig.1 Test apparatus overlook and face
根系分泌物随土壤溶液流渗入大有机玻璃圆缸以外盆中土壤时,也会有极少量N、P、K随土壤溶液流渗入盆中土壤。
本试验采取“补差”办法解决上述问题:用吸管及时收集并保存对照中(无孔“双套筒中空有机玻璃圆缸”)大有机玻璃圆缸底部一周内积存水溶液,经过滤等处理,测量其体积和N、P、K浓度,计算各自的量。于翌周浇水时(水中溶有相对应量的N、P、K)对各不同处理,按不同(0倍量、2倍量等)差额补差使各处理地下部资源总量相同。
1.2.4.2土壤小缸与大缸内装土重量相同,为25 kg,每个处理12次重复。土壤化学性质为pH 7.2,有机质35.6mg·kg-1,全氮0.158%,全磷0.078%,碱解氮212.8 mg·kg-1、速效磷54.1 mg·kg-1、速效钾129mg·kg-1。
1.2.4.3播种方式
每个盆中播4穴,每穴5粒种子,播种后覆干土3 cm,保证出苗率,日后需间苗、定苗。
1.2.5取样及测定方法
晴天,上午9:00~10:00,分别在苗期(V3)、始花期(R1)、盛荚期(R4),鼓粒期(R6)对刚展开叶片(倒2、3叶)测定净光合速率。并将该部位叶片用冰盒带回实验室测定硝酸还原酶活性。
大豆叶片硝酸还原酶活性测定参照马凤鸣等方法[8]。大豆叶片净光合速率(Pn)采用美国LICoK6400R便携式光合仪测定;叶片叶绿素含量采用SPAD-502Plus叶绿素含量测定仪测定。
1.2.6数据计算及分析
种子发芽率(%)=(种子发芽7 d内正常发芽的所有种子数/测试种子数)×100%。
发芽势(%)=(种子发芽开始3 d内正常发芽的所有种子数/测试种子数)×100%。
以大豆各指标平均作用抑制率IR(Inhibitory rate)判定甜菜对大豆化感作用与资源竞争,IR为正值,表示促进作用,负值,表示抑制作用。
计算公式如下:IR(%)=(处理值-对照值)/对照值×100%。
平均IR值=各指标IR之和/指标数。
试验结果用SPSS 19.0软件进行Duncan新复全距测验分析。
2 结果与分析
2.1甜菜根系分泌物对大豆种子发芽势、发芽率影响
如表2所示,各浓度甜菜根系分泌物对大豆种子萌发均有抑制作用。随浓度不断增加,种子发芽率逐渐下降,从95%下降到65%,与清水对照相比,1/8H、1/4H、1/2H和H浓度下大豆发芽率显著降低(P<0.05);发芽势从95%下降到60%,浓度从1/4H增加到H时,甜菜根系分泌物对大豆种子发芽势影响幅度变小。化感作用抑制强度随根系分泌物浓度增加而增大,与清水对照相比,1/8H、1/4 H、1/2 H、H对发芽率IR值分别为-15.79%、-17.89%、-18.95%和-31.58%;对发芽势IR值分别为-15.79%、-25.26%、-31.58%和-36.84%。

表2 甜菜根系分泌物对大豆种子萌发影响Table 2 Effects of sugar beet root exudate on soybean seed germination (%)
2.2甜菜根系分泌物成分鉴定
试验中鉴定出甜菜根系分泌物31种(见表3),其中烷烃类4种(1.44%),酯类12种(62.62%),酚类1种(11.80%),酸类5种(10.33%),烯烃类1种(3.22%),醇类2种(1.23%),萘类4种(7.44%),酮类1种(0.43%),醛类1种(0.67%),其他(0.82%)。鉴定出组分中,酯类种类最多,所占总成分比例也最大。邻苯二甲酸二丁酯峰面积最大,占总面积47.22%,2,6-二叔丁基对甲酚占11.80%。邻苯二甲酸是甜菜根系分泌物分泌酸类中的主要成分,占总峰面积4.31%,其次是异辛酸占3.66%,甲基9-(Z)-十八烯酸占1.36%。
2.3甜菜根系分泌物主要成分对大豆幼苗生长影响
甜菜根系分泌物对大豆幼苗生长影响见表4。

表3 甜菜根系分泌物成分鉴定Table 3 Ingredient identification on sugar beat root exudates

表4 甜菜根系分泌物对大豆幼苗生长影响Table 4 Effects of sugar beat root exudates on soybean seedling growth
由表4可知,2,6-二叔丁基对甲酚和邻苯二甲酸对大豆幼苗生长有明显抑制作用,随处理浓度增大,大豆发芽率逐渐降低,叶绿素含量逐渐减少,净光合速率降低且各处理间差异显著(P<0.05),但邻苯二甲酸二丁酯对大豆幼苗生长几乎无影响,各处理间无显著差异。
2.4甜菜根系分泌物对大豆叶片净光合速率(Pn)影响
Pn值是体现光合特性最直接指标,也反映品种光合潜能[9]。如图2所示,大豆全生育期内叶片净光合速率Pn先升后降,始花期达最大值。V3时期,A>D>B>C,处理A与处理B、C差异显著(P<0.05);大豆R1时期,此时为甜菜块根膨大期,各处理间Pn差异显著(P<0.05),说明甜菜对大豆化感作用和营养竞争作用增强;大豆盛荚期,处理A与D比较,大豆叶片光合速率差异不显著,处理A、B和C比较,差异显著(P<0.05);大豆鼓粒期,大豆叶片Pn降低,处理B开始出现早衰现象,与其他3个处理相比较,处理间差异达显著水平(P<0.05)。表明大豆生育期间,甜菜根系分泌物抑制大豆叶片Pn,对大豆光合作用产生负效应。

图2 不同处理下大豆各生育时期净光合速率Fig.2 Net photosynthetic rates at soybean each growing period under different treatments
由表5可知,B、C、D 3个处理IR皆为负值,且在始花期最大。大豆幼苗期、始花期、盛荚期和鼓粒期,处理C大豆叶片净光合速率IR(甜菜对大豆化感作用)分别达-13.9%、-14.2%、-11.7% 和-10.4%,平均IR达-12.6%,处理B大豆叶片净光合速率IR分别达-12.5%、-33.0%、-23.9%和-23.8%。
2.5甜菜根系分泌物对大豆叶片硝酸还原酶(NR)活性影响
NR是硝态氮同化过程关键酶,也是植物代谢中重要调节酶和限速酶。NR活性决定硝态氮代谢速度,NR活性高低对整个氮代谢强弱起关键作用[10]。由图3可知,在大豆生育期中,大豆叶片NR活性均呈单峰曲线变化趋势,R4时期达最大值。V3时期4个处理NR活性差异不显著;在R1和R4两个时期,处理A的NR活性与B、C有明显差异,且差异达显著水平(P<0.05),但与处理D差异不显著;在R6期,与V3、R1和R4时期相比,各处理间NR值均大幅下降,与处理A相比,处理B和C 的NR活性显著降低(P<0.05),说明甜菜对大豆化感作用与资源竞争共同影响,降低大豆NR活性,限制大豆对氮的转化能力。

表5 不同处理下大豆叶片净光合速率的IRTable 5 IR of net photosynthetic rate in soybean leaf under different treatments (%)
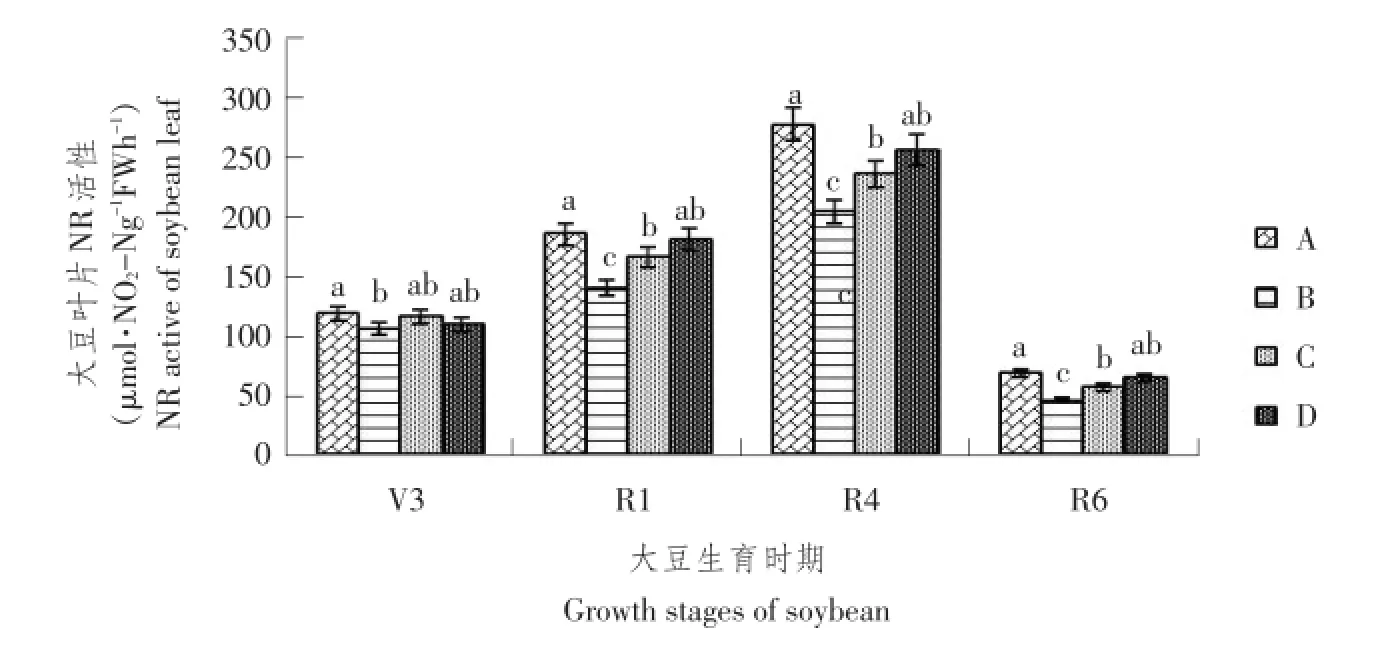
图3 不同处理下大豆各生育时期硝酸还原酶活性Fig.3 NR activities at soybean each growing period under different treatments
由表6可知,B、C、D 3个处理叶片NR活性IR皆为负值,且处理B和C在鼓粒期最低,表明B、C和D3个处理均抑制大豆硝酸还原酶活性。在大豆V3、R1、R4和R6 4个时期,处理B的NR活性IR分别为-11%、-25%、-26%和-33%,平均IR 为-24%;处理C大豆NR活性IR(即甜菜对大豆化感作用)分别达-2%、-11%、-15%和-18%,平均IR为-11%。比较B、C处理的平均IR,得出甜菜对大豆资源竞争作用为13%,且表现为抑制作用。处理D大豆叶片NR活性IR分别达-7%、-3%、-8%和-5%,平均IR为-6%。
2.6甜菜根系分泌物对大豆生长和产量影响
由表7可知,处理A大豆株高和节数高于B、C、D处理,处理B最低,可见化感作用和资源竞争共同影响大豆生长状况,且表现抑制作用。处理A与C相比,处理C株高、节数显著降低(P< 0.05),说明甜菜抑制大豆生长,表现抑制性化感作用;从产量性状上看,每株荚数、每荚粒数、每株粒数、百粒重、单株籽粒产量和生物产量,各处理趋势大致相同,即处理A>D>C>B,且处理间达显著水平(P<0.05)。表明大豆产量受甜菜化感作用影响显著,产量降低。

表6 各处理下大豆叶片NR活性的IRTable 6 IR of NR activity in soybean leaf under different treatments (%)

表7 甜菜根系分泌物对大豆生长和产量影响Table 7 Effects of sugarbeet root exudate on soybean growth and yield
由表8可知,处理B,大豆株高、每株节数、每株荚数、每荚粒数、每株粒数、百粒重、单株籽粒产量和生物产量性状上资源竞争与化感共同作用IR分别为:-13.1%、-13.7%、-15.4%、-18.7%、-27.5%、-4.2%、-33.5%、-11.6%,平均值为-17.2%,甜菜对大豆作用IR达-17.2%。处理C,甜菜对大豆株高、每株节数、每株荚数、每荚粒数、每株粒数、百粒重、单株籽粒产量和生物产量性状的化感作用,IR分别为-8.4%、-8.7%、-8.6%、-11.7%、-18.4%、-1.7%、-19.3%、-8.0%,平均IR为-10.6%,即抑制性化感作用潜力达10.6%。可见,甜菜对大豆单纯化感作用,也会使大豆生长和产量性状指标降低,造成大豆减产。处理B的IR减去处理C的IR为甜菜对大豆土壤养分竞争效应,即甜菜对大豆株高、每株节数、每株荚数、每荚粒数、每株粒数、百粒重、单株籽粒产量和生物产量性状上IR分别:-4.7%、-5.0%、-6.8%、-7%、-9.1%、-2.5%、-14.2%、-3.6%,平均值为-6.6%,说明甜菜对大豆土壤养分竞争为负效应。比较化感作用与地下资源竞争作用发现,甜菜对大豆化感作用大于对大豆地下资源竞争作用。

表8 大豆生长和产量性状抑制率Table 8 IR of soybean growth and yield traits (%)
3 讨 论
研究根系分泌物化感问题关键是试验存在化感作用,但化感作用又和竞争作用分隔,即栽植供体土壤不能与栽植受体土壤有共同交界面。Xu等研究表明,竞争与根密度和土壤深度、无机氮形式和生长季有关,根所占土壤容积和土壤密度作用比空气温度和降水因素大[11]。本试验在化感与竞争真正分离情况下,小缸内与大缸外盆内所装土壤质量保持一致,保证供体与受体竞争关系稳定,可提高试验结果准确性。
本试验中,甜菜根系分泌物对大豆生长和发育有抑制作用。随分泌物浓度增大,大豆发芽率和发芽势逐渐降低。李春杰等研究表明,在裸地12年区,大豆种子在大豆、玉米和亚麻根渗出物中发芽势很低,为30%,在甜菜根渗出物中发芽率最高,为100%,发芽势也高达80%[12]。与本试验结果不同,可见,不同生长环境下,甜菜根系分泌物对大豆发芽影响表现出促进或抑制两种不同效应。
Tang等研究表明,根系分泌物中植物生长抑制剂主要是酚类化合物[13]。本试验中,通过水培法收集甜菜根系分泌物,再用萃取法,通过乙酸乙酯分离纯化根系分泌物,经GC-MS分析,并与NIST05谱库核对,确定各组分名称及结构。鉴定出组分中,酯类种类最多,所占总成分比例也最大。主要是邻苯二甲酸二丁酯和2,6-二叔丁基对甲酚。邻苯二甲酸是甜菜根系分泌物分泌酸类中的主要成分。通过这几种物质对大豆幼苗化感作用试验,可初步判断,2,6-二叔丁基对甲酚及邻苯二甲酸在甜菜对大豆化感作用中起重要作用。Hussain等研究指出,当鸭茅(Dactylics agglomer⁃ate)生长环境中出现天然化合物对羟基苯甲酸时,与光合作用有关的初级代谢产物含量显著降低,光合作用效率降低[14]。本试验发现对大豆幼苗生长有抑制作用的不只是邻苯二甲酸,2,6-二叔丁基对甲酚同样抑制大豆光合作用。
化感物质释放途径很多,如雨雾淋溶、自然挥发、根系分泌、残根分解和植株降解[15]。通过试验分析,D处理各项指标均比处理A低,IR为负值。原因是甜菜对大豆地上部存在化感作用,化感物质通过自然挥发释放到空气中,对临近受体产生影响。因为处理C大豆和甜菜地下部相互独立,比处理A各项指标低,又低于处理D,也说明地下部化感作用,是根系分泌物与微生物共同作用结果。
韩丽梅等对大豆根系分泌物研究中,邻苯二甲酸能显著降低大豆幼苗根系活力,使大豆根系吸收养分和水分能力下降;破坏大豆幼苗叶片细胞膜稳定性,降低抗逆性,导致大豆幼苗生长发育受阻,生物产量下降[16]。本试验通过大豆生理效应分析,在大豆幼苗期、始花期、盛荚期和鼓粒期,处理C中大豆叶片净光合速率IR和叶片硝酸还原酶活性IR皆为负值,表明甜菜化感作用能降低大豆光合作用强度和大豆硝酸还原酶活性。大豆株高、单株节数、以及各项产量性状指标均受到甜菜化感作用抑制。在大豆鼓粒期,大豆叶片净光合速率和硝酸还原酶活性均降低,处理C较处理A均显著降低(P<0.05),与试验中发现该处理发生早衰现象相符。
本试验中大豆产量下降原因是作物产量中90%~95%物质来自光合作用,光合速率与产量呈正相关[17]。甜菜根系分泌物中苯甲酸衍生物抑制大豆净光合速率,植物在光合作用中吸收二氧化碳减少,合成的碳水化合物减少,干物质减少,同时叶绿素含量减少,叶片功能过早退化,发生早衰;大豆是喜氮植物,化感物质降低硝酸还原酶活性,使氮的无机同化能力降低,农艺性状及产量下降。苯甲酸衍生物对大豆生长及生理活性影响,尚需进一步研究。
甜菜对大豆化感作用抑制率为-10.6%,甜菜对大豆地下资源竞争抑制率为-6.6%。说明化感作用影响大于资源竞争。在日常套作及轮作生产中要注意植物间化感作用影响,这种影响分为促进或抑制两个方向[18-20],而本试验中甜菜对大豆化感作用表现为抑制作用。
本研究主要以大豆生长发育状况反映甜菜对大豆化感作用,而甜菜对大豆土壤状况影响需进一步试验分析。
4 结 论
甜菜根系分泌物能抑制大豆发芽势和发芽率,延长发芽时间,胚根长度受抑制,同时抑制大豆生长,降低大豆净光合速率和硝酸还原酶活性,导致大豆产量减少。在甜菜根系分泌物中,2, 6-二叔丁基对甲酚和邻苯二甲酸为大豆主要化感物质。
[1]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Journal ofchemical ecology,1988,14(1):181-187.
[2]Xiong J,Lin W X,Zhou J J,et al.Analysis on resource competi⁃tion and allelopathic effect on barnyardgrass in rice accessions ex⁃posed to different N application rates[J].Chin J of Appl Ecol, 2005,16(5):885-889.
[3]周艳丽,王艳,李金英,等.大蒜根系分泌物的化感作用[J].应用生态学报,2011,22(5):1368-1372.
[4]王光华,金剑,韩晓增,等.不同土地管理方式对黑土土壤微生物量碳和酶活性的影响[J].应用生态学报,2007,18(6):1275-1280.
[5]刘晓冰,王光华,金剑,等.作物根际和产量生理研究[M].北京:科学出版社,2010.
[6]高兴武,史淑芝,程大友,等.谈甜菜连作障碍[J].中国甜菜糖业,2008(2):19-22.
[7]沈荔花,梁义元,何华勤,等.水稻化感生物测试方法的比较及应用[J].应用生态学报,2004,15(9):1575-1579.
[8]马凤鸣,高继国.硝酸还原酶活力作为甜菜氮素营养诊断及预测产糖量指标的研究[J].中国农业科学,1996(5):16-22.
[9]Riarcher W.植物生理生态学[M].翟志席,郭玉海,马永泽,译.北京:中国农业大学出版社,1997.
[10] 刘丽,甘志军,王宪泽.植物氮代谢硝酸还原酶水平调控机制的研究进展[J].西北植物学报,2004,24(7):1355-1361.
[11]Xu X,Ouyang H,Richter A,et al.Spatio-temporal variations de⁃termine plant-microbe competition for inorganic nitrogen in an al⁃pine meadow[J].Journal of Ecology,2011,99(2):563-571.
[12] 李春杰,赵丹,司兆胜,等.不同轮作系统中作物根渗出物对大豆种子萌发的化感作用[J].大豆科学,2013,32(2):206-210.
[13]Tang C S,Young C C.Collection and identification of allelopathic compounds from the undisturbed root system of bigalta limpo⁃grass(Hemarthria altissima)[J].Plant Physiology,1982,69(1): 155-160.
[14]Hussain M I,Reigosa M J,Al-Dakheel A J.Biochemical,physio⁃logical and isotopic responses to natural product p-hydroxybenzo⁃ic acid in Cocksfoot(Dactylis glomerata L.)[J].Plant Growth Reg⁃ulation,2015,75(3):783-792.
[15]拱健婷,张子龙.植物化感作用影响因素研究进展[J].生物学杂志,2015(3):73-77.
[16]韩丽梅,王树起,鞠会艳,等.大豆根分泌物的鉴定及其化感作用的初步研究[J].大豆科学,2000,19(2):119-125.
[17]许大全,沈允钢.光合作用与作物产量[M].北京:科学出版社, 1992.
[18]Ma Y,Wang X,Wei M,et al.Accumulation of phenolic acids in continuously cropped cucumber soil and their effects on soil mi⁃crobes and enzyme activities[J].Chinese Journal of Applied Ecol⁃ogy,2005,16(11):2149-2153.
[19]Xiao H,Peng S,Zheng Y,et al.Interactive effects between plant allelochemicals,plant allelopathic potential and soil nutrients[J]. Chinese Journal of Applied Ecology,2006,17(9):1747-1750.
[20]戴建军,宋朋慧,闫暮春,等.不同种植方式对苗期大豆,玉米根际土壤酶活性及微生物量碳氮的影响[J].东北农业大学学报,2013,44(2):17-22.
Study on allelopathy of sugar beet root exudates on soybean/LI Caifeng,
CHEN Ming,MA Fengming,GAI Zhijia,GUO Jian,WANG Yubo(School of Agriculture,Northeast Agricultural University,Harbin 150030,China)
With sugar beet as the donor crop and soybean as the acceptor crop,the allelopathy of sugar beet root exudates on soybean's growth and development was researched.The results showed that the allelopathic effect of sugar beet root exudates on soybean increased with an increase in the concentration of the exudates.Total 31 kinds of sugar beet root exudates were found in the root exudates,among which there were four alkanes(1.44%),twelve esters(62.62%),one phenol(11.80%),five acids(10.33%),one olefin (3.22%),two alcohols(1.23%),four naphthalenes(7.44%),one ketone(0.43%),one aldehydes(0.67%),and others(0.82%).In the sugar beet root exudates,2,6-di-tert-butyl-p-cresol and phthalate were the main allelochemicals,and they showed the inhibition on soybean.The sugar beet root exudates inhibited the soybean's growth and development significantly;at the period of seedling,flowering and poding,filling,IR(Inhibitory rate)of the net photosynthetic rate of soybean leaf were-13.9%,-14.2%,-11.7%and-10.4%,respectivelyand IR of the net nitrate reductase activity were-2%,-11%,-15%,and-18%;meanwhile,IR of of sugar beat on the soybean height,nodes per plant,pods per plant,seeds per pod,seeds per plant,kernel weight,seed yield per plant,biomass yield were-8.4%,-8.7%,-8.6%,-11.7%,-18.4%,-1.7%,-19.3%,-8.0%,respectively. The average value was-10.6%,which meant that the allelopathic inhibtition potential was 10.6%.
sugar beat;allelopathy;root exudate;soybean;seed germination
S566.3
A
1005-9369(2016)08-0021-10
2016-12-28
国家自然科学基金项目(31371568)
李彩凤(1965-),女,教授,博士,博士生导师,研究方向为作物栽培生理与分子生物学。E-mail:licaifeng@neau.edu.cn
