甜瓜遗传连锁图谱构建及果实相关性状QTL定位
2016-09-24栾非时卢丙洋周慧文王学征
栾非时,卢丙洋,,周慧文,,王学征,
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺学院,哈尔滨 150030)
甜瓜遗传连锁图谱构建及果实相关性状QTL定位
栾非时12,卢丙洋1,2,周慧文1,2,王学征1,2
(1.农业部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨150030;2.东北农业大学园艺学院,哈尔滨150030)
试验以厚皮甜瓜品系M4-5为母本材料,薄皮甜瓜品系M1-15为父本材料,配制杂交组合获得F1、F2代,研究甜瓜果实相关性状遗传规律。对M4-5和M1-15两亲本间存在SNP突变位点序列作CAPS检测,共设计CAPS标记523对,CAPS标记223对,多态率43.8%。利用多态性引物标记F2代群体,构建甜瓜遗传连锁图谱,该图谱包含195个标记,12个连锁群,1 702.55 cM,标记间平均距离8.78 cM。28个,贡献率介于3.4974%~17.9684%。其中与果实形状相关位点14个,与产量相关位点9个,与可溶性固形物含量相关位点5个。
甜瓜;果实性状;遗传连锁图谱;QTL
网络出版时间2016-8-24 15:04:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1504.004.html
栾非时,卢丙洋,周慧文,等.甜瓜遗传连锁图谱构建及果实相关性状QTL定位[J].东北农业大学学报,2016,47(8):9-20.
Luan Feishi,Lu Bingyang,Zhou Huiwen,et al.Construction of genetic linkage map and QTL location for fruit-related traits in melon[J].Journal of Northeast Agricultural University,2016,47(8):9-20.(in Chinese with English abstract)
甜瓜(Cucumis melon L.)是被子植物亚门、双子叶植物纲、葫芦目、葫芦科、属一年生蔓性草本植物。染色体2n=2x=24。我国现为世界甜瓜种植面积最大、产量最高的国家。果实形状、体积、果重、可溶性固形物含量等性状是影响果实品质重要因素[1]。目前,果实形状、果实重量、可溶性固形物含量等是甜瓜果实性状基因定位研究主要对象。Périn等用同一个圆形果实甜瓜品系分别与两个长形果实甜瓜品系杂交构建两个重组自交系群体,定位和分析控制甜瓜果形基因,两个群体中果形性状主要受果实长度影响,与果实形状和子房形状相关的QTL位点存在大量共区间现象,说明在子房发育过程中活跃着大量控制果实形状基因,可能存在基因多效现象[2]。Monforte等利用F2和DH群体,共检测到20个与甜瓜早熟性、果形及可溶性固形物含量相关QTL位点。在9号连锁群检测到1个与甜瓜外果皮颜色相关位点,在1号连锁群检测到和绿色果肉颜色相关位点。控制橙色果肉颜色的遗传因素相对复杂,在2号和12号连锁群分别找到和橙色果肉颜色相关位点,扩大群体规模有利于阐明控制橙色果肉遗传因素[3]。果实重量是影响产量重要因素。Zalapa等在探究甜瓜产量相关性状时共检测到包括单株果重、单果平均重在内5个性状的37个QTL位点,试验结果表明甜瓜种质资源中高度分枝类型的基因更具增产潜力[1]。Obando等以RILs群体为基础检测到134个与甜瓜果实品质性状相关QTL位点,其中包括与形态学和外观性状相关位点52个,与颜色性状相关位点69个,余下23个位点与果实风味性状相关[4]。Diaz等参考国际葫芦科基因组计划数据,将8个甜瓜图谱整合为一个图谱,分析果实相关性状发现果实形状遗传可能性明显高于果实重量和可溶性固形物含量[5]。Diaz等以中等大小、长果形的印度地方甜瓜品种PI1124112和果形较大、椭圆形西班牙栽培甜瓜品种PS为亲本材料杂交获得F2代群体,利用基于遗传连锁分析QTL定位,共检测到10个和果实形状相关QTL位点,分别与果实长度、果实直径和果形相关,3个性状中均检测到贡献率较大的QTL位点[6]。Ramamurthy等研究甜瓜果实形状和子房形状过程中,发现两者之间存在显著正相关,与Périn等结果相似,说明甜瓜果实形状在开花期之前已确定。Ramamurthy等利用基于遗传连锁分析的QTL定位时,共检测到31个与甜瓜果实品质和形态性状相关的QTL位点,其中23个位点得到证实,8个新定位的QTL位点涉及果实形状、单株总果重、可溶性固形物含量、果肉颜色、子房形状等[7]。
本试验以厚皮甜瓜品系M4-5为母本材料,薄皮甜瓜品系M1-15为父本材料,配制杂交组合获得F1、F2代,研究甜瓜果实相关性状遗传规律,利用CAPS标记构建遗传连锁图谱,通过分子标记找到控制果实相关性状位点,为进一步开展甜瓜果实相关基因定位和克隆研究提供理论依据。
1 材料与方法
1.1田间试验材料
以遗传和表型差异极大作为亲本材料选择依据,并配置杂交组合用以表型数据调查和图谱构建。母本材料为厚皮甜瓜伊丽莎白(M4-5),中早熟品系,果实圆形(果形指数0.9),果皮厚,果实大(单果重0.96 kg)。父本材料为薄皮甜瓜M1-15,早熟品系,果实长椭圆形(果形指数1.5),果皮薄,果实小(单果重0.24 kg)。两亲本材料来源于东北农业大学园艺学院西甜瓜分子育种研究室。利用母本M4-5和父本M1-15配置杂交组合,获得F1代,F1代自交获得F2代。
1.2田间试验设计
2015年4月~2015年8月,在东北农业大学设施园艺工程中心1号大棚播种P1、P2、F1和F2代群体,采用完全随机区组设计,3次重复,亲本P1、P2及F1各种植30株,每小区种植10株。随机种植F2300株(见图1),株行距35 cm×50 cm。待果实成熟后测定果实相关性状。

图1 田间布局Fig.1 Distribution in plastic greenhouse
1.3果实性状调查方法
将收获的父、母本,F1和F2群体中成熟甜瓜果实分株标号,每株收获1个果实,每个果实每个性状测定3次,取测量3次平均值作结果,其中父、母本,F1代各测定30株,F2代测定284株,具体测定方法如下:
单果重:电子天平测量;
外果皮和食用果皮硬度:硬度计测量;
种腔、果实长度、宽度:直尺测量;
种腔与果实比例:种腔与果实长度比值;
可溶性固形物:手持糖度仪测定。
1.4分子标记试验内容与方法
1.4.1CAPS分子标记开发
以两亲本材料基因组重测序数据为依据,已发布甜瓜基因组数据为参考,利用东北农业大学园艺学院西甜瓜实验室自编Perl语言脚本提取SNP位点前后约500 bp碱基序列,利用SNP2CAPS[8]软件查找存在差异的酶切位点候选序列,根据序列中突变位点所处位置,选择适合CAPS标记开发的序列设计引物。
1.4.2DNA提取
待M4-5(♀)、M1-15(♂)、F1代及其自交获得的F2代群体定植缓苗后,采集幼嫩叶片,分袋保存,分别标号,以免混淆,用以提取DNA。
采用改良CTAB法提取植物基因组DNA[9],应用氯仿、异戊醇(24 ϑ 1)抽提3次,以保证DNA纯度。提取亲本及F1的DNA用于CAPS标记多态性筛选,F2单株DNA用于遗传连锁分析。
1.4.3CAPS标记筛选与验证
将引物母液按体积比1 ϑ 49稀释后,采用降落式PCR(Touchdown PCR)反应程序进行引物PCR扩增,PCR反应程序参照束永俊等方法[10],步骤略有改动,PCR产物在1%琼脂糖凝胶电泳上检验。
参照限制性内切酶操作说明书对酶切位点加以验证,利用Eco RⅠ、HindⅢ、PstⅠ、Bam HⅠ 4种限制性核酸内切酶分别对相应PCR产物酶切验证,酶切体系为15.3 μL,酶切反应在水浴锅中进行,具体酶切温度根据4种不同限制性内切酶最适反应温度设定,均为37℃。1%琼脂糖凝胶电泳酶切产物检验。
1.5遗传连锁图谱构建
利用IciMapping V3.3对具有多态性且应用到F2代基因分型的分子标记构建遗传图谱,采用复合区间作图法构建遗传连锁图谱。利用MapChart2.2软件绘制遗传连锁图谱,依次将连锁群命名为LG1~LG12。
1.6QTL定位分析方法
QTL分析使用IciMapping V3.3软件,采用复合区间作图法,以1.0 cM步行速度在全基因组内扫描。以性状英文缩写、连锁群编号和QTL编号为依据命名其QTL。
2 结果与分析
2.1甜瓜果实相关性状表型数据分析
2.1.1亲本及F1果实表型数据分析
由表1可知,两亲本M4-5和M1-15果实各性状存在差异,母本M4-5单果重、果实长、果实宽、种腔直径均明显大于父本M1-15,仅果形指数小于父本M1-15,可溶性固形物和种腔与果实比这两个性状两亲本差异不显著。在F1代果实中,单果重、果实宽、果形指数、种腔直径及种腔与果实比均介于两亲本之间,而果实长度存在超亲现象,明显大于两亲本值,可溶性固形物含量明显小于两亲本。
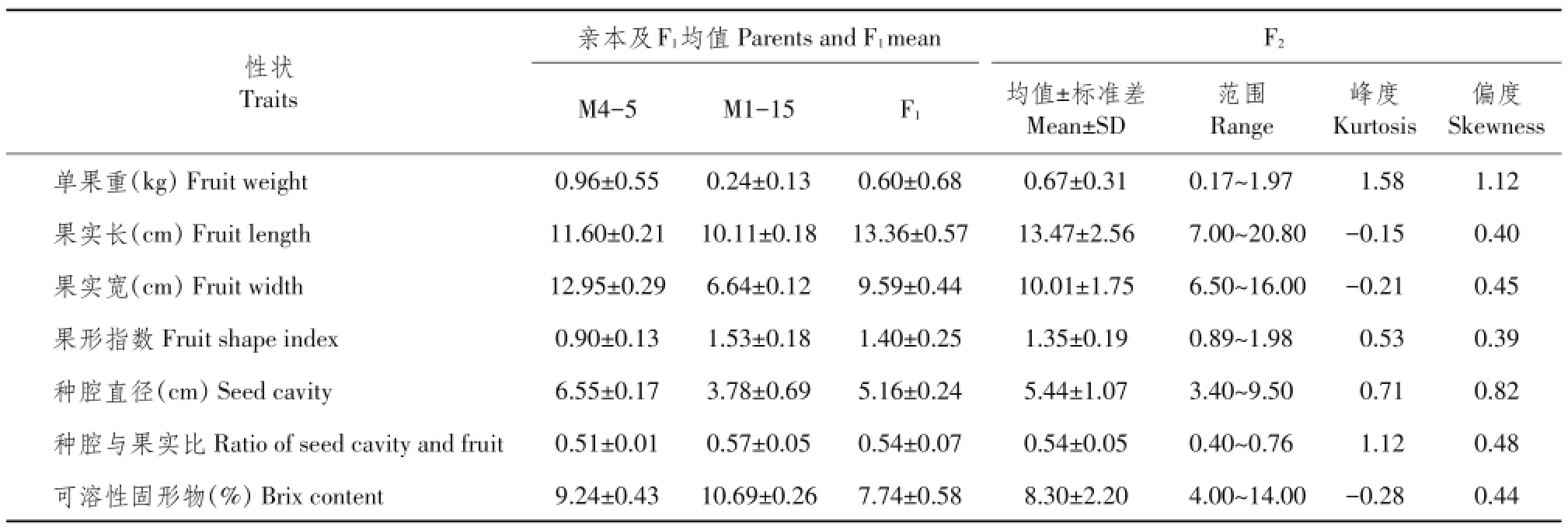
表1 亲本、F1及F2群体果实相关性状表现Table 1 Fruit-related trait separation proportion of the parental materials,F1and F2generation
2.1.2果实单果重表型数据分析
由图2可知,在单果重方面,母本M4-5单果重为(0.96±0.55)kg,父本M1-15单果重为(0.24± 0.13)kg,F1单果重为(0.60±0.68)kg,介于两亲本之间。在F2代果实中,单果重呈连续分离状态,且存在超亲现象,单果重分离范围0.17~1.97 kg,整体分离趋势基本符合正态分布,表明单果重受多个基因共同控制,同时存在主效基因,为数量性状,可作QTL定位分析。
2.1.3果实长度表型数据分析
由图3可知,在果实长度方面,母本M4-5果实长度为(11.6±0.21)cm,父本M1-15果实长度为(10.11±0.18)cm,F1果实长度为(13.36±0.57)cm,果实长度均高于两亲本。在F2代果实中,果实长度分离范围7.00~20.80 cm,最高值和最低值均出现超亲遗传,分离趋势基本符合正态分布,表明果实长度受多个基因共同控制,同时存在主效基因,为数量性状,可作QTL定位分析。

图2 果实单果重次数分布Fig.2 Fruit weight proportion distribution in F2population

图3 果实长度次数分布Fig.3 Fruit length proportion distribution in F2population
2.1.4果实宽度表型数据分析
由图4可知,在果实宽度方面,母本M4-5果实宽度为(12.95±0.29)cm,父本M1-15果实宽度为(6.64±0.12)cm,F1果实宽度为(9.59±0.44)cm,F1代表型数据介于父本和母本之间。在F2代果实中,果实宽度为6.50~16.00 cm,与两亲本相比存在超亲现象,分离趋势呈连续正态分布,表明果实宽度受多个基因共同控制,同时存在主效基因,为数量性状,可作QTL定位分析。
2.1.5果形指数表型数据分析
由图5可知,在果形指数方面,母本M4-5果形指数为0.90±0.13,果实为近圆形,父本M1-15果形指数为1.53±0.18,果实为长椭圆形,F1代果形指数为1.40±0.25,果形指数介于两亲本之间,且偏向父本M1-15,为长椭圆形。
在F2代果实中,果形指数分离范围0.89~ 1.98,既有亲本类型的近圆形和长椭圆形,也存在两者之间过渡类型且有超亲现象。分离情况呈连续正态分布,表明果形指数为数量性状,可作QTL定位分析。
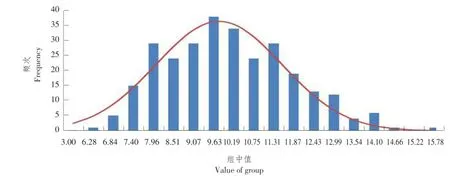
图4 果实宽度次数分布Fig.4 Fruit width proportion distribution in F2population

图5 果形指数次数分布Fig.5 Fruit shape index proportion distribution in F2population
2.1.6种腔表型数据分析
由图6可知,母本M4-5种腔直径为(6.55± 0.17)cm,父本M1-15种腔直径为(3.78±0.69)cm,父母本差异显著。F1代种腔直径为(5.16±0.24)cm,介于两亲本之间,且偏向于父本。F2代种腔直径3.40~9.50 cm,存在超亲现象,分离情况呈正态分布,为数量性状,可作QTL定位分析。
2.1.7种腔与果实比表型数据分析
由图7可知,种腔与果实比可显示果实可食用率,通过种腔与果实比数据显示,M4-5和M1-15可食用率基本相同,F1代数据介于两亲本之间,F2代群体中可食用率出现较大变异,种腔与果实最大比值为0.76,最小比值为0.40,呈正态分布,为数量性状。
2.1.8可溶性固形物表型数据分析
由图8可知,母本M4-5可溶性固形物含量为(9.24±0.43)%,父本M-15可溶性固形物含量为(10.69±0.26)%,F1代果实可溶性固形物含量低于两亲本,F2代群体可溶性固形物含量4.00%~14.00%,存在较大幅度变异,均出现超亲遗传现象。F2代群体呈正态单峰分布,表明可溶性固形物含量受多个基因共同控制,同时存在主效基因,为数量性状。

图6 种腔次数分布Fig.6 Seed cavity proportion distribution in F2population
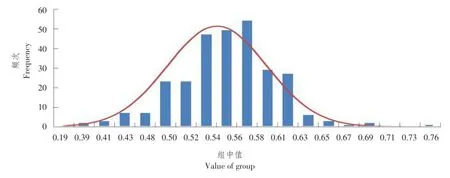
图7 种腔与果实比次数分布Fig.7 Ratio of seed cavity and fruit proportion distribution in F2population

图8 可溶性固形物次数分布Fig.8 Brix content proportion distribution in F2population
2.2甜瓜遗传连锁图谱构建
2.2.1甜瓜基因组DNA提取
利用改良CTAB法提取基因组DNA,经1%琼脂糖凝胶电泳检测,电泳结果见图9,父母本、F1及F2代分离群体DNA浓度和纯度均可用于分子标记检测,无RNA和蛋白质,对分子标记检测不存在影响。

图9 甜瓜基因组DNAFig.9 Genomic DNA of melon
2.2.2CAPS引物筛选与验证
通过测序结果,根据HindⅢ、Eco RⅠ、Bam HⅠ和PstⅠ酶切位点信息对M4-5和M1-15两亲本间有存在SNP突变位点序列作CAPS检测,利用Primer 6设计并选用523对引物。利用提取的亲本及F1代DNA,对设计的523对CAPS引物作PCR和酶切反应,验证引物多态性和共显性。图10为部分有多态性引物经PCR和酶切反应后产物电泳条带。验证结果显示,523对CAPS引物中有229对存在多态性和共显性,多态率达43.8%。
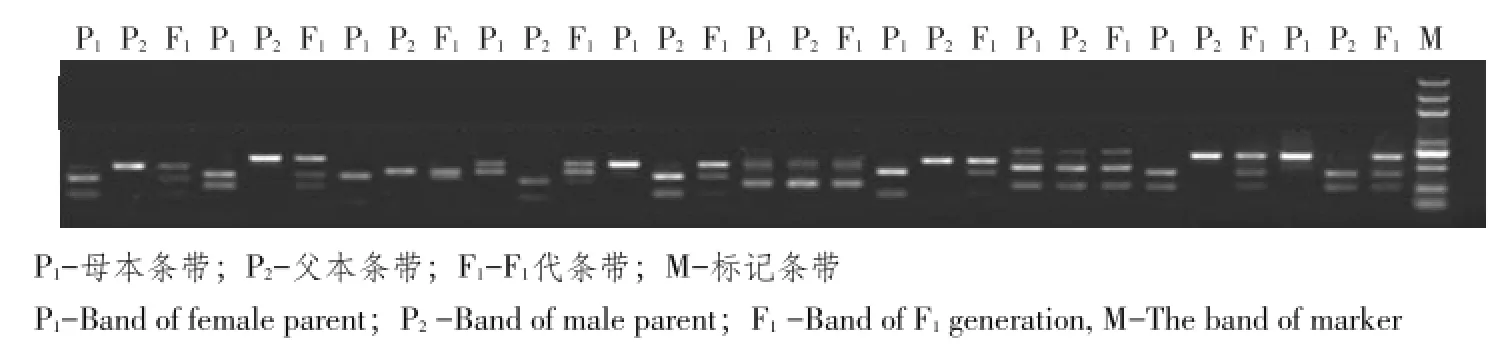
图10 CAPS引物在亲本及F1代多态性表现Fig.10 Polymorphism of CAPS markers among parental materials and F1generation
2.2.3甜瓜遗传图谱构建
利用筛选出的多态性引物在F2代群体中作分析,IciMapping V3.3软件对多态性CAPS标记连锁作图,排除条带不清与偏分离标记,用于作图引物共计195对,如图11所示,构建一张包含12个连锁群,覆盖基因组长度1 702.55 cM,标记间平均距离8.78 cM的甜瓜F2代临时群体遗传图谱,图谱中来源于同一条染色体CAPS标记均位于相同连锁群上,将连锁群依次命名为LG1~LG12,连锁群长度介于105.16~187.34 cM。该图谱最长连锁群为LG2,长度为187.34 cM,包含18个CAPS标记,最短连锁群为LG10,长度105.16 cM,包含12个CAPS标记(见表2和图11),包含最多标记连锁群为LG4,共23个标记,包含标记最少连锁群为LG10,共12个标记。连锁群LG10为包含标记最少,长度最短连锁群。
2.3果实相关性状QTL定位分析
2.3.1单果重QTL分析
对于单果重,如表3所示,共定位到3个QTL,均为微效QTL位点,分别位于连锁群LG5、LG6和LG11上。其中FW5.1和FW6.1对单果重起增加作用,而FW11.1起减小作用。这3个QTL位点中贡献率最大的是位于连锁群LG5上的FW5.1,贡献率为6.8534%,定位在标记M5-37和M5-22之间,距离M5-37距离1.02 cM,距离M5-22距离0.33 cM,距离两标记距离均相对较近。贡献率最小的为定位在连锁群LG11的FW11.1,贡献率仅3.7775%,位于标记M11-2和M11-22之间,距离两标记距离分别为9.65和0.28 cM,该位点只与一端标记距离近,而与另一端标记距离则较远。
2.3.2果实长度QTL分析
通过田间数据与分子数据结合分析,共检测到与果实长度相关的QTL位点5个(见表4),其中包含1个贡献率>10%的QTL位点,其余QTL位点贡献率3.4974%~4.6475%。这5个QTL分别位于连锁群LG3、LG5、LG6、LG9和LG11上。除FL5.1对增加甜瓜果实长度表现为正的加性效应外,其余4个QTL位点对增加甜瓜果实长度表现为负的加性效应,即降低果实长度。定位在连锁群LG3 的FL3.1,定位在连锁群LG6的FL6.1和定位在连锁群LG11的FL11.1这3个QTL位点均与一侧标记距离较近,分别为0.04、0.39和0.28 cM,而距另一侧标记相对较远,分别为13、10.93和9.65 cM。贡献率最大的FL5.1定位距离与其他QTL位点相比,与相邻标记间距离相对较远,分别为14和10.01 cM。

图11 甜瓜遗传连锁图谱及果皮与果实相关性状定位位点Fig.11 Genetic linkage map and locus for pericarp-related and fruit-related traits of melon

表2 甜瓜遗传连锁图谱基本参数Table 2 Parameter of melon genetic linkage map
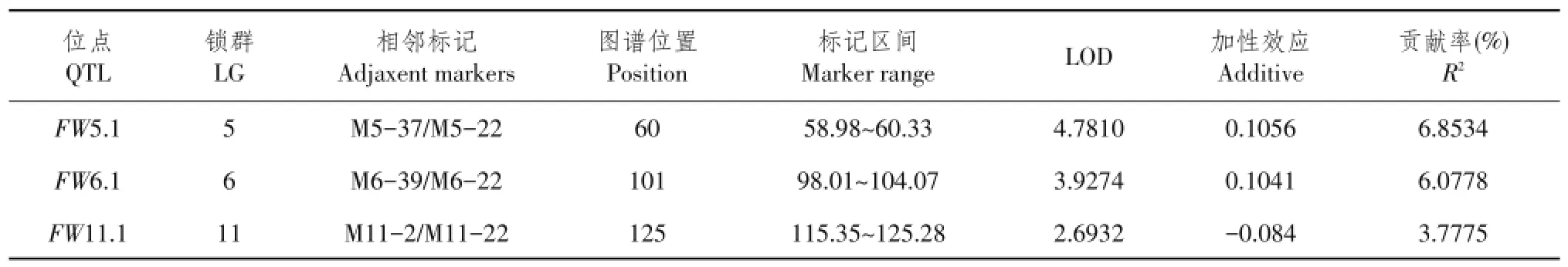
表3 甜瓜单果重QTL遗传效应分析Table 3 Genetic effects analysis of QTLs for fruit weight in melon
2.3.3果实宽度QTL分析
如表5所示,关于果实宽度仅定位到两个QTL位点,分别位于连锁群LG5和LG6上,两标记贡献率分别达7.1447%和9.4046%,同时对于果实宽度均起增加作用。在连锁群LG5上定位到的FWID5.1距离标记M5-48距离为3.01 cM,距离标记M5-49距离为0.64 cM。在连锁群LG6上定位到的FWID6.1距离两标记距离分别为2.99和3.07 cM。与定位到的关于果实长度QTL位点相比,关于果实宽度的QTL位点定位距离相对较近。
2.3.4果形指数QTL分析
定位到与果形指数相关的QTL位点共计7个(见表6),分别位于连锁群LG1、LG2、LG4、LG7、LG9和LG10。其中贡献率为17.9684%的主效QTL,位于连锁群LG7上,该位点被定位在标记M7-39和M7-24之间,距离两标记分别为1.06 和1.80 cM。在连锁群LG4上,共检测到两个与果形指数有关QTL位点,两位点贡献率为7个QTL中最小。这7个关于果形指数的QTL贡献率累计达41.55%。在LG2上定位到的FSI2.1与标记M2-12紧密连锁,距离仅为0.16 cM。在定位到与果形指数相关的QTL位点中,定位结果与果实长度QTL位点一样,也存在QTL位点只与一侧标记紧密连锁,与另一标记距离相对较远的情况。

表5 甜瓜果实宽度QTL遗传效应分析Table 5 Genetic effects analysis of QTLs for fruit width in melon

表6 甜瓜果形指数QTL遗传效应分析Table 6 Genetic effects analysis of QTLs for fruit shape index in melon
2.3.5种腔QTL分析
种腔体积既影响果实食用率同时也影响产量,种腔越小,食用率越高,产量也越高。在种腔定位中,共定位到3个QTL位点,分别位于连锁群LG4、LG5和LG6(见表7),其中定位在连锁群LG5上的QTL位点SC5.1与相邻两标记距离最近,分别为0.67和0.95 cM。定位在LG6上的QTL位点SC6.1贡献率最大,达7.8495%。但并未定位到关于种腔的主效QTL位点。同时发现种腔和果实宽度共同定位在标记M6-39和M6-22之间。
2.3.6果实可溶性固形物含量QTL分析
如表8所示,共定位到关于可溶性固形物含量QTL位点5个,连锁群LG2上存在1个,LG6上存在1个,LG7上存在2个,LG9上存在1个。5个QTL贡献率达3.8933%-5.7898%,BRC6.1和BRC9.1加性效应值为负值,表明对果实可溶性固形物含量起减小作用,其余QTL加性效应值为正值,对果实可溶性固形物含量起增加作用。
2.3.7种腔与果实比QTL分析
种腔与果实比可从侧面反映果皮厚度及可食用率,比值越小可食用率越大。结合表型数据与分子数据,共计定位到3个QTL位点,分别位于连锁群LG4、LG8和LG9上。其中CFR4.1加性效应为正,表明增加种腔与果实比,即对可食用率起降低作用,而其余位点加性效应为负,表明对可食用率起增加作用。
在定位距离上,CFR4.1和CFR8.1出现与一侧标记紧密连锁的情况,与另一侧标记距离相对较远。CFR9.1与两标记间距离分别为4.87和2.08 cM(见表9)。

表7 甜瓜种腔QTL遗传效应分析Table 7 Genetic effects analysis of QTLs for seed cavity in melon

表8 甜瓜可溶性固形物QTL遗传效应分析Table 8 Genetic effects analysis of QTLs for brix content in melon

表9 甜瓜果实与种腔比QTL遗传效应分析Table 9 Genetic effects analysis of QTLs for seed cavity and fruit ratio in melon
3 讨 论
3.1基于重测序的分子标记开发
本研究用于构建遗传连锁图谱的195个CAPS分子标记均源于甜瓜基因组重测序数据开发,是该图谱最显著的特点。
与其他标记相比,CAPS标记具有以下优势:①两亲本材料序列比对后设计的CAPS引物具有更强针对性和更高多态性,本试验中CAPS引物多态性达43.8%。②用琼脂糖凝胶电泳即能对CAPS标记检测,方便且易于观测。③基因组中数量庞大的单碱基突变为构建高饱和遗传连锁图谱提供更大可能性。④多数单碱基突变位点位于基因编码区及功能区,利于对相关性状精细定位。⑤所构建遗传连锁图谱与实际染色体相对应,基因定位更有实际意义。
3.2果实相关性状分析及QTL定位
通过相关性分析结果显示,甜瓜果实性状大部分均显著相关,在定位分析中,这些性状也均在相同连锁群上,有的甚至定位在相同区域。这种现象存在于甜瓜中[7],也存在于其他作物中,如西瓜、茄子、辣椒、番茄、玉米、红麻等[11-19]。Ramamurthy等研究表明,与甜瓜果实长度、果实宽度、果形指数、单果重、果肉厚度等相关QTL位点富集于连锁群LG8上[7],本研究结果也出现QTL簇,QTL聚集在连锁群LG6和LG9上,在LG6上同时定位到关于果实形状、产量及食用果皮厚度和裂果等相关性状位点,在LG9上定位到果实形状、产量以及外果皮类型等相关性状位点。对于这种现象,有学者认为与基因多因一效和一因多效遗传机制有关[20-21],为聚合多种优良性状分子育种手段奠定理论基础。
4 结论
4.1甜瓜遗传图谱构建
利用生物信息学分析软件挖掘SNP位点,对M4-5和M1-15两亲本间存在SNP突变位点序列作CAPS检测,共设计CAPS标记523对,筛选出在亲本间有多态性CAPS标记223对,多态率43.8%。利用多态性引物对F2代群体作标记分析,构建甜瓜遗传连锁图谱,该图谱包含195个标记,12个连锁群,覆盖基因组长度1 702.55 cM,标记间平均距离8.78 cM。该图谱最长连锁群为LG2,最短连锁群为LG10。
4.2甜瓜果实相关性状遗传分析
果实相关性状包括果实形状、产量、可溶性固形物,研究表明这些与果实相关性状均为数量性状。通过遗传分析和相关性研究发现果皮及果实相关性状密切相关。结合表型数据与分子数据,共计定位到果皮及果实相关性状位点28个,并明确其在连锁群上分布情况及位点遗传效应。在果实相关性状定位中,与形状相关位点共计14个,与产量相关位点共计9个,与可溶性固形物含量相关位点5个。
[1]Zalapa J E,Staub J E,Mccreight J D,et al.Detection of QTL for yield-related traits using recombinant inbred lines derived from exotic and elite US western shipping melon germplasm[J].Theo⁃retical&Applied Genetics,2007,114(7):1185-1201.
[2]Périn C,Hagen L S,Giovinazzo N,et al.Genetic control of fruit shape acts prior to anthesis in melon(Cucumis melo L.)[J].Molec⁃ular Genetics&Genomics Mgg,2002,266(6):933-941.
[3]Monforte A J,Oliver M,Gonzalo M J,et al.Identification of quan⁃titative trait loci involved in fruit quality traits in melon(Cucumis melo L.)[J].Tag Theoretical&Applied Genetics Theoretische Und Angewandte Genetik,2004,108(4):750-758.
[4]Obando J,Fernández-Trujillo J P,Martinez J A,et al.Identifica⁃tion of melon fruit quality quantitative trait loci using near-isogen⁃ic lines[J].Journal of the American Society for Horticultural Sci⁃ence,2008,133(1):139-151.
[5]Díaz A,Fergany M,Formisano G,et al.A consensus linkage map for molecular markers and quantitative trait loci associated with economically important traits in melon(Cucumis melo L.)[J]. BMC Plant Biology,2011,11(2):121-136.
[6]Díaz A,Zarouri B,Fergany M,et al.Mapping and introgression of QTL involved in fruit shape transgressive segregation into‘piel de sapo,melon(Cucucumis melo L.)[J].PloS One,2014,9(8): e104188.
[7]Ramamurthy R K,Waters B M.Identification of fruit quality and morphology QTLs in melon(Cucumis melo)using a population de⁃rived from flexuosus and cantalupensis botanical groups[J].Eu⁃phytica,2015,204(1):1-15.
[8]Thiel T,Kota R,Grosse I,et al.SNP2CAPS:A SNP and INDEL analysis tool for CAPS marker development[J].Nucleic Acids Re⁃search,2004,32(1):5.
[9]Luan F,Delannay I,Staub J E.Chinese melon(Cucumis melo L.) diversity analyses provide strategies for germplasm curation,ge⁃netic improvement,and evidentiary support of domestication pat⁃ terns[J].Euphytica,2008,164(2):445-461.
[10]束永俊,李勇,吴娜拉胡,等.大豆EST-SNP的挖掘、鉴定及其CAPS标记的开发[J].作物学报,2010,36(4):574-579.
[11]Chaim A B,Paran I,Grube R C,et al.QTL mapping of fruit-relat⁃ed traits in pepper(Capsicum annuum)[J].Theoretical&Applied Genetics,2001,102(6-7):1016-1028.
[12]程瑶,刘识,朱子成,等.西瓜糖含量相关性状的QTL分析[J].中国蔬菜,2016(2):24-31.
[13]乔军,陈钰辉,王利英,等.茄子果形的QTL定位[J].园艺学报, 2012,39(6):1115-1122.
[14]Saliba-Colombani V,Causse M,Langlois D,et al.Genetic analy⁃sis of organoleptic quality in fresh market tomato.1.Mapping QTLs for physical and chemical traits[J].Theoretical&Applied Genetics,2001,102(2-3):259-272.
[15]Prothro J,Sandlin K,Abdel-Haleem H,et al.Main and epistatic quantitative trait loci associated with seed size in watermelon[J]. Journal of the American Society for Horticultural Science Ameri⁃can Society for Horticultural Science,2012,137(6):452-457.
[16]Katherine S,Jason P,Adam H,et al.Comparative mapping in wa⁃termelon[Citrullus lanatus(Thunb.)Matsum.et Nakai][J].Tag Theoretical&Applied Genetics Theoretische Und Angewandte Genetik,2012,125(8):1603-1618.
[17]Ren Y,Mcgregor C,Zhang Y,et al.An integrated genetic map based on four mapping populations and quantitative trait loci asso⁃ciated with economically important traits in watermelon(Citrullus lanatus)[J].BMC Plant Biology,2014,14(1):1.
[18] 赵璞,刘瑞响,李成璞,等.基于掖478导入系的玉米产量性状QTL鉴定[J].中国农业科学,2011,44(17):3508-3519.
[19] 陈美霞,祁建民,方平平,等.红麻6个重要产量性状的QTL定位[J].中国农业科学,2011,44(5):874-883.
[20]Katherine S,Jason P,Adam H,et al.Comparative mapping in wa⁃termelon[Citrullus lanatus(Thunb.)Matsum.et Nakai][J].Tag Theoretical&Applied Genetics Theoretische Und Angewandte Genetik,2012,125(8):1603-1618.
[21]Zhang X,Rhodes B,Wang M,et al.Genes controlling watermelon seed size[J].Cucurbitaceae,1994,94:144-147.
Construction of genetic linkage map and QTL location for fruit-related
traits in melon/LUAN Feishi1,2,LU Bingyang1,2,ZHOU Huiwen1,2,WANG Xuezheng1,2(1.Ministry of Agriculture KeyLaboratory of Biology and Germplasm Enhancement of Horticultural Crops in Northeast China,Harbin 150030,China;2.School of Horticulture,Northeast Agricultural University, Harbin 150030,China)
The present study was to develop SNPs based on the resequencing data and bioinformatics methods of M4-5 and M1-15 and convert them into cleaved amplified polymorphic sequence (CAPS)markers.In this study,we developed 523 CAPS markers totally and 223 markers showed polymorphism between parents,the polymorphism rate was 43.8%.We markered F2generation using CAPS markers and constructed a genetic map.The map contained 195 markers and grouped on 12 linkage groups,spanning a total length of 1 702.55 cM,with an average of 8.78 cM between markers.A total of 28 locus for friut-related traits which contained 14 locus for fruit,nine locus for yield and five locus brix content with contribution rate ranged from 3.4974%to 17.9684%.
melon;fruit trait;genetic linkage;QTL
S652
A
1005-9369(2016)08-0009-12
2016-04-11
国家西甜瓜产业技术体系(CARS-026-02)
栾非时(1964-),女,教授,博士,研究方向为西瓜甜瓜遗传育种。E-mail:luanfeishi@sina.com
