番茄叶霉病抗性基因Cf-5、Cf-9和Cf-12介导的抗性生理研究
2016-09-24薛东齐许向阳姜景彬柴鑫凤李景富
薛东齐,许向阳,姜景彬,柴鑫凤,张 红,李景富
(1.东北农业大学园艺学院番茄研究所,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030)
番茄叶霉病抗性基因Cf-5、Cf-9和Cf-12介导的抗性生理研究
薛东齐1,许向阳1,姜景彬1,柴鑫凤2,张红1,李景富1
(1.东北农业大学园艺学院番茄研究所,哈尔滨150030;2.东北农业大学生命科学学院,哈尔滨150030)
为明确番茄叶霉病抗性基因Cf-5、Cf-9和Cf-12介导的过敏反应中抗性生理间差异,为Cf-0(CK)、Cf-5、Cf-9、Cf-12番茄材料接种叶霉菌生理小种1.2.3,并比较各抗性材料在活性氧暴发、H2O2积累、水杨酸含量及超氧化物歧化酶、过氧化物酶、过氧化氢酶、苯丙氨酸解氨酶、多分氧化酶活性变化等相关生理生化指标异。结果表明,Cf-9、Cf-12积累活性氧和HR坏死斑点数稍高于Cf-5说明Cf-9、Cf-12发生早期防御信号较Cf-5强;细胞保护酶类测定结果表明,含Cf-5、Cf-9、Cf-12基因抗性材料各保护酶变化趋势大致相同,但部分指标间存在显著差异,均与对照(Cf-0)各指标在变化趋势及变化量上差异显著;水杨酸测定结果证实其对产物结构相似Cf基因介导的过敏性坏死反应作用存在差异。综合各抗性材料、抗性生理指标与抗病性鉴定结果,表明含Cf-9基因材料对叶霉菌抗性较Cf-5、Cf-12基因材料强,抗性基因对叶霉病抗性主要通过调控体内细胞保护酶类活性及水杨酸含量提高叶霉菌抗性。
叶霉病抗性基因;过敏反应;活性氧暴发;抗性生理指标;细胞保护酶类
网络出版时间2016-8-24 15:03:00[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160824.1503.002.html
薛东齐,许向阳,姜景彬,等.番茄叶霉病抗性基因Cf-5、Cf-9和Cf-12介导的抗性生理研究[J].东北农业大学学报,2016,47(8):1-8.
Xue Dongqi,Xu Xiangyang,Jiang Jingbin,et al.Study on tomatoCf-5,Cf-9 andCf-12 gene mediated resitance physiological mechanism toCladosporium fulvum(syn.Passalora fulva)[J].Journal of Northeast Agricultural University,2016,47(8):1-8.(in Chinese with English abstract)
番茄(Solanum lycopersicum)受较多病原物侵扰,如番茄黄化曲叶病[1]、番茄黄萎病[2]、番茄枯萎病[3]、番茄灰霉病[4]等,这些病原物暴发均可造成番茄大面积减产,甚至绝产。在我国中部和北方保护地番茄栽培中,番茄叶霉菌(Cladosporium fulvum)引起的叶霉病成为威胁番茄生产主要真菌性病害,给番茄生产带来影响[5]。目前,随生产中不同番茄叶霉病抗病品种推广,以抗病基因Cf-2、Cf-4为主的材料已被叶霉菌生理小种1.2.3.4克服,含抗病基因Cf-5、Cf-9材料也在部分地区被叶霉菌生理小种2.5、2.4.9克服[6-7]。可以看出,抗叶霉病番茄品种推广在加剧叶霉菌生理小种分化同时,也使其流行趋势多态化[8]。因此,挖掘新的叶霉病抗性基因,明确其抗性机理间异同成为现阶段研究重点。
番茄抗叶霉病品种与叶霉菌发生非亲和互作时,在侵染区域发生过敏性坏死反应[9](Hypersensi⁃tive response,HR),主要表现为活性氧(Reactive ox⁃ygen species,ROS)分子暴发[10],O2-、H2O2及·OH大量积累,致使体内活性氧产生与清除机制间动态平衡被打破[11],引起细胞膜质过氧化[12],及细胞内相关保护酶类变化,启动植物抗病防卫反应[13]。植物体内相关保护酶类主要有超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)、多分氧化酶(PPO)等,维持植物细胞膜系统稳定性。除保护酶外,植物体内SA等也是植物抗病信号转导途径中重要正向调控因子[14],这些保护酶及激素变化与植物抗病性密切相关[15]。然而,研究表明,Avr4/Cf-4介导的HR 与Avr9/Cf-9介导的HR在产生速度、强度和组织特异性等方面存在显著差异[16]。为明确不同叶霉病抗性基因材料间介导的HR是否存在差异,本试验利用含有不同叶霉病抗性基因番茄材料,研究在HR反应过程中植物体内活性氧、细胞保护酶,及激素变化情况,以期明确叶霉病抗性基因Cf-5、Cf-9、Cf-12抗性生理异同,为进一步研究番茄与叶霉菌之间抗病机制奠定理论基础和科学依据。
1.1材料
试验于2015年在东北农业大学园艺学院FYSHY-7型人工气候室和实验室完成。供试番茄品种如表1所示,供试叶霉菌生理小种为1.2.3,均由东北农业大学园艺学院番茄课题组提供。
1.2方法
1.2.1供试番茄材料与处理
将叶霉菌抗性材料Cf-5、Cf-9、Cf-12及对照Cf-0种子经15%NaClO溶液消毒10 min,无菌水冲洗3遍,于28℃恒温箱催芽2 d,播种于5 cm×5 cm营养钵中,并置于FYS-HY-7型人工气候室,昼/夜温度28℃/18℃,空气湿度80%,每天光照时间16 h,80%光照强度,常规苗期管理。供试材料设3次重复,每重复10株,待番茄幼苗长至4~5片真叶时,采用喷雾法于叶背面接种叶霉菌生理小种1.2.3,接种前保持99%湿度24 h,接种后保持95%湿度,昼/夜温度25℃/22℃,每天光照时间14 h,60%光照强度。于接种前(0 d)和接种后第1、3、5、8、12、15天分别取每株1~2片小叶,无菌水冲洗干净,液氮速冻后于-80℃冰箱保存。
1.2.2番茄叶片台盼蓝及DAB染色
为从形态学角度明确叶霉菌生理小种1.2.3与分别含Cf-5、Cf-9、Cf-12基因抗病番茄材料间非亲和互作过程,以Cf-0为对照,分别取接种后第3、8、15天3个采样时间点对接种叶片作台盼蓝染色,并取接种后第1、2、3、4天接种叶片作DAB染色。台盼蓝染色参照Faoro等方法[17],DAB染色参照Watanabe等方法[18],采用美国AMG EVOS倒置显微镜以及OLYMPUS SZX10体式显微镜观察拍照。
1.2.3活性氧、细胞保护酶和激素含量测定
植物体内活性氧H2O2含量测定采用文献[19]等方法;细胞保护酶类SOD、POD、CAT活性测定参照赵世杰等方法[20],PPO、PAL活性测定参照高俊凤方法[21];激素SA采用张玉琼等HPLC方法测定[22]。
1.3番茄叶霉病鉴定分级
对抗性材料Cf-5、Cf-9、Cf-12及对照Cf-0接种叶霉菌生理小种1.2.3后15 d作鉴定分级,番茄叶霉病鉴定分级标准参照孟凡娟等方法[23]。
1.4数据处理
试验数据采用SPSS 17.0的Duncan(D)法进行差异显著性检验(P<0.05),利用Excel 2007作数据计算和图形绘制。
2 结果与分析
2.1台盼蓝染色和抗病性鉴定
由于含Cf-5、Cf-9、Cf-12基因的抗病番茄材料与叶霉菌生理小种1.2.3发生非亲和互作,产生HR,通过各抗性材料作叶霉病鉴定分级,结果如表2所示,Cf-9材料对叶霉菌生理小种1.2.3表现为免疫,而Cf-5和Cf-12表现为高抗。台盼蓝染色结果如图1所示。
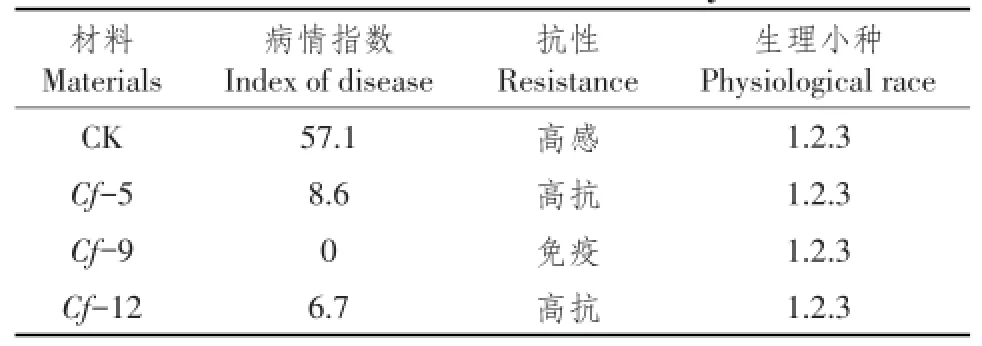
表2 供试番茄材料抗病性鉴定Table 2 Resistance reaction of tomato materials used for this study

图1 叶霉菌侵染后叶片坏死情况观察Fig.1 Necrosis symptom of leaves after infecting C.fulvum
在接种后第3、8天,对照Cf-0(CK)叶片上观察发现坏死斑区域均较抗病材料叶片少,说明叶霉菌在Cf-0材料上形成较好初侵染,而在抗病材料上初侵染受阻;第15天时,对照CK产生大量菌丝被染色,而抗病材料未见明显菌丝着生,但叶片坏死斑点个数和面积均较之前有明显增多和扩大,且坏死斑点在叶片远轴端分布较多。结合抗病性鉴定及台盼蓝染色结果可知,Cf-9介导的HR强度较Cf-5、Cf-12强,而Cf-5、Cf-12介导的HR强度相当。
2.2DAB染色观察和H2O2测定
当抗性材料接种叶霉菌后,叶霉菌分泌效应因子Avr蛋白和Ecp蛋白激活植物早期抗病防御反应,主要表现为H2O2等相关活性氧大量积累。采用Patterson法和DAB染色法实时监测H2O2暴发情况,结果如图2所示。
随接种后时间延长,H2O2在各抗性材料上信号强度均不断增强,并在第2天达到高峰,其中Cf-9、Cf-12峰值稍高于Cf-5,说明Cf-9、Cf-12发生的早期防御信号较强,而第3天三抗性材料信号明显减弱;对于感病材料Cf-0而言,H2O2信号强度在第3天达到高峰,且强度均低于抗病材料,与刘慧芹等结论一致[24]。通过结合DAB染色叶片上H2O2信号弥散程度(见图2),证实Cf-5、Cf-9、Cf-12在早期H2O2抗病信号积累上存在差异。

图2 叶霉菌侵染后不同抗性材料叶片H2O2积累情况Fig.2 H2O2accumulation of different resistance material after infecting C.fulvum
2.3细胞保护酶SOD活性变化
SOD作为植物细胞内清除活性氧自由基关键酶,在维持细胞活性氧代谢平衡系统,阻止膜脂过氧化过程中发挥重要作用[12-13]。
由图3可知,在对Cf-5、Cf-9、Cf-12及Cf-0接种叶霉菌后,抗性材料SOD活性先急剧增加,在第1天后快速下降,3 d后又快速上升,第5天后呈现出相对一致的缓慢增加变化趋势;而感病材料Cf-0的SOD活性先缓慢上升,在第3天时达到高峰,后又下降,并基本维持在360 U·g-1FW水平。
总体来看,抗性材料SOD活性初始值及接种后,SOD上升幅度均远大于感病材料,且Cf-9的SOD水平稍大于Cf-12、Cf-5,说明Cf-9抗性材料对叶霉菌的前期防卫反应较Cf-12、Cf-5激烈。

图3 接种叶霉菌后番茄叶片SOD活性变化Fig.3 SOD activity of tomato leaves after infecting C.fulvum
2.4细胞保护酶POD和CAT活性变化
对不同处理材料接种叶霉菌后,POD和CAT活性变化如图4所示。
接种前,Cf-9材料POD活性稍大于Cf-0、Cf-5、Cf-12,保持在15 U·min-1·g-1FW左右;对抗性材料而言,接种后POD活性快速上升,在第3~8天时达到平台期,之后快速上升,整个变化过程中,Cf-5、Cf-9、Cf-12材料POD活性接近,且均显著大于Cf-0材料,说明POD在番茄对叶霉菌侵染后发生的应激反应中发挥积极作用;然而CAT活性则呈现为第1天有所下降,后快速上升,并在第8天达到最大峰值后又缓慢下降变化趋势,这可能是POD与CAT相互协同作用结果。然而,对于感病材料Cf-0而言,接种后POD活性缓慢上升,并在第5~8天时达到平台期,之后又缓慢上升,但上升幅度相对较小;而CAT活性则在第3天时达到最大值后缓慢下降,并在第15天时又上升到接近第3天时水平。
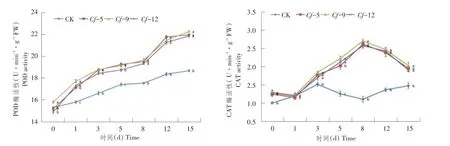
图4 接种叶霉菌后番茄叶片POD和CAT活性变化Fig.4 POD and CAT activities of tomato leaves after infecting C.fulvum
2.5细胞保护酶PPO和PAL活性变化
对抗病以及感病材料接种叶霉菌后,PPO以及PAL活性变化如图5所示。
接种前,4份材料间PPO和PAL活性差异小,PPO活性含量维持在240 U·min-1·g-1FW左右;接种后,抗性材料Cf-5、Cf-9、Cf-12的PPO活性均快速增加,并在第3天出现一个折点,之后又快速增加,在第15天时PPO活性达到最大,差异显著性分析可知PPO活性高低表现为Cf-9>Cf-12>Cf-5,且在接种后1~15 d,抗性材料PPO活性均显著高于感病材料,原因可能是抗性材料在受到叶霉菌侵染后催化更多的酚类化合物;接种后对抗性材料PAL测定表明,其变化趋势基本相似,主要表现为PAL活性在接种后迅速升高,并于第1天达到各自第一个峰值,之后PAL活性快速下降,并于第5天后PAL活性才再次上升,第15天时各材料PAL活性高于第1天时PAL峰值。而对于感病材料Cf-0而言,其PPO和PAL活性在各测定时间点均较抗性材料差异显著。
图5 接种叶霉菌后番茄叶片PPO和PAL活性变化Fig.5 PPO and PAL activities of tomato leaves after infecting C.fulvum
2.6番茄植株SA含量积累动态
为明确SA在番茄对叶霉菌抗性过程中变化趋势,测定各材料接种后叶片SA含量,结果如图6所示。各抗性材料在接种后SA含量均快速升高,并于第3天达到最大值,但Cf-9、Cf-12材料SA积累量高于Cf-5,且接种后5 d内保持较高水平,之后逐渐下降,第12天时Cf-9、Cf-12材料SA稍有增加,并维持在2.93 mg·g-1左右,Cf-5材料SA则维持在1.64 mg·g-1左右;感病材料Cf-0叶片内SA水平变化趋势相对稳定,差异显著性分析可知,抗性材料叶片内SA含量在接种后始终显著高于感病材料Cf-0。

图6 接种叶霉菌后番茄叶片SA含量变化Fig.6 SA content of tomato leaves after infecting C.fulvum
番茄抗叶霉病基因与叶霉菌发生的非亲和互作符合基因对基因假说[25],随不同叶霉病抗性基因在生产上的推广,以抗病基因Cf-4、Cf-5为主的材料已分别被叶霉菌生理小种1.2.3.4和2.5克服[6],含Cf-9基因抗性番茄材料虽已应用于生产,但由于叶霉菌生理小种不断分化,易出现广谱或复合毒性小种,使含Cf-9基因的抗性材料失去抗病性。本研究明确番茄叶霉病抗性基因Cf-5、Cf-9、Cf-12在叶霉菌抗病性表现及抗性生理间差异。
研究表明植物对病原菌抗性依赖于对病原菌早期识别,从而激发ROS和启动防卫反应,由DAB染色可知,叶霉菌生理小种1.2.3在Cf-5、Cf-9、Cf-12抗性材料上初侵染受阻,接种后叶片内H2O2快速、大量积累也证实这一结果,其中Cf-9、Cf-12积累的活性氧稍高于Cf-5,说明Cf-9、Cf-12发生早期防御信号较强,各材料抗病性鉴定结果与Lamb等研究结果一致[26];侵染后期,抗性材料积累大量活性氧信号分子启动植物防卫反应,引起HR,表现为叶片上出现坏死斑,与小麦锈病HR表现一致[27],说明不同Cf基因对叶霉菌介导的HR存在差异。
通过进一步测定细胞保护酶类SOD、POD、CAT、PAL、PPO,结果表明含Cf-5、Cf-9、Cf-12基因抗性材料各保护酶化趋势大致相同,但部分指标间存在显著差异,且均与对照(Cf-0)各指标在变化趋势及变化量上差异显著。SOD、POD、CAT作为植物细胞内清除活性氧自由基的重要酶,其活性高低直接反映植物对体内活性氧自由基清除能力强弱[28-29]。Cf-9材料SOD活性稍高于Cf-12、Cf-5,这可能因抗性材料在O2-清除能力及抵御脂膜过氧化能力方面具有差异;活性氧分子经SOD歧化为H2O2,POD和CAT催化H2O2分解为H2O,与此同时POD还可催化脂肪酸、芳香胺及酚类物质的氧,有研究表明POD可促进植保素及木质素生成[28],抑制病菌扩展;而CAT则主要在过氧化物酶体及乙醛酸循环中发挥作用;对POD和CAT测定结果表明,Cf-9材料在多个测定时间点与Cf-12、Cf-5材料间具有显著差异,这可能与抗病基因在接种后被诱导表达量有关;病原菌侵染后,植物体内会积累大量酚类及类黄酮类化合物,PPO和 PAL通过将这些物质催化为醌、黄酮和木质素等次生代谢物质抵御病原菌侵染[27,30],测定结果表明抗性品种PPO和PAL活性间大多数测定点差异不显著,但均显著高于感病品种,说明PPO和PAL活性升高与植物抗病性密切相关,与崔延玲[31]和齐绍武等[32]对番茄叶霉病和油菜菌核病抗性相关酶研究结果一致。通过对三抗性材料五种细胞保护酶综合分析,结合抗病性鉴定结果,表明Cf-9材料对叶霉菌生理小种1.2.3抗性较Cf-5、Cf-12材料激烈,Cf-5与Cf-12材料抗性激烈程度相当。
Delaney和Hammond等研究SA在番茄与叶霉菌非亲和互作(Cf-9/Avr9,Cf-2/Avr2)过敏坏死中的调控作用,表明SA在植物与病原物互作下游防卫反应中起重要作用,同时也在抗性基因介导的过敏性坏死反应中发挥作用,且SA积累量受温度、光照等多种环境因素影响[33-34]。对抗性材料SA测定发现Cf-9、Cf-12材料SA积累量高于Cf-5,差异显著,说明SA对产物结构相同的Cf基因介导过敏性坏死反应作用存在差异,这与蔡新忠等对依赖番茄Cf-4和Cf-9基因的过敏坏死中的调控作用研究结果一致[35]。综上所述,各抗性材料在叶霉菌抗病性表现以及抗性生理间差异,含Cf-9基因材料对叶霉菌抗性较Cf-5、Cf-12基因材料强,各抗性材料对叶霉病抗性主要通过调控体内细胞保护酶类活性及SA含量增强其对叶霉菌抗性。
[1]Boulton M I.Geminiviruses:Major threats to world agriculture[J]. Annals of Applied Biology,2003,142(2):143.
[2]尤海波,李景富,许向阳,等.番茄黄萎病病原菌研究[J].植物保护,2004(6):68-70.
[3] 崔萍,安慧,张楠,等.番茄枯萎病病原菌鉴定与拮抗菌筛选[J].西南农业学报,2013(3):1038-1043.
[4]奉代力,王强,郑纪慈,等.几种杀菌剂对番茄灰霉病菌的抑菌效果对比研究[J].浙江农业学报,2013(1):119-123.
[5]韩晓莹,康立功,许向阳,等.2009年东北三省番茄叶霉病菌主流生理小种变化监测[J].东北农业大学学报,2010,41(12):26-29.
[6]Li S,Zhao T T,Li H J.First report of races 2.5 and 2.4.5 of Cladosporium fulvum(syn.Passalora fulva),causal fungus of to⁃mato leaf mold disease in China[J].Journal of General Plant Pa⁃thology,2015,81(2):162-165.
[7]柴敏,于拴仓,丁云花,等.北京地区番茄叶霉病菌致病性分化新动态[J].华北农学报,2005,20(2):97-100.
[8]李春霞,许向阳,康立功,等.2006~2007年东北三省番茄叶霉病菌生理小种变异的监测[J].中国蔬菜,2009(2):42-45.
[9]韩建东,曹远银,姚平.小麦条锈菌互作中的激发子对小麦过敏性坏死反应和防御酶活性的诱导[J].华北农学报,2009,24 (1):79-82.
[10]Foyer C H,lopez D H,Ferrer M A.Hydrogen peroxide and gluta⁃thione associated mechanisms of acclamatory stress tolerance and signaling[J].Plant Physiology,1997,100:241-254.
[11]John J G,Gary J L.Role of reactive oxygen intermediates and cog⁃nate redox signaling in disease resistance[J].Plant Physiology, 2000,124(1):21-29.
[12]李美如,刘鸿生,王以柔.细胞氧化应激机制与植物抗冷性机理的研究[J].生命科学,1996(4):30-34.
[13]王小媚,任惠,刘业强.低温胁迫对杨桃品种抗寒性生理生化指标的影响[J].西南农业学报,2016,29(2):270-275.
[14]Mühlenbock P,Plaszczyca M,Plaszczyca M,et al.Lysigenous aer⁃enchyma formation in Arabidopsis is controlled by LESION SIMU⁃LATING DISEASE1[J].Plant Cell,2007,19(19):3819-3830.
[15]Ingeborg T,Christiane L,Alok K S.Cyclopentenone isoprostanes induced by reactive oxygen species trigger defense gene activa⁃tion and phytoalexin accumulation in Plants[J].The Plant Journal, 2003,34(3):363-368.
[16]Cai X Z,Takken F,Joosen M,et al.Specific recognition of AVR4 and AVR9 results in distinct patterns of hypersensitive cell death in tomato,but similar patterns of defence-related gene expression [J].Molecular Plant Pathology,2001,2(2):77-86.
[17]Faoro F,Maffi D,Cantu D,et al.Chemical-induced resistance against powdery mildew in barley:The effects of chitosan and ben⁃zothiadiazole[J].Bio Control,2008,53:387-401.
[18]Watanabe N,Lam E.Arabidopsis Bax inhibitor-1 functions as an attenuator of biotic and abiotic types of cell death[J].Plant Jour⁃nal,2006,45(6):884-894.
[19]Uchida A,Jagendorf T,Hibino T,et al.Effects of hydrogen perox⁃ide and nitric oxide on both salt and heat stress tolerance in rice [J].Plant Science,2002,163:515-523.
[20]赵世杰,刘华山,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,1998.
[21]高俊凤.植物生理学实验技术[M].西安:世界图书出版社, 2000.
[22]张玉琼,仲延龙,高翠云,等.高效液相色谱法分离和测定小麦中的5种内源激素[J].色谱,2013,31(8):800-803.
[23]孟凡娟,许向阳,李景富,等.东北三省新的番茄叶霉病生理小种分化初报[J].中国蔬菜,2006(1):21-23.
[24]刘慧芹,刘慧平,韩巨才.叶霉菌粗毒素对番茄幼苗防御酶及活性氧的诱导[J].华北农学报,2009,24(6):215-218.
[25]De Wit P J.Molecular characterization of gene-for-gene systems in plant-fungus interactions and the application of avirulence genes in control of plant pathogens[J].Annu Rev Phytopathol, 1992,30(4):391-418.
[26]Lamb C,Dixon R.The oxidative burst in plant disease resistance [J].Annu Rev Plant Physical Plant Mol Biol,1997,48:251-275.
[27]龙书生,曹远林,李亚玲,等.小麦抗条锈病过敏性坏死反应中的活性氧代谢[J].西北农林科技大学学报:自然科学版:, 2009,31(11):125-130.
[28]王全华,王秀峰,林忠平.外源GO基因导入番茄后对叶霉病的抗性机制[J].中国农业科学,2006,39(7):1365-1370.
[29] 吕晓梅,许向阳,李景富.番茄叶霉病及其抗病育种的研究进展[J].东北农业大学报,2002,33(4):396-406.
[30]Gusui W,Barry J,Ellen B.Disease resistance conffered by expres⁃sion of a gene encoding H2O2generating glucose oxidase in trans⁃genic potato plants[J].Plant Cell,1995(7):1357-1368.
[31]崔彦玲,张环.番茄叶霉病抗性与苯丙氨酸解氨酶的相关性[J].华北农学报,2003,18(1):79-82.
[32] 齐绍武,官春云,刘春林.甘蓝型油菜品系一些酶的活性与抗菌核病的关系[J].作物学报,2004,30:270-273.
[33]Delaney T,Uknes S,Vernooij B,et al.A central role of salicylic acid in plant disease resistance[J].Science,1994,226:1247-1250.
[34]Hammond K,Silverman P,Raskin I,et al.Race-specific elicitors of Cladosporium fulvum induce changes in cell morphology and the synthesis of ethylene and salicylic acid in tomato plants carry⁃ing the corresponding Cf disease resistance gene[J].Plant Physiol, 1996,110:1381-1394.
[35] 蔡新忠,徐幼平.水杨酸和乙烯对依赖于Cf基因的过敏坏死的调控作用[J].植物生理与分子生物学学报,2003,29(1):11-14.
Study on tomatoCf-5,Cf-9 andCf-12 gene mediated resitance physiological mechanism toCladosporium fulvum(syn.Passalora fulva)/
XUE Dongqi1,XU Xiangyang1,JIANG Jingbin1,CHAI Xinfeng2,ZHANG Hong1,LI Jingfu1(1.Tomato Research Institute,School of Horticulture,Northeast Agricultural University,Harbin 150030,China; 2.School of Life Sciences,Northeast Agricultural University,Harbin 150030,China)
In order to clarify tomato leaf mold resistance genesCf-5,Cf-9 andCf-12 mediated hypersensitive response resistance reaction physiological differences.The experiment inoculated tomato leaf mold physiological races 1.2.3.onCf-0(CK),Cf-5,Cf-9 andCf-12 tomato materials,and compared the resistance material physiological and biochemical parameters differences of reactive oxygen species,hydrogen peroxide accumulation,salicylic acid content,superoxide dismutase, peroxidase,catalase,phenylalanine ammonia lyase,and polyphenol oxidase activities.The resultsshowed that the reactive oxygen species accumulation and the number of HR necrotic spots ofCf-9 and Cf-12 were slightly higher thanCf-5.Therefore,early defensive signals occurrence ofCf-9,Cf-12 relatively strong thanCf-5.The cytoprotective enzymes measurement results showed that changes of the protective enzyme ofCf-5,Cf-9 andCf-12 material had approximately same trends,But there were significant differences between some indicators.Each resistant material compared with the CK had significant differences in each parameter's trends and the amount of changes.The measurement results of SA confirmed that it had a different effect on the same structural genesCf-mediated HR.In summary, we knew from the resistance physiological index and resistance identification results that containingCf-9 material's resistant to tomato leaf mold disease was relatively strong thanCf-5 andCf-12 material. Resistance gene for tomato leaf mold disease mainly through the regulation of the cytoprotective enzymes activity and the content of salicylic acid to improve its resistance to PassaloraC.fulvum.
tomato leaf mold resistance genes;hypersensitive response;reactive oxygen species; resistance physiological index;cytoprotective enzymes
S641.2
A
1005-93692016)08-0001-08
2016-04-13
“十二五”国家科技计划项目(2012BAD02B02-7);国家自然科学基金项目(31272171,31572137)
薛东齐(1987-),男,博士研究生,研究方向为番茄抗病遗传育种与生物技术。E-mail:xuedongqi2009@hotmail.com
李景富,教授,博士生导师,研究方向为蔬菜遗传育种与生物技术。E-mail:lijf_2005@126.com
