绿茶茶汤对肥胖相关肠道菌群的影响
2016-09-21郭虹雯许翔雨陈莹婕倪莉刘志彬
郭虹雯,许翔雨,陈莹婕,倪莉,刘志彬
福州大学食品科学技术研究所,福建省食品生物技术创新技术研究中心,福建 福州 350108
绿茶茶汤对肥胖相关肠道菌群的影响
郭虹雯,许翔雨,陈莹婕,倪莉,刘志彬*
福州大学食品科学技术研究所,福建省食品生物技术创新技术研究中心,福建 福州 350108
近年来,饮茶调节肠道微生态的效果受到广泛关注。本研究通过将绿茶茶汤与志愿者新鲜粪样混合培养,使用荧光原位杂交技术考察不同发酵时间点(0、6、12、24 h)绿茶茶汤对与肥胖密切相关的肠道菌群(包括总菌、拟杆菌门微生物和厚壁菌门微生物)的影响,从而评估绿茶茶汤调节肠道微生态作用的效果。实验结果表明,绿茶茶汤在体外粪样混合培养体系中发酵 24 h时,对于肠道中总菌、拟杆菌门微生物以及厚壁菌门微生物的数量减少有抑制效果(P<0.05),并可以改善肠道中拟杆菌门与厚壁菌门的相对丰度,降低厚壁菌门与拟杆菌门比例(F/B),这为饮茶对改善肠道健康、减肥降脂作用提供了一定的理论参考。
绿茶茶汤;肠道菌群;肥胖;拟杆菌门微生物;厚壁菌门微生物
据《经济学人》的数据显示,中国超过四分之一的成年人处于超重或肥胖的状态[1],最新数据表明中国已超过美国成为全球第一肥胖国[2],肥胖正成为我国最为严重而紧迫的公共卫生问题。目前,众多学者认为肥胖与肠道菌之间存在着一定的联系。2004年,美国华盛顿大学Gordon实验室首次报道了肠道菌群与肥胖相关[3],之后他们在小鼠和人体肠道菌群中发现与肥胖相关的菌群特征,研究指出在肥胖小鼠和人群肠道的厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)微生物的比例(F/B)相对于清瘦个体而言更高[4]。还有研究报道肠道中厚壁菌门微生物每增加20%,拟杆菌门微生物每减少20%,宿主的能量摄入就增加约 150 kcal[5],大量研究认为 F/B是衡量肥胖的一个指标[6-7]。
茶叶含有丰富的多酚类化合物且本身不含热量,其抗肥胖及体重控制效果得到广泛的认可,早在《本草拾遗》中就有“茶,去人脂,久食令人瘦”的记载[8]。目前也有大量文献报道了茶叶,尤其是绿茶,具有减肥、降脂等功效[9-13]。但茶叶的抗肥胖机理多从脂肪组织、肝脏等作为靶标进行研究,还鲜有以肠道菌群为靶标所开展的研究。本研究以采集的人体新鲜粪便中的肠道菌群为研究对象,通过荧光原位杂交技术(FISH),考察绿茶茶汤对肥胖相关的肠道菌群的影响,从调控肠道菌群的角度初步探索绿茶茶汤的抗肥胖机理。
1 材料与方法
1.1材料与试剂
市售绿茶(特级碧螺春),由福建公泰茶叶有限公司提供。Merck Millipore Ltd GTTP02500 0.2 μm聚碳酸酯滤膜,上海碧云天荧光淬灭封片液,MITSUBISHI GAS CHEMICAL CO.,INC.厌氧袋、厌氧产气袋,磷酸盐缓冲液(0.01 mol·L-1,pH 7.2~7.4),4%多聚甲醛固定液,5×杂交液;FISH使用的专用 16 S rRNA寡合苷酸单链探针由生工生物工程(上海)有限公司合成,在探针的5′端上标记Alexa Fluor 488染料,使用时用去离子水稀释至 50 ng·μL-1,染料在蓝色激发波长下发出绿光,可以清晰的分辨出菌体细胞形态,探针详细信息见表1。
1.2仪器与设备
上海精宏TSQ-280型生化培养箱,上海智诚ZWY-2102C型双层恒温培养振荡器,日本尼康公司TE2000S尼康倒置荧光显微镜。
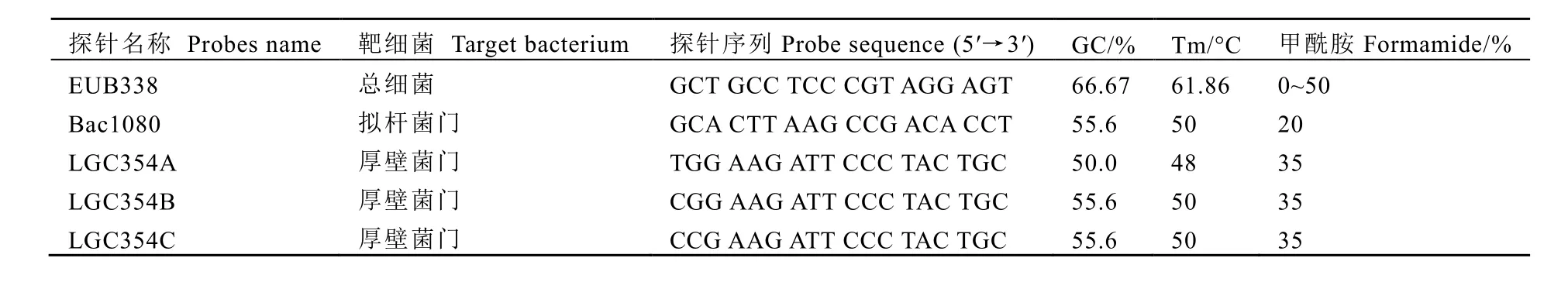
表1 荧光探针合成报告Table 1 Information of fluorescent probes
1.3方法
1.3.1绿茶茶汤制备
根据福建省当地居民的饮茶习惯和方式制备绿茶茶汤。称取5.0 g绿茶样品置于烧杯中,加入 100 mL煮沸蒸馏水(90~95℃),浸泡1 min,用滤纸过滤,保留滤液,冷却至室温待用。
1.3.2粪便样品采集培养
征集1名健康志愿者(男,21周岁,采样前3个月未使用抗生素,也没有肠道传染性疾病或进行过胃肠道手术)提供粪便样品。在获得其同意并签署知情同意书后,收集其新鲜全便,迅速挖取中段粪便样品约5 g,置于150 mL无菌三角烧瓶中,加入100 mL绿茶茶汤(对照组加入相应的无菌水),漩涡振荡混匀后分装于10 mL离心管中,置于厌氧袋中37℃培养。
1.3.3样品处理
培养0、6、12、24 h后取出相应的样品,震荡漩涡均匀后置于研钵中充分研磨1 min,取1 mL于离心管中,2 700 r·min-1离心2 min后取上清液于10 mL离心管中,沉淀用1 mL生理盐水重悬离心2次,将最终上清液统一定容到 3 mL;从中取 1mL菌液 10 000 r·min-1离心3 min去上清液得菌体沉淀;加入磷酸盐缓冲液和固定液(1︰3),于4℃冰箱中固定1 h后加入等体积的无水乙醇置于-20℃下保存。每组3个平行样。
1.3.4FISH定量分析
取1.3.3中的样品20 μL加入杂交液300 μL,混匀后 10 000 r·min-1离心 3 min,去上清液后加入45 μL 5×杂交液悬浮,于暗室中加入5 μL对应的探针(探针信息见表1),轻轻重悬,在避光条件下水浴加热 1.5 h(总菌、厚壁菌门杂交温度:50℃,拟杆菌门杂交温度46℃);杂交结束后,补充0.01 mol·L-1PBS缓冲液至200 μL,取40~200 μL通过真空抽滤装置过滤到 0.2 μm孔径聚碳酸酯滤膜上,滴加抗荧光猝灭剂后封片;荧光显微镜镜检时使用蓝色激发光进行镜检并拍摄荧光图片;随机选取荧光显微镜内观察的视野10个,取其细菌平均数,按照下列公式计算,并取其以 10为底的对数:
菌体细胞数目=视野平均细菌数×(过滤面积/视野面积)×稀释倍数
其中:选用过滤半径为8.4 mm的聚碳酸酯滤膜,其过滤面积S(S/μm2=π×84002≈2.22 ×108);观察的视野面积为 118×89.2=1.05 ×104μm2。
1.3.5拟杆菌门和厚壁菌门相对丰度
由FISH计数结果计算拟杆菌门和厚壁菌门数量,再由拟杆菌门和厚壁菌门与总菌的比值计算得丰度。
1.3.6数据分析
使用 SPSS 22.0统计分析软件中的Duncan's ANOVE(P<0.05)对试验数据进行显著性分析。
2 结果与分析
2.1绿茶茶汤对肠道总菌的影响
使用细菌通用探针EUB338杂交,并使用荧光显微镜观察绿茶茶汤对肠道总菌的影响,并以蒸馏水作为对照,镜检结果见图1。
从图中可以看出,EUB338探针对人肠道总菌杂交效果良好,细胞形态明显,可以准确计数。经 24 h培养发酵后,可粗略判断粪便总菌数明显下降(图1-B,图1-C),但添加绿茶茶汤的样品总菌数明显更多(图1-C)。经镜检计数获得对照组和绿茶茶汤组在不同发酵时间总菌的变化情况(图2)。由图可知,随着发酵时间的推移对照组总菌数量呈现下降的趋势,对照组在6 h时与起始数量相比变化不大,但在12 h和24 h时对照组明显少于起始数量(P<0.05)。而绿茶茶汤组的粪便总菌数也呈总体呈下降趋势,但在加入绿茶茶汤24 h后,粪便总菌数显著高于同时间的对照组。

注:A、B、C分别是对照组0 h、24 h以及实验组24 h发酵样液EUB338检测结果。Note:A,B,C were the detection results of probe Eub338 in control group 0 h,24 h and treatment group 24 h respectively.图1 采用EUB338探针对体外厌氧发酵样液FISH处理后荧光显微镜下观察结果Fig.1 FISH results of anaerobic fermentation broth with water or infusion of green tea observed by epifluorescence microscope
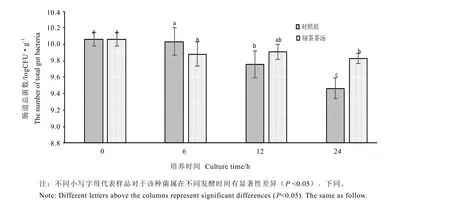
图2 体外培养后肠道总菌的数量Fig.2 The change of total gut bacteria in anaerobic fermentation broth
2.2绿茶茶汤对肠道拟杆菌门微生物的影响
拟杆菌门是人体肠道内的优势菌群,属于革兰氏阴性严格厌氧菌,可分拟杆菌(Bacteroides)、普雷沃氏菌(Prevotella)和卟啉单胞菌(Porphyromonas)三大类[14]。拟杆菌具有发酵碳水化合物、参与胆汁酸和类固醇代谢、多糖代谢、维持肠道正常等诸多生理功能,对人体健康影响重大[15]。使用拟杆菌门特异性探针 Bac1080杂交,并使用荧光显微镜观察绿茶茶汤对后肠道拟杆菌门微生物的影响,并以蒸馏水作为对照,镜检结果见图3。
从图3镜检结果可以看出,Bac1080探针对人肠道拟杆菌门细菌杂交效果良好,细胞形态明显,可以准确计数。经24 h培养发酵后,可粗略判断粪便拟杆菌门微生物的数量明细下降(图3-B,图3-C),但添加绿茶茶汤的样品总菌数明显更多(图3-C)。经镜检计数获得对照组和绿茶茶汤组在不同发酵时间拟杆菌门的变化情况(图4)。由图可知,随着发酵时间的推移对照组拟杆菌门微生物数量呈下降趋势,对照组在6 h时与起始数量相比变化不大,但在12 h和24 h时明显少于起始数量(P<0.05),这与总菌对照组变化趋势相一致。而绿茶茶汤组的粪便拟杆菌微生物数量也是总体呈下降趋势,但下降程度不大,在加入绿茶茶汤24 h后只下降0.15个拷贝数,粪便拟杆菌微生物数量显著高于同时间的对照组。图5是经培养后拟杆菌门微生物数量的相对丰度,从图中可以看出相比于对照组,绿茶茶汤组拟杆菌门微生物数量的相对丰度均更高,这充分说明在体外发酵培养后,肠道中的拟杆菌门利用了茶汤中的物质,促进其自身生长。另外可以发现在6 h时两组的相对丰度差距最大,这有可能是因为拟杆菌门在发酵过程中的前6 h内更容易利用茶汤中的物质。
2.3绿茶茶汤对肠道厚壁菌门的影响
厚壁菌门是人体及高等哺乳动物肠道内一大类细菌,绝大多数是梭菌纲(Clostridia)。这一类细菌属于低 G+C含量的革兰阳性厌氧菌[16]。根据细菌16 S rRNA基因系统发育关系,Clostridia纲分为18个cluster(Ⅰ-Ⅸ),其中球形梭菌亚群(Clostridium coccoides group,clusterⅩⅣa)和柔嫩梭菌亚群(Clostridium leptum subgroup,cluster Ⅳ)是肠道内最为常见的两个类群[17]。通过添加绿茶茶汤培养后测定厚壁菌门的变化情况并与对照组进行比较。
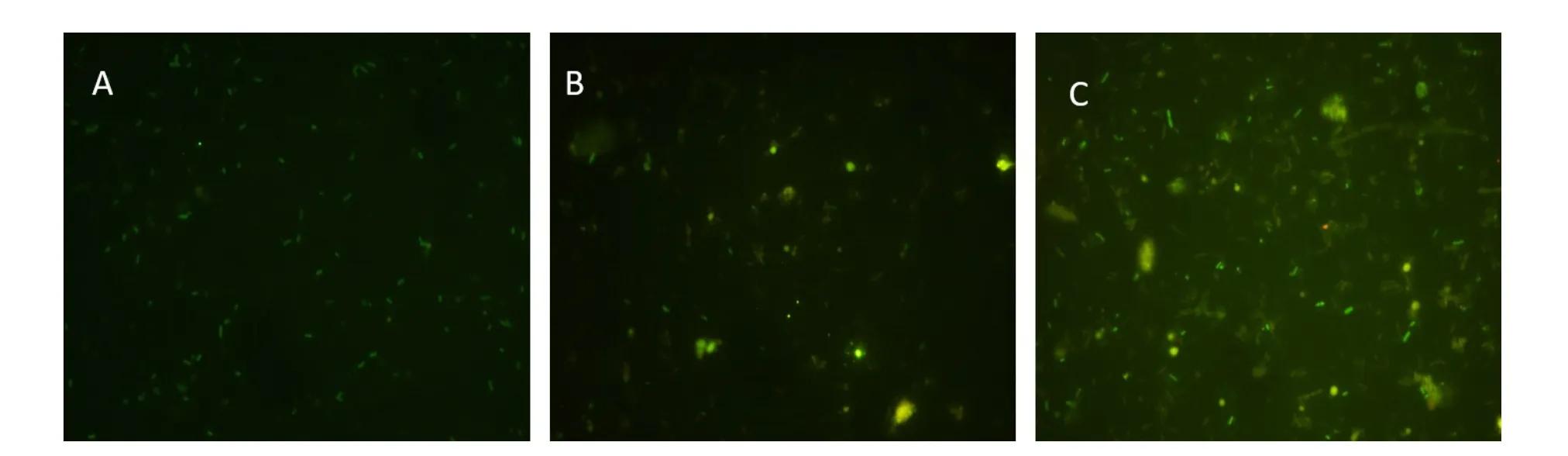
图3 采用Bac1080探针对体外厌氧发酵样液FISH处理后荧光显微镜下观察结果Fig.3 FISH results of anaerobic fermentation broth with water and infusion of green tea observed by epifluorescence microscope注:A、B、C分别是对照组0 h、24 h以及实验组24 h发酵样液Bac1080检测结果。Note:A,B,C were the detection results of probe Bac1080 in control group 0 h,24 h and treatment group 24 h.
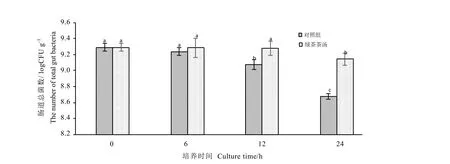
图4 体外培养肠道拟杆菌门微生物的数量变化Fig.4 The change of bacteroidetes in anaerobic fermentation broth
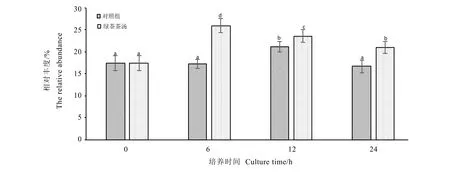
图5 绿茶茶汤体外培养肠道拟杆菌门微生物的相对丰度Fig.5 The relative abundance of bacteroidetes in anaerobic fermentation broth

注:A、B、C分别是对照组0 h、24 h以及实验组24 h发酵样液LGC354检测结果。Note:A,B,C were the detection results of probe LGC354 in control group 0 h,24 h and treatment group 24 h.图6 采用LGC354探针对体外厌氧发酵样液FISH处理后荧光显微镜下观察结果Fig.6 FISH results of anaerobic fermentation broth with water and infusion of green tea observed by epifluorescence microscope
从图6中可以看出,使用LGC345探针可以检测肠道菌群中的厚壁菌门微生物,也可以直观地看出其数量明显少于总菌和拟杆菌门微生物,并且数量变化不明显,24 h对照组(图6-B)与绿茶茶汤组(图 6-C)相差不多。经镜检计数获得对照组和绿茶茶汤组在不同发酵时间厚壁菌门微生物数量的变化情况,结果见图7。由图可知,随着发酵时间的推移对照组厚壁菌门微生物数量呈现下降的趋势,对照组在6 h时与起始数量相比变化不大,但在12 h时及12 h后明显少于0、6 h(P<0.05)。而绿茶茶汤组的粪便厚壁菌门微生物数量也总体呈下降趋势,在 0~12 h变化趋势不明显,但在24 h明显少于前3个时间段,在加入绿茶茶汤 24 h后粪便厚壁菌门微生物数量显著高于同时间的对照组,比对照组 24 h的高32.39%。图8是不同发酵时间厚壁菌门微生物数量的相对丰度。从图中可以发现随着发酵时间推移,对照组厚壁菌门微生物数量的相对丰度逐渐变高,12 h、24 h时间段与0 h均有显著性差异(P<0.05),而绿茶茶汤组在发酵24 h后其相对丰度要显著小于对照组,这可能是因为在发酵过程中茶汤中的物质能够促进拟杆菌门微生物的生长,从而在一定程度上抑制厚壁菌门微生物的优势。这一结果也说明加入绿茶茶汤培养后可以有效改变厚壁菌门微生物数量的相对丰度,从而调节肠道菌群结构。
2.4绿茶茶汤对肠道厚壁菌门和拟杆菌门比值的影响
拟杆菌门和厚壁菌门是对肥胖易感的两类细菌,在众多的文献中报道,其组成和比值在一定程度上可以反映人体肥胖情况。图 9是体外共培养体系中不同发酵时间绿茶茶汤组厚壁菌门与拟杆菌门微生物的比值与对照组的比较。图中可以看出对照组的F/B值随发酵时间增加而缓慢增加,在24 h骤增(P<0.05),而绿茶茶茶汤组该值则缓慢降低,在24 h时显著低于对照组(P<0.05),说明加入茶汤培养一定时间后可以降低肠道中厚壁菌门和拟杆菌微生物数量的比例,这与许多研究结果相一致。张鑫等[18]研究茶叶儿茶素对肠道微生态的调节作用时发现,儿茶素可以显著促进有益菌的生长并且抑制有害菌的增殖,茶多酚对产气荚膜梭菌(C.perfringens)、金黄色葡萄球菌(Staphyloccocus aureus Rosenbach)以及副溶血弧菌(Vibrioparahaemolyticus)都有抑制作用[19],绿茶提取物可以增强双歧杆菌(Bifidobacterium spp.)的生长[20]。
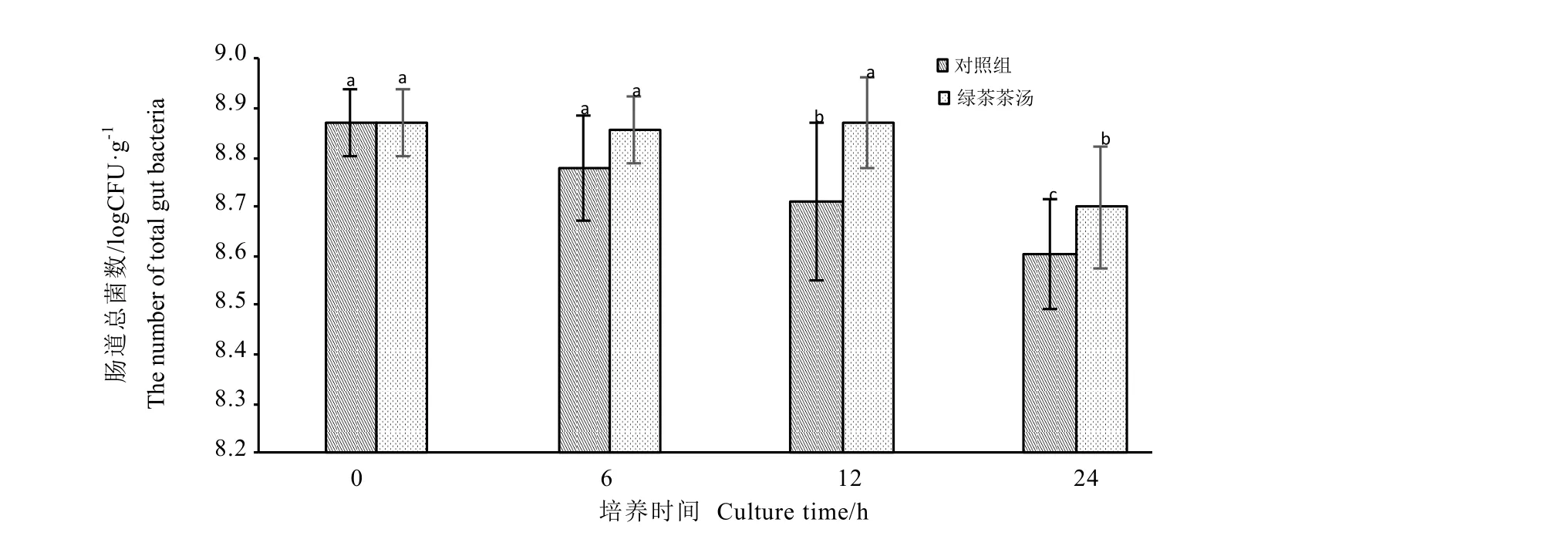
图7 绿茶茶汤体外培养肠道厚壁菌门微生物的数量Fig.7 The number of Firmicutes in anaerobic fermentation broth

图8 绿茶茶汤体外培养肠道厚壁菌门微生物的相对丰度Fig.8 The relative abundance of Firmicutes in anaerobic fermentation broth
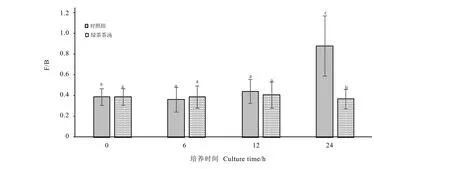
图9 体外厌氧共培养体系中厚壁菌门与拟杆菌门微生物的比值(F/B)Fig.9 The ratio of Firmicutes and bacteroidetes in anaerobic fermentation broth
3 结论
由于难以直接获取志愿者肠道内容物,因此目前体外评估食物成分对人体肠道菌群的影响多采用接近人结肠内菌群结构的粪便作为体外发酵模型的起始菌群,并通过环境控制(如调节 pH、添加培养基等)来模拟肠道环境。张宁等[21]通过加入酵母浸膏、蛋白胨、血清素、多种离子等作为培养基模拟人体肠道的营养环境,并调节通用培养基的pH至6.7,37℃培养,充入氮气设置厌氧环境,接种人体新鲜粪便悬浮液进行探究大蒜果聚糖是否有益生功能,Anna Pompei等[22]通过在通用培养基中加入两种不同类型的果聚糖间歇式静态厌氧培养,探究其调节肠道菌群的作用。但在粪便中额外添加营养成分进而探讨研究对象的肠道菌群调节作用这种模式可能会掩盖研究对象对肠道微生物的较为微弱的作用。如营养丰富的酵母浸膏、蛋白胨、血清素、多种离子等培养基成分或通用培养基对肠道菌群的作用可能高于本研究所探讨的茶叶成分的作用。且这些额外营养成分的添加也不符合实际的生理过程,因为培养基中的蛋白质、脂肪、淀粉、小分子糖等成分基本会被小肠吸收,到达大肠的主要物质为纤维等无法消化吸收的成分,即粪便残渣。因此,本研究以新鲜粪便作为肠道菌的主要营养来源,并构建厌氧环境,模拟实际肠道菌群的生存环境,在此基础上考察绿茶茶汤的肠道菌群调节功能。
实验结果发现,经 24 h共培养后,粪便总菌和拟杆菌门、厚壁菌门微生物数量呈现下降趋势,这与 Guergoletto K B 等[23]研究Euterpe edulis在体外发酵后其总菌数量降低结论一致;Fernando Sánchez-Patán等[24]探究蔓越莓和葡萄籽多酚提取物对调节肠道菌群作用时也发现随着发酵时间的推移,大肠中总菌、拟杆菌的数量呈现下降趋势。主要原因可能是体外肠道环境难以完美模拟。但即使在这一简单模式下,相比于对照组,绿茶茶汤可以抑制肠道总菌、拟杆菌门微生物、厚壁菌门微生物的下降趋势,说明肠道中拟杆菌及厚壁菌可能可利用茶多酚增殖。实验结果还发现,粪便中的拟杆菌门和厚壁菌门微生物对绿茶茶汤的利用效率不同,厚壁菌门微生物的绿茶利用效率更低,反映在绿茶组在24 h后 F/B值显著低于对照。该结果与 QIAO等[25]所开展的研究结果相一致,其动物实验表明,白藜芦醇可以恢复高脂饮食导致的肠道菌群失调,并降低厚壁菌门-拟杆菌门微生物的比值,Cowan T E等[26]研究了咖啡、多酚可恢复肥胖小鼠肠道菌失调,包括降低F/B,抑制肥胖相关梭菌属的生长。厚壁菌门与拟杆菌门微生物数量比例的改变会带来肠道菌群结构的改变,这种改变可能会进一步引起机体肥胖状况的变化。Turnbaugh PJ等[27]给予肥胖志愿者低脂饮食1年后,其体重出现下降,而体内的革兰氏阳性厚壁菌门比例下降,革兰氏阴性拟杆菌门微生物比例上升这一结果证明了这种猜想;动物模型中肠道无菌小鼠给予高脂饮食并不引起肥胖,而接种肥胖小鼠盲肠细菌后显示出明显的体重增加[28],这同样也说明了肠道菌群的改变会影响肥胖状况。可见,绿茶茶汤可以在体外改变与肥胖相关的肠道菌群,进而可能影响体重下降。本研究的结果对进一步了解茶叶的抗肥胖功效提供了一个新的思维角度。
[1]JS,CH,GD.Peak fat [J/OL].The Economist.[2014-05-29]http://www.economist.com/blogs/graphicdetail/2014/05/dail y-chart-19.
[2]NCD Risk Factor Collaboration.Trends in adult body-mass index in 200 countries from 1975 to 2014:a pooled analysis of 1698 population-based measurement studies with 19· 2 million participants [J].The Lancet,2016,387(10026):1377-1396.
[3]Bäckhed F,Ding H,Wang T,et al.The gut microbiota as anenvironmental factor that regulates fat storage [J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15718-15723.
[4]Ley R E,Turnbaugh P J,Klein S,et al.Microbial ecology:human gut microbes associated with obesity [J].Nature,2006,444(7122):1022-1023.
[5]Lepš J,Šmilauer P.Multivariate analysis of ecological data using CANOCO [M].Oxford city:Cambridge University press,2003.
[6]王蝶.茶叶对肥胖大鼠的减肥作用及机制研究[D].长沙:湖南农业大学,2012.
[7]Fukuda S,Toh H,Hase K,et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate [J].Nature,2011,469(7331):543-547.
[8]林智.乌龙茶的减肥功效研究[J].茶博览,2013(7):70-73.
[9]龚金炎,焦梅,吴晓琴,等.茶叶减肥作用的研究进展[J].茶叶科学,2007,27(3):179-184.
[10]陈金华,谭斌,龚雨顺,等.红茶对高脂饮食小鼠血脂的调节作用研究[J].茶叶科学,2015,35(4):384-396.
[11]Bose M,Lambert J D,Ju J,et al.The major green tea polyphenol,(-)-epigallocatechin-3-gallate,inhibits obesity,metabolic syndrome,and fatty liver disease in high-fat-fed mice [J].J Nutr,2008,138(9):1677-1683.
[12]刘安军,郭丹霄,刘慧慧,等.绿茶提取物的降血脂及减肥作用研究[J].现代食品科技,2012,28(6):601-605.
[13]Johnson R,Bryant S,Huntley A L.Green tea and green tea catechin extracts:An overview of the clinical evidence [J].Maturitas,2012,73(4):280-287.
[14]Paster B J,Dewhirst F E,Olsen I,et al.Phylogeny of Bacteroides,Prevotella,and Porphyromonas spp.and related bacteria [J].Journal of Bacteriology,1994,176(3):725-732.
[15]Salyers A A.Bacteroides of the human lower intestinal tract [J].Annual Reviews in Microbiology,1984,38(1):293-313.
[16]Hayashi H,Sakamoto M,Benno Y.Phylogenetic analysis of the human gut microbiota using 16 S rDNA clone libraries and strictly anaerobic culture-based methods [J].Microbiology and Immunology,2002,46(8):535-548.
[17]Collins M D,Lawson P A,Willems A,et al.The phylogeny of the genus Clostridium:proposal of five new genera and eleven new species combinations [J].International Journal of Systematic and Evolutionary Microbiology,1994,44(4):812-826.
[18]张鑫,马丽苹,张芸,等.茶叶儿茶素对肠道微生态的调节作用[J].食品科学,2013,34(5):232-237.
[19]华德兴,钱元恕,彭青.绿茶对耐甲氧西林金黄色葡萄球菌的抗西作用及机制研冤进展[J].中国新药与临床杂志,2008,27(9):697-701.
[20]Sae-Tan S,Grove K A,Lambert J D.Weight control and prevention of metabolic syndrome by green tea [J].Pharmacological Research,2011,64(2):146-154.
[21]张宁,曾艳华,吴希阳,等.中性大蒜果聚糖体外发酵产短链脂肪酸[J].食品与发酵工业,2013(1):51-54.
[22]Pompei A,Cordisco L,Raimondi S,et al.In vitro comparison of the prebiotic effects of two inulin-type fructans [J].Anaerobe,2008,14(5):280-286.
[23]Guergoletto K B,Costabile A,Flores G,et al.In vitro fermentation of juçara pulp(Euterpe edulis)by human colonic microbiota [J].Food Chemistry,2016,196:251-258.
[24]Sánchez-Patán F,Barroso E,Van de Wiele T,et al.Comparative in vitro fermentations of cranberry and grape seed polyphenols with colonic microbiota [J].Food Chemistry,2015,183:273-282.
[25]Qiao Y,Sun J,Xia S,et al.Effects of resveratrol on gut microbiota and fat storage in a mouse model with high-fat-induced obesity [J].Food & Function,2014,5(6):1241-1249.
[26]Cowan T E,Palmnäs M S A,Yang J,et al.Chronic coffee consumption in the diet-induced obese rat:impact on gut microbiota and serum metabolomics [J].The Journal of Nutritional Biochemistry,2014,25(4):489-495.
[27]Turnbaugh P J,Ley R E,Mahowald M A,et al.An obesity-associated gut microbiome with increased capacity for energy harvest [J].Nature,2006,444(7122):1027-1131.
[28]Bäckhed F,Ding H,Wang T,et al.The gut microbiota as an environmental factor that regulates fat storage [J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(44):15718-15723.
Effect of Green Tea Infusions on Obesity-associated Gut Microbiota
GUO Hongwen,XU Xiangyu,CHEN Yingjie,NI Li,LIU Zhibin*
Institute of Food Science and Technology,Fuzhou University,Fujian Center of Excellence for Food Biotechnology,Fuzhou 350108,China
In recent years,the effect of tea on intestinal microflora attracted widespread attention.In this study,the green tea infusion with human fecal was mixed,the change of intestinal flora related to obesity in different fermentation time points(0,6,12,24 h)were measured and the role of tea regulated intestinal microflora was evaluated.The results showed that green tea infusion inhibited the reduction of total gut bacteria,Bacteroides and Firmicutes after fermentation for 24 h(P<0.05),improved the relative abundance of Bacteroides and Firmicutes,reduced the F/B ratio,which provides a reference to support the important role of green tea infusion in improving intestinal health,reducing weight and lowering blood lipid.
green tea infusion,intestinal bacteria,obesity,Bacteroides,Firmicutes
TS272.5+;R574
A
1000-369X(2016)04-354-09
2016-04-01
2016-05-08
国家自然科学基金资助(31501494)
郭虹雯,女,硕士研究生,主要从事茶叶生理功能方面的研究。*通讯作者:liuzhibin@fzu.edu.cn
