首发未用药精神分裂症与精神分裂症患者健康子女静息态脑功能低频振幅研究
2016-09-07王晔王大海魏胜男王菲汤艳清
王晔 王大海 魏胜男 王菲 汤艳清
·论著·
首发未用药精神分裂症与精神分裂症患者健康子女静息态脑功能低频振幅研究
王晔*王大海**魏胜男△王菲△汤艳清△
目的探讨首发未用药精神分裂症患者和精神分裂症患者健康子女脑功能磁共振低频振幅(amplitude of low frequency fluctuation,ALFF)的共性与差异。方法应用静息态功能磁共振ALFF的方法对年龄<30岁的23例首发未用药精神分裂症患者、25名精神分裂症患者健康子女以及29名健康对照进行大脑范围内ALFF值比较。结果与对照组相比,患者组和患者子女组在左侧颞下回后部、左侧海马旁回、左侧海马、右侧中央后回、双侧楔前叶的ALFF值有统计学差异(P<0.05),而患者组和患者子女组间在以上脑区的ALFF值无统计学差异(P>0.05);与患者子女组和对照组相比,患者组在左侧颞下回前部、左侧颞上极、双侧距状裂周围皮层的ALFF值有统计学差异(P<0.05),患者子女组和对照组间在以上脑区的ALFF值无统计学差异(P>0.05)。 结论首发未用药精神分裂症患者以及精神分裂症患者健康子女都存在脑功能异常;左侧颞下回后部、左侧海马旁回、左侧海马、右侧中央后回、双侧楔前叶可能是与精神分裂症遗传素质性相关的脑区;左侧颞下回前部、左侧颞上极、双侧距状裂周围皮层可能是与疾病状态性相关的脑区。
精神分裂症精神分裂症患者健康子女静息态脑功能成像血氧水平依赖低频振幅
精神分裂症(schizophrenia,SZ)具有高度遗传性[1],目前研究认为精神分裂症患者的一级健康亲属是精神分裂症患病的高危人群(high risk for schizophrenia,HR-SZ)[1-2]。脑功能磁共振(functional MRI,fMRI)低频振幅(amplitude of low frequency fluctuation,ALFF)可能是反映大脑疾病状态的一个指标[3-6],目前研究指出精神分裂症患者ALFF异常脑区包括枕中回、海马、海马旁回、中央后回、中央前回、双侧楔前叶、颞中回等[7-9]。采用ALFF对精神分裂症患者健康子女进行的研究目前较少,尚无研究直接将精神分裂症患者、患者健康子女和健康对照进行比较。本研究采用ALFF的分析方法对精神分裂症患者、精神分裂症患者健康子女和健康对照直接进行比较,以分析其ALFF值的共性与差异。本研究假设:①患者和患者健康子女在某些脑区ALFF值可能存在共同变化,这些脑区可能和精神分裂症遗传因素有关,即素质性脑功能改变;②某些脑区ALFF值的改变可能只出现在精神分裂症患者中,而在患者健康子女和对照中都没有改变,这些脑区功能改变可能和发病因素有关,即疾病状态性脑功能改变;③某些脑区的ALFF值异常可能只出现在患者健康子女中,属于其未发病的保护性因素。
1 对象与方法
1.1研究对象患者组来自2009年7月至2014年10月中国医科大学附属第一医院精神医学科以及沈阳市精神卫生中心就诊的首发未用药精神分裂症患者。入组标准:①符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition,DSM-Ⅳ)精神分裂症或分裂样精神障碍的诊断标准,所有患者经过6个月的电话随访以确诊为精神分裂症;②首次发病且未经过抗精神病药物或电休克治疗,病程≤1年;③年龄<30岁,汉族,右利手。排除标准:①有重大躯体疾病史,尤其是可能影响大脑结构和功能的疾病,如高血压、脑肿瘤、癫痫、脑血管病、脑肿瘤病变和神经变性疾病史等,以及重大头部创伤史(持续5 min以上的意识丧失);②患有不稳定的躯体疾病,如重性哮喘等;③患有可能导致心境障碍的躯体疾病,如多发性硬化、甲状腺疾病等;④患有精神发育迟滞、孤独症、广泛发育障碍;⑤患有幽闭恐怖症;⑥体内有强磁性物体;⑦物质依赖或滥用者;⑧长期使用中枢神经系统作用的药物或影响情绪的药物者;⑨孕妇。共收集28例患者,其中在随访时有2例修改诊断为分离转换障碍,1例修改诊断为双相情感障碍,2例因头动较大而剔除。最终有23例患者入组,其中男性8例,女性15例;年龄12~29岁,平均(18.78±3.49)岁;病程0.2~12月,平均(3.20±3.20)月。
患者子女组来自中国医科大学附属第一医院精神医学科和沈阳市精神卫生中心就诊的精神分裂症患者的健康子女。入组标准:①父母至少一方符合DSM-Ⅳ中精神分裂症的诊断标准;②本人无DSM-Ⅳ轴Ⅰ或轴Ⅱ有关的疾病;③未服用过任何精神科药物;④年龄<30岁,汉族,右利手;⑤与患者组均无血缘关系。排除标准同患者组。共收集26名患者子女,其中1名因头动而剔除。最终25名健康子女入组,男性14名,女性11名;年龄12~29岁,平均(19.56±4.57)岁。
对照组为来自社区的健康志愿者。入组标准:①无DSM-Ⅳ轴Ⅰ或轴Ⅱ有关的疾病;②无精神疾病家族史;③入组前未服用过任何精神科药物;④年龄<30岁,汉族,右利手;⑤与患者组均无血缘关系。排除标准同患者组。共收集29名对照,其中男性12名,女性17名;年龄12~29岁,平均(19.45±3.50)岁。
1.2静息态fMRI成像磁共振扫描在中国医科大学附属第一医院影像科进行,由熟练磁共振操作的放射科医生完成。扫描设备采用3.0 T超导型扫描仪(General Electric Company,Milwaukee,USA)。扫描前嘱受试者在扫描过程中保持清醒、闭眼、均匀呼吸,尽量不做思维活动,保持身体不动。扫描时受试者保持仰卧,头部置于线圈中央,并用泡沫填充头部和线圈中的间隙以固定头部。戴上耳塞以减少扫描时噪音对受试者的影响。扫描参数:重复时间(repetition time,TR)=2000 ms;回波时间(echo time,TE)=40 ms;矩阵=64×64;视野(field of view,FOV)=240 mm×240 mm;层厚=3 mm;层间隔=0 mm;200个时间点,每个时间点扫描35层;扫描时间400 s。
1.3fMRI数据分析
1.3.1预处理在Matlab(http://www.mathworks.cn)软件平台上,对fMRI原始数据预处理使用基于SPM8软件(http://www.fil.ion.ucl.ac.uk/spm/software/spm8)的静息态fMRI数据处理助手软件包(Data Processing Assistant for Resting-State fMRI,DPARSF V2.0)。首先将DICOM格式数据转换为Nifti格式数据;移除前10个时间点,保留190个时间点的数据,从而排除机器稳定性和受试者适应环境的影响;层间时间差异校正(slice timing)以校正图像在获取时间上的差异;头动校正(realignment),剔除头平移(translation)大于3 mm或旋转(rotmion)大于3°的受试者;空间标准化(normalization),应用3 mm×3 mm×3 mm的采样分辨率将所有受试者的fMRI图像标准化到SPM标准蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)空间;平滑处理,采用6 mm×6 mm×6 mm的高斯核对fMRI图像进行平滑,使图像的信噪比增加;去线性漂移和滤波(0.01~0.08 Hz)处理,以减少低频漂移和高频生理性噪声。
1.3.2ALFF值计算使用REST软件包(Resting-State FMRI Data Analysis Toolkit,V1.7,http://www.restfmri.net)计算ALFF值。主要分为3个步骤:①在全脑范围内逐体素地对滤波后的时间序列行傅立叶变换以获得频域功率谱;②对0.01~0.08 Hz范围的功率谱进行开方,得到ALFF值;③用全脑每个体素ALFF值和全脑信号幅值均值相除,从而消除个体间全脑ALFF水平的差异,获得标准化ALFF图像。
1.4统计学方法使用REST软件对三组被试标准ALFF脑图中对应位置的每个体素行基于体素的单因素方差分析,以比较其ALFF值,在REST的AlphaSim插件中设定全宽半高(full-width half-maxi-mum,FWHM)为6,基于体素的检验水准α为0.05,模拟1000次,得到基于区域的检验结果为P<0.05时相应的体素数为>123。得出组间有差异的脑区后,应用REST软件提取差异脑区内的平均ALFF值,并使用SPSS 21.0对平均ALFF值进行两两组间比较,采用Bonferroni法,检验水准α为0.05,双侧检验。
2 结果
患者组、患者子女组和对照组行基于体素的单因素方差分析共得到4簇(cluster,CL)有差异脑区,分别为CL1(左侧颞下回前部、左侧颞上极)(F=10.08,P<0.05),CL2(左侧颞下回后部、左侧海马旁回、左侧海马)(F=8.87,P<0.05),CL3(双侧距状裂周围皮层)(F=8.61,P<0.05),CL4(右侧中央后回、双侧楔前叶)(F=8.70,P<0.05)。见表1与图1。
两两比较示,与对照组相比,患者组和患者子女组在CL2(左侧颞下回后部、左侧海马旁回、左侧海马)、CL4(右侧中央后回、双侧楔前叶)的ALFF值均有统计学差异(P<0.05),患者组和患者子女组之间在以上脑区的ALFF值无统计学差异(P>0.05)。与患者子女组和对照组相比,患者组在CL1(左侧颞下回前部、左侧颞上极)、CL3(双侧距状裂周围皮层)的ALFF值差异有统计学意义(P<0.05),患者子女组和对照组间在以上脑区的ALFF值无统计学差异(P>0.05)。见表2。

表1 患者组、患者子女组和对照组ALFF值有统计学差异的脑区

表2 患者组、患者子女组和对照组各差异脑区ALFF值±s)
1)与患者子女组比较,经多重检验Bonferroni校正,P<0.05;2)与对照组比较,经多重检验Bonferroni校正,P<0.05
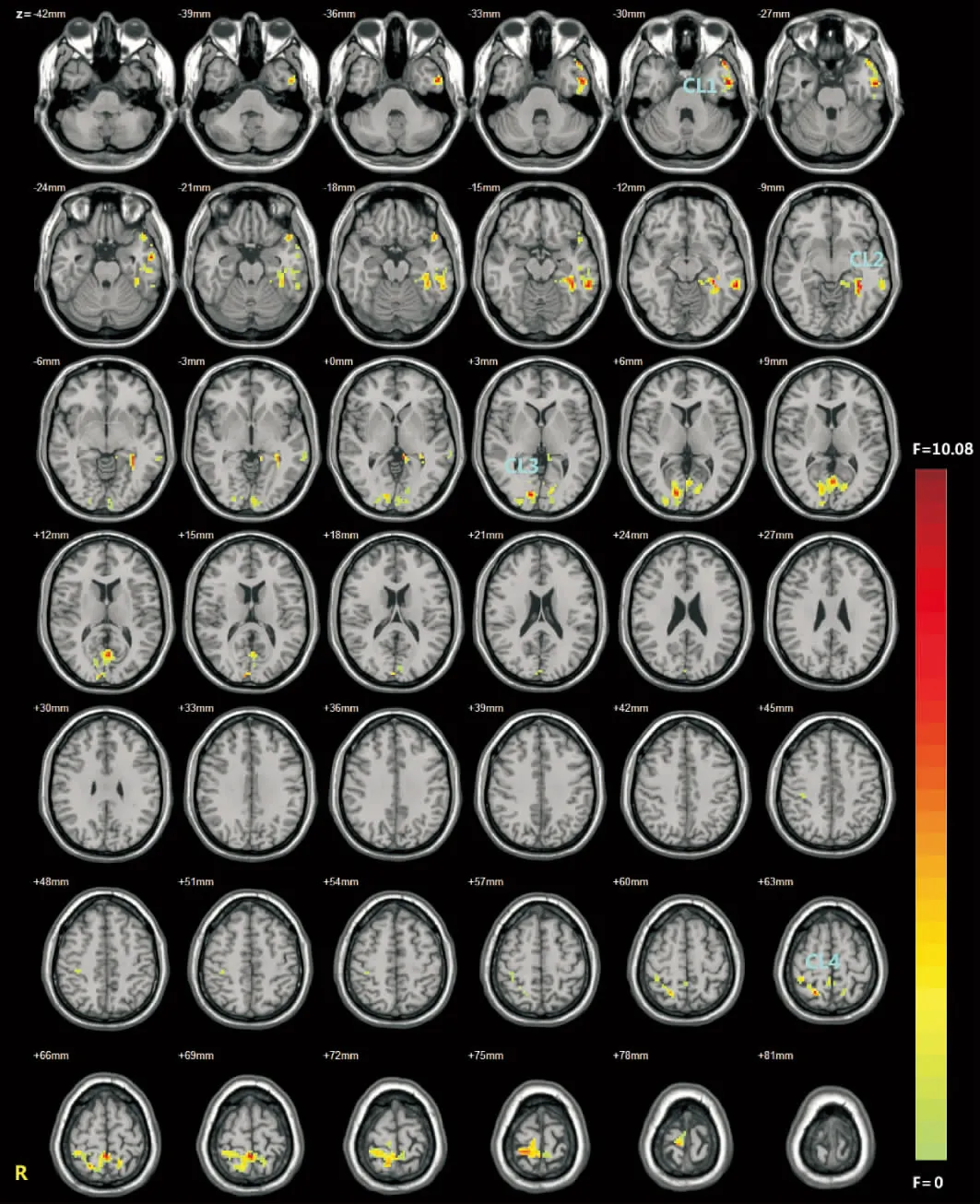
图1 患者组、患者子女组和对照组比较ALFF值有差异的脑区 CL1为左侧颞下回前部、左侧颞上极;CL2为左侧颞下回后部、左侧海马旁回、左侧海马;CL3为双侧距状裂周围皮层;CL4为右侧中央后回、双侧楔前叶。图中蓝色到红色表示F值增大,最大值F=10.08。
3 讨论
本研究发现,与对照组相比,患者组与患者子女组在CL2(左侧颞下回后部、左侧海马旁回、左侧海马)、CL4(右侧中央后回、双侧楔前叶)的ALFF值有统计学差异,这一结果提示本研究假设①成立,说明CL2、CL4的ALFF值显著改变可能与遗传因素有关,即素质性脑功能改变。本研究另一个较重要的发现是与患者子女组和对照组相比,患者组在CL1(左侧颞下回前部、左侧颞上极)、CL3(双侧距状裂周围皮层)的ALFF值有统计学差异,患者子女组在以上脑区的ALFF值与对照组相比无统计学差异,与研究假设②一致,说明以上脑区脑功能改变可能和发病因素有关,即疾病状态性脑功能改变。但是本研究并未证实假设③患者子女组有特异的ALFF值改变。
此前已有研究表明精神分裂症患者海马和海马旁回的结构和功能存在异常[10-11],RASETTI等[12]研究发现精神分裂症患者和患者的健康同胞在执行相关任务时与对照组相比,海马和海马旁回信号激活减弱,并指出海马和海马旁回功能的损害可能与精神分裂症的遗传因素有关。本研究同样发现患者、患者健康子女与对照组相比左侧海马旁回和左侧海马ALFF值显著升高,由此推测左侧海马和海马旁回可能和疾病的遗传因素有关,与以上文献研究结果一致。既往有研究指出首发精神分裂症患者颞极皮层厚度和表面积与对照组相比无变化[13],而本研究发现精神分裂症患者与对照组相比ALFF值升高,由此推论可能颞极的功能改变早于结构改变。有研究指出与对照组相比,精神分裂症患者在中央后回、双侧楔前叶ALFF值降低[7-8],本研究结果与该研究一致,并且进一步发现与对照组相比患者健康子女以上脑区ALFF值显著降低,说明中央后回和楔前叶可能和疾病的遗传素质性因素有关,但这有待进一步的研究证实。
精神分裂症患者健康子女患精神分裂症的风险显著高于普通人群[14-15],目前关于患者健康子女的脑功能研究较少,本研究通过对患者和患者健康子女的比较,发现其部分脑区ALFF的改变相似,从而验证了本研究假设①,即患者健康子女可能存在着素质性脑功能改变,为今后患者健康子女的进一步研究提供了一个方向。有研究表明,精神分裂症患者在服用抗精神病药物4~6周后脑功能会发生改变[16-17],本研究纳入的精神分裂症患者均为首次发病,病程较短,属于疾病的早期阶段,且均未服用抗精神病药物,从而排除抗精神病药物对患者脑功能的影响,更能反映疾病本身造成的脑功能改变。但本研究尚存在许多的局限性,首先本研究属于横向研究,需要长期对精神分裂症健康子女组进行随访,以进一步验证研究结果;其次,本研究样本量较小,需要在后续的研究中进一步扩大样本量;再次,本研究对象年龄跨度较大,可能对研究结果造成一定的影响。
[1]SU TW, LAN TH, HSU TW, et al. Reduced neuro-integration from the dorsolateral prefrontal cortex to the whole brain and executive dysfunction in schizophrenia patients and their relatives [J]. Schizophr Res, 2013, 148(1-3): 50-58.
[2]KHADKA S, MEDA SA, STEVENS MC, et al. Is aberrant functional connectivity a psychosis endophenotype? A resting state functional magnetic resonance imaging study [J]. Biol Psychiatry, 2013,74(6): 458-466.
[3]ZANG YF, HE Y, ZHU CZ, et al. Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI [J]. Brain Dev,2007, 29(2): 83-91.
[4]CHENG Y, XU J, NIE B, et al. Abnormal resting-state activities and functional connectivities of the anterior and the posterior cortexes in medication-naive patients with obsessive-compulsive disorder [J]. PloS One, 2013, 8(6): e67478.
[5]TURNER JA, DAMARAJU E, VAN ERP TG, et al. A multi-site resting state fMRI study on the amplitude of low frequency fluctuations in schizophrenia [J]. Front Neurosci, 2013,7: 137.
[6]VARGAS C, LOPEZ-JARAMILLO C, VIETA E. A systematic literature review of resting state network--functional MRI in bipolar disorder [J]. J Affect Disord, 2013, 150(3): 727-735.
[7]HOPTMAN MJ, ZUO XN, BUTLER PD, et al. Amplitude of low-frequency oscillations in schizophrenia: a resting state fMRI study [J]. Schizophr Res, 2010, 117(1): 13-20.
[8]YU R, CHIEN YL, WANG HL, et al. Frequency-specific alternations in the amplitude of low-frequency fluctuations in schizophrenia [J]. Hum Brain Mapp, 2014, 35(2): 627-637.
[9]LUI S, YAO L, XIAO Y, et al. Resting-state brain function in schizophrenia and psychotic bipolar probands and their first- degree relatives [J]. Psychol Med, 2015, 45(1): 97-108.
[10]LEDOUX A, BOYER P, PHILLIPS JL, et al. Structural hippocampal anomalies in a schizophrenia population correlate with navigation performance on a wayfinding task [J]. Front Behav Neurosci, 2014, 8: 88.
[11]GUO X, LI J, WANG J, et al. Hippocampal and orbital inferior frontal gray matter volume abnormalities and cognitive deficit in treatment-naive, first-episode patients with schizophrenia [J]. Schizophr Res, 2014, 152(2-3): 339-343.
[12]RASETTI R, MATTAY VS, WHITE MG, et al. Altered hippocampal-parahippocampal function during stimulus encoding a potential indicator of genetic liability for schizophrenia [J]. JAMA Psychiatry, 2014, 71(3): 236-247.
[13]ROIZ-SANTIANEZ R, PEREZ-IGLESIAS R, QUINTERO C, et al. Temporal pole morphology in first-episode schizophrenia patients: clinical correlations [J]. Psychiatry Res, 2010, 184(3): 189-191.
[14]TSUANG M T, STONE WS, FARAONE SV. Genes, environment and schizophrenia [J]. Br J Psychiatry Suppl, 2001, 40: s18-24.
[15]TSUANG M. Schizophrenia: genes and environment [J]. Biol Psychiatry, 2000, 47(3): 210-220.
[16]Lui S, Li T, Deng W, et al. Short-term effects of antipsychotic treatment on cerebral function in drug-naive first-episode schizophrenia revealed by "resting state" functional magnetic resonance imaging [J]. Arch Gen Psychiatry 2010,67(8): 783-792
[17]Keedy SK, Reilly JL, Bishop JR, Weiden PJ, Sweeney JA. Impact of antipsychotic treatment on attention and motor learning systems in first-episode schizophrenia [J]. Schizophrenia bulletin 2015,41(2): 355-365.
(责任编辑:肖雅妮)
A resting-state functional magnetic resonance imagingstudy in first-episode drug-naive schizophrenia and offspring of schizophrenia patients.
WANG Ye, WANG Dahai, WEI Shengnan, WANG Fei, TANG Yanqing.
Shenyang mental health center, Shenyang 110168, China. Tel: 024-83283333.
Objective To explore the similarities and differences in amplitude of low frequency fluctuation (ALLF) between patients with first-episode drug-naive schizophrenia and offspring of schizophrenia patients.MethodsALFF values were estimated by measuring the Blood Oxygen Level-Dependent (BOLD) signal using resting state functional magnetic resonance imaging (rs-fMRI). The fMRI date were acquired from 23 patients with first-episode drug-naive schizophrenia (SZ), 25 offsprings of schizophrenia patients (OS) and 29 age- and gender-matched health controls(HC). The ALFF value of each subject was calculated by MATLAB-based DPARSF software.ResultsCompared with HC, the ALFF values of SZ and OS were significantly different in the left posterior part of the inferior temporal gyrus, left parahippocampal gyrus, left hippocampus, right postcentral gyrus and bilateral precuneus. The ALFF values were not significantly different between these two groups in the aforementioned regions. Compared with OS and HC, the ALFF values of SZ were significantly different in the left anterior part of the inferior temporal gyrus, left temporal pole and bilateral calcarine cortex. But there was no significant difference between OS and HC.ConclusionsThe brain function is abnormal in patients with early schizophrenia and offspring of schizophrenia patients. The significant difference of ALFF in the left posterior part of the inferior temporal gyrus, left parahippocampal gyrus, left hippocampus, right postcentral gyrus and bilateral precuneus may suggest the heredodiathesis-related brain functional alterations. Significant difference of ALFF in the left anterior part of the inferior temporal gyrus and the left temporal pole bilateral calcarine cortex may suggest the disease-related brain alterations.
SchizophreniaOffspring of schizophreniaResting state functional magnetic resonance imaging (rs-fMRI)Blood oxygen level dependent (BOLD)Amplitude of low frequency fluctuation (ALLF)
10.3969/j.issn.1002-0152.2016.06.005
*沈阳市精神卫生中心心理科(沈阳110001)
**沈阳市精神卫生中心医务科
△中国医科大学附属第一医院精神医学科
E-mail:wdoctory@sina.com)
R749.3
A
2016-03-06)
