内源性硫化氢及其合成酶在人成骨肉瘤细胞中表达的研究
2016-09-05胡杨覃巍廉凯晏雄伟陆新颜
胡杨 覃巍 廉凯 晏雄伟 陆新颜
·实验研究论著·
内源性硫化氢及其合成酶在人成骨肉瘤细胞中表达的研究
胡杨覃巍廉凯晏雄伟陆新颜
目的观察硫化氢(H2S)及其合成酶胱硫醚⁃β⁃合成酶(CBS)、胱硫醚⁃γ⁃裂解酶(CSE)和3⁃巯基丙酮酸硫转移酶(MPST)在人成骨细胞株及人成骨肉瘤细胞系中的表达。方法我科于2013年6月至2014年12月运用免疫组化染色和蛋白质印迹方法在人永久性成骨细胞株hFOB1.19,成骨肉瘤细胞株Saos⁃2、MG⁃63和U⁃2 OS中分别检测CBS、CSE和MPST基因表达量、蛋白含量;通过敏感硫电极法检测H2S在正常成骨组织和骨肉瘤细胞中的含量。分别比较H2S及其合成酶在各组之间的差异,初步探讨H2S及其合成酶与不同成骨肉瘤细胞之间的关系。结果在成骨肉瘤标本和细胞中CBS、CSE和MPST基因的较高表达;成骨肉瘤组织与成骨细胞来源的正常和恶性肿瘤细胞CBS、CSE和MPST基因表达的蛋白水平以及H2S产生率不同,其中成骨肉瘤细胞株U⁃2 OS表达水平最高。结论内源性H2S及它的合成酶CBS、CSE和MPST存在于人恶性成骨肉瘤组织和细胞中,高水平的H2S及其生物合成物质或许能成为成骨肉瘤治疗的新靶点。
硫化氢;骨肉瘤;成骨细胞;细胞凋亡
成骨肉瘤占所有恶性肿瘤的比例不到1%,是最常见的骨恶性肿瘤,在儿童和青少年中多见[1,2]。尽管联合了外科和其他治疗方法,大部分患者后来仍会复发并最终死于肺转移[3]。基于顺铂新的辅助化疗方法是治疗进展期转移性成骨肉瘤的唯一方法,起初疗效良好,随后会出现固有的或获得性顺铂耐药而使治疗失败[4]。研究表明多重机制导致顺铂耐药性的产生,包括药量摄入的减少和/或流出的增加,含硫蛋白和/或分子的失活,DNA包含修复和/或耐受能力的增加,以及凋亡启动的失效[5]。顺铂反应性的抑制和逆转是核心部分,因其耐药和致死性结局的高发,需要更有力的研究进行证实。
在哺乳类动物中,硫化氢(H2S)是一种新近发现的由β胱硫酸合成酶(CBS)、γ胱硫酸裂解酶(CSE)和3⁃巯基丙酮酸硫基转移酶(MPST或3⁃MST)三种酶催化产生的内生性气体信号转导分子[6]。尽管骨骼系统中内源性H2S的表达和功能尚未完全清楚,一些研究表明H2S能参与破骨细胞和牙髓干细胞的分化以及成骨细胞氧化损伤的保护[7,8]。
骨肿瘤的形成中,包括气体信号分子在内的各种因子参与此进程,从而产生相应的病理表现[9,10]。新型气体信号分子H2S在骨来源细胞中所起的作用,目前国际上仅见Irie等[11]观察到外源性给予H2S可引起大鼠牙槽骨中破骨细胞的成骨性分化,而最为重要的H2S在正常以及恶性骨来源组织和细胞中的表达以及可能的功能情况仍未见报道。
我们假设增加H2S含量和其生物合成或许能在成骨肉瘤中起作用,通过体外直接增加H2S供体NaHS含量或抑制内源性H2S生物合成,在人正常成骨细胞hFOB1.19和人成骨肉瘤细胞U⁃2 OS中,它们增殖和凋亡的明显变化。本项研究致力于在人成骨肉瘤标本和培养细胞中识别H2S的产生能力和CBS、CSE和MPST基因的蛋白表达水平。本项研究目的在于:①在人成骨肉瘤标本和培养细胞中识别H2S的产生能力和CBS、CSE和MPST基因的蛋白表达水平,探讨在骨肿瘤的发生发展的过程中,H2S的表达以及功能意义;②研究H2S在其增殖和凋亡过程中的潜在作用,探讨其在成骨肉瘤治疗中成为新的药物靶点的可能。
材料和方法
一、实验材料
人永久性成骨细胞株hFOB1.19(CRL⁃11372)、成骨肉瘤细胞株Saos⁃2(HTB⁃85)、MG⁃63(CRL⁃1427)和U⁃2 OS(HTB⁃96)从美国模式培养物集存库获得。hFOB1.19细胞株在去除了苯酚红的DMEM (HyClone,Thermo Fish Scientific公司,美国)与F12 按1∶1混合的培养基中培养。Saos⁃2细胞株常规在McCoy’s 5a培养基(HyClone)中培养,MG⁃63细胞株常规在Eagle’s Minimum Essential Medium(Invitrogen公司,美国)中培养,U⁃2 OS细胞株常规在McCoy’s 5a培养基中培养。所有培养基中加入10%胎牛血清(FBS,Invitrogen公司,美国),100 U的青霉素G和100 μg链霉素(Lonza Group公司,瑞士)。
二、实验方法
(一)组织标本和细胞CBS、CSE和MPST基因免疫组化染色和图像的半定量检测
将4 μm厚石蜡包埋切片用3%过氧化氢处理15 min后,再用标准山羊血清孵育30 min,以阻断非特异性结合位点。接着进行再补水过程,用微波炉让组织切片在四乙铵二乙酸钠(EDTA)缓冲液中沸腾10 min,进行抗原恢复。切片CBS(Abnova,中国台湾)、CSE(Abnova,中国台湾)和MPST(Santa Cruz Biotechnology,美国)基因检测一抗于4℃冰箱用1∶200的鼠抗人抗体孵育12 h。PBST漂洗后,二抗用辣根过氧化物酶标记的羊抗鼠IgG抗体孵育(Santa Cruz Biotechnology公司,美国),二抗由过氧化物酶标记链霉亲和素以及二氨基联苯胺配制,并用苏木精进行对比染色。每例标本选取10张连续组织切片进行免疫组织化学图像半定量检测,通过MSTS评分系统及Enneking肌肉骨骼系统肿瘤术后评价标准和特异性染色强度进行分组。染色强度阴性记为“-”,中等记为“+”,强染色记为“++”。
切片上的U⁃2 OS细胞用PBS冲洗2次后,在PBS缓冲液中用4%多聚甲醛固定30 min,然后室温下用渗透液(BD Pharmingen公司,美国)处理5 min。盖玻片于4℃用一抗孵育12 h,再用1∶50的异硫氰酸荧光素(fluorescein isothiocyanate,FITC)抗鼠二抗(Santa Cruz Biotechnology公司,美国)于37℃孵育1 h。切片DAPI处理后用激光共聚焦显微镜(Olympus公司,日本)获取图像。
(二)蛋白质印迹检测细胞中蛋白含量
成骨肉瘤细胞置于人胚肺成纤维细胞(WI⁃38)的裂解产物(Abnova)中,用Bradford蛋白法测量蛋白质浓度,CBS、CSE和MPST基因的表达水平通过蛋白质印迹法分析。采用十二烷基硫酸钠-聚丙烯酰胺凝胶(Bio⁃Rad Life Science公司,美国)电泳,每条泳道加载100 μg蛋白,并转移到硝酸纤维素膜上,用5%脱脂奶粉进行封膜,用1∶1 000鼠抗人CBS、CSE和MPST抗体,α微管蛋白抗体(Abnova,中国台湾)孵育,然后用辣根过氧化酶二抗(Santa Cruz Biotechnology公司,美国)孵育。ECL免疫印迹试剂盒(Promega公司,美国)监测信号,并用柯达成像系统(Eastman Kodak公司,美国)记录。
(三)H2S产生能力分析
成骨肉瘤细胞均匀分布于10倍于自身体积(wt/ vol)的冰镇磷酸钾缓冲液中(pH=6.8)。反应在25 ml锥形瓶中进行,2 ml试管作为中央井,每管含有1 mol/L NaOH 0.5 ml,硫敏感电极(PXS⁃270,上海)用于测定内源性H2S产生率,代表产H2S酶的活力[16]。用细胞匀浆同500 μl预冷的50 mmol/L pH=6.8 PBS缓冲液和1 ml反应系统溶液(100 mmol/L pH=7.4 PBS,10 mmol/L L⁃cys mmol/L)混合,制备混合液。在样本蛋白浓度测定后,取2 ml上述混合液移入室温下的烧瓶中,密封后37℃水浴90 min。然后加入50%三氯乙酸1 ml结束反应,并继续37℃水浴60 min。把中央井中的内容物分装到12支含有1 ml抗氧化剂的试管(Corning公司,美国)中。随后,用硫敏感电极测量标准曲线下上述试管中的H2S含量,单位nmol/(min·mg)。
三、统计学分析
采用SPSS 12.0进行统计学分析。正常骨组织和成骨肉瘤细胞中CBS、CSE和MPST基因蛋白表达水平,H2S产生能力对比,组间采用独立样本t检验。P<0.05表示差异有统计学意义。
结果
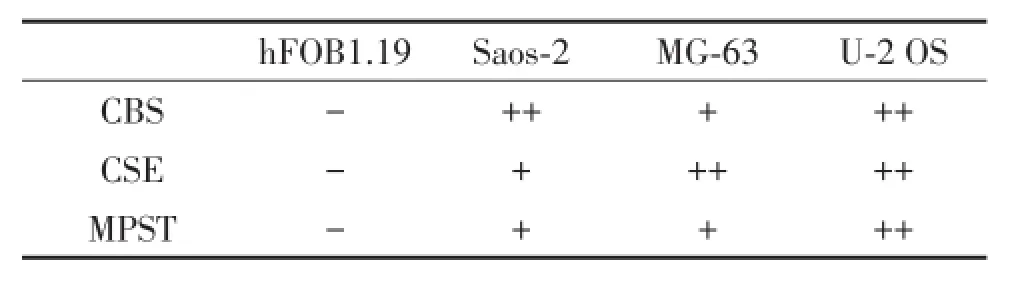
表1 各细胞涂片CBS、CSE、MPST染色强度
一、成骨肉瘤细胞中CBS、CSE和MPST基因的表达
正常成骨细胞hFOB1.19很少或不表达CBS、CSE或MPST,成骨肉瘤上皮细胞表达CBS和CSE,基质细胞同样表达CSE。人成骨肉瘤细胞株U⁃2 OS免疫组化染色显示CBS、CSE及MPST表达阳性(图1,表1)。
二、成骨肉瘤细胞中CBS、CSE、MPST基因蛋白表达水平
正常成骨细胞组织和成骨肉瘤细胞CBS,CSE 和MPST基因表达的蛋白水平不同,与正常成骨细胞组比较,肉瘤组细胞CBS、CSE、MPST蛋白含量明显增高,差异均有统计学意义(均P<0.05);其中成骨肉瘤细胞株U⁃2 OS表达水平最高,差异均有统计学意义(均P<0.05)(图2)。
三、H2S产生能力分析
正常成骨细胞仅产生少量H2S。与正常成骨细胞组比较,肉瘤组细胞H2S产率明显增高,差异均有统计学意义(均P<0.05);其中成骨肉瘤细胞株U⁃2 OS H2S产率最高,差异均有统计学意义(均P<0.05)(表2)。
表2 各细胞组织CBS、CSE、MPST蛋白定量和H2S产率测定
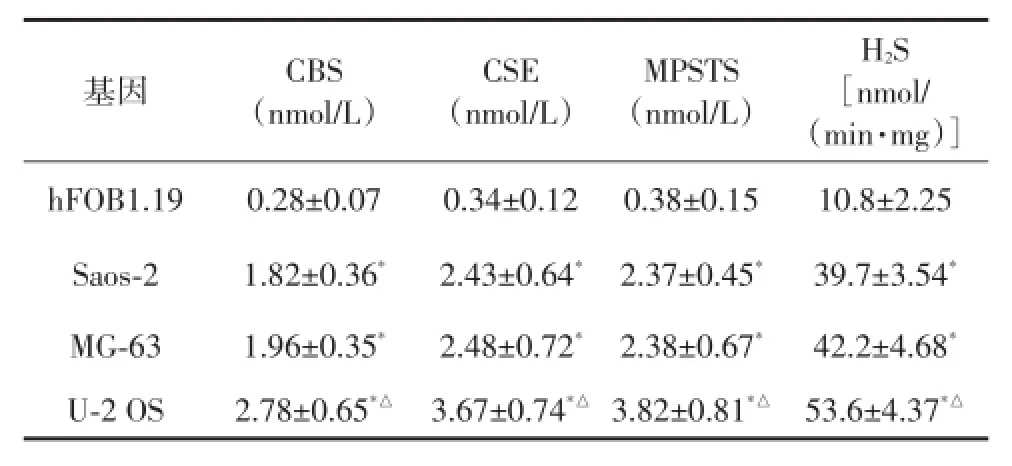
表2 各细胞组织CBS、CSE、MPST蛋白定量和H2S产率测定
注:与hFOB1.19相比,*P<0.05;与Saos⁃2、MG⁃63相比,△P<0.05
基因hFOB1.19 Saos⁃2 MG⁃63 U⁃2 OS CBS (nmol/L)0.28±0.07 1.82±0.36*1.96±0.35*2.78±0.65*△CSE (nmol/L)0.34±0.12 2.43±0.64*2.48±0.72*3.67±0.74*△MPSTS (nmol/L)0.38±0.15 2.37±0.45*2.38±0.67*3.82±0.81*△H2S [nmol/ (min·mg)]10.8±2.25 39.7±3.54*42.2±4.68*53.6±4.37*△
讨论
H2S作为人体内第三种气体信号分子,体内由CBS及CSE催化L⁃半胱氨酸而生成,大量研究表明一碳单位以及含巯基物质广泛参与含巯基物质代谢以及药物转化,而H2S合成途径位于一碳单位与转硫途径的关键位置,广泛参与⁃SH与⁃SS⁃的代谢循环。H2S具有促进血管新生的作用,肿瘤细胞通过促进CBS和CSE的合成而增加H2S的合成,最终促进肿瘤细胞的增殖,而有体外实验则表明H2S具有抑制肿瘤细胞增殖和侵袭及诱导凋亡等功能。基于这些证据,推测H2S可能与肉瘤的发病机制存在关联。本研究发现,同人正常成骨细胞hFOB1.19相比,H2S产生能力与其合成酶CBS、CSE和MPST在人恶性成骨肉瘤组织和细胞中高表达,而且在不同细胞系中表达不同,这提示H2S在恶性骨肉瘤发展过程中起着重要的作用。
H2S和其生物合成物质在人成骨肉瘤中的内源特性尚未有研究报道。H2S被认为是一种新的非肾上腺素能和非胆碱能三级气体信号转导分子,并且通过多重信号通路发挥作用,这与一氧化氮和一氧化碳作用机制不同,尽管它们或许存在交联,发挥协同或者拮抗作用[9]。越来越多的证据表明,H2S能激活细胞信号转导,诱导细胞增殖或凋亡甚至内质网应激反应[10]。更重要的是,H2S被证明能直接减少和清除ROS和RNS,而ROS和RNS与放化疗过程中的肿瘤形成和分子蛋白、DNA损伤相关[11,12]。
在心血管炎症和疾病中,H2S及其合成酶的表达和功能研究较为深入,目前已有报道将H2S及其合成酶作为可能的治疗靶点。那么外源性H2S在基于顺铂新的辅助化疗中的作用需要更进一步探索,确认是促进凋亡或者保护增殖。研究表明含巯基化合物能减轻顺铂诱导的氧化应激反应[13]。我们推测H2S不仅激活多条信号通路拯救细胞,并有可能直接去除顺铂毒性。最近有研究揭示H2S在增加谷胱甘肽(GSH)产量同时抑制氧化应激反应,这能够减轻许多药物和自由基的细胞毒性[14]。正如在许多顺铂耐药的肿瘤细胞[15]中观察到了谷胱甘肽的超表达,顺铂耐药机制可能归因于H2S的介入。
新型气体信号分子H2S的研究在国际上也尚处于起步阶段,在骨肉瘤方面更是空白,本实验意义重大,可能为骨肉瘤的发病机制及诊断治疗探索提供新的研究方向。
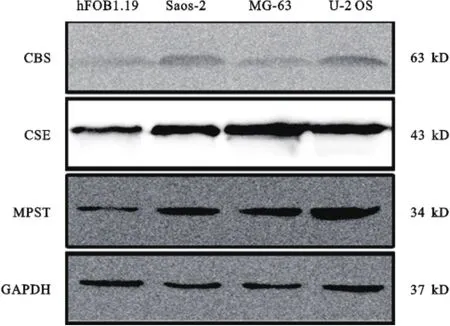
图2 解蛋白印迹结果表明CBS、CSE及MPST在正常骨细胞组织中表达水平较低,而在骨肉瘤细胞株Saos⁃2、MG⁃63和U⁃2 OS中表达为阳性或强阳性
[1]Kamoun P.Endogenous production of hydrogen sulfide in mam⁃mals[J].Amino Acids,2004,26(3):243⁃254.
[2]Kimura H.Hydrogen sulfide:its production and functions[J].Exp Physiol,2011,96(9):833⁃835.
[3]Wang R.Physiological implications of hydrogen sulfide:a whiff ex⁃ploration that blossomed[J].Physiol Rev,2012,92(2):791⁃896.
[4]Irie K,Ekuni D,Yamamoto T,et al.A single application of hydro⁃gen sulphide induces a transient osteoclast differentiation with RANKL expression in the rat model[J].Arch Oral Biol,2009,54 (8):723⁃729.
[5]Xu ZS,Wang XY,Xiao DM,et al.Hydrogen sulfide protects MC3T3⁃E1 osteoblastic cells against H2O2⁃induced oxidative dam⁃age⁃implications for the treatment of osteoporosis[J].Free Radic Biol Med,2011,50(10):1314⁃1323.
[6]Ishkitiev N,Calenic B,Aoyama I,et al.Hydrogen sulfide increases hepatic differentiation in tooth⁃pulp stem cells[J].J Breath Res,2012,6(1):017103.
[7]Janeway KA,Grier HE.Sequelae of osteosarcoma medical therapy:a review of rare acute toxicities and late effects[J].Lancet Oncol,2010,11(7):670⁃678.
[8]Burger H,Loos WJ,Eechoute K,et al.Drug transporters of plati⁃num⁃based anticancer agents and their clinical significance[J]. Drug Resist Updat,2011,14(1):22⁃34.
[9]Olson KR,Donald JA,Dombkowski RA,et al.Evolutionary and comparative aspects of nitric oxide,carbon monoxide and hydro⁃gen sulfide[J].Respir Physiol Neurobiol,2012,184(2):117⁃129.
[10]Gobbi G,Ricci F,Malinverno C,et al.Hydrogen sulfide impairs keratinocyte cell growth and adhesion inhibiting mitogen⁃activated protein kinase signaling[J].Lab Invest,2009,89(9):994⁃1006.
[11]Azad N,Iyer A,Vallyathan V,et al.Role of oxidative/nitrosative stress⁃mediated Bcl⁃2 regulation in apoptosis and malignant trans⁃formation[J].Ann N Y Acad Sci,2010,1203:1⁃6.
[12]Wang T,Wang L,Zaidi SR,et al.Hydrogen sulfide attenuates par⁃ticulate matter⁃induced human lung endothelial barrier disruption via combined reactive oxygen species scavenging and Akt activa⁃tion[J].Am J Respir Cell Mol Biol,2012,47(4):491⁃496.
[13]Moran LK,Gutteridge JM,Quinlan GJ.Thiols in cellular redox sig⁃nalling and control[J].Curr Med Chem,2001,8(7):763⁃772.
[14]Kimura Y,Goto Y,Kimura H.Hydrogen sulfide increases glutathi⁃one production and suppresses oxidative stress in mitochon⁃dria[J].Antioxid Redox Signal,2010,12(1):1⁃13.
[15]Biaglow JE,Miller RA.The thioredoxin reductase/thioredoxin sys⁃tem:novel redox targets for cancer therapy[J].Cancer Biol Ther,2005,4(1):6⁃13.
Expression of endogenous hydrogen sulfide and its synthases in human osteosarcoma cells.
HU Yang,QIN Wei,LIAN Kai,YAN Xiongwei,LU Xinyan.Department of Orthopaedics,Xiangyang Central Hospital,Affili⁃ated to Hubei University of Arts and Science,Xiangyang 441021,China
QIN Wei,E⁃mail:tanwhb123@163.com
ObjectiveTo investigate the expression levels of endogenous hydrogen sulfide(H2S)and its synthases cystathionine β⁃synthase(CBS),cystatbionine γ⁃lyase(CSE)and 3⁃mercaptopyruvate sulfurtrans⁃ferase(MPST)in osteosarcoma cells.MethodsFrom June 2013 to December 2014,immunohistochemistry and Western blotting were used to detect CBS,CSE and MPST mRNA and protein expression in hFOB1.19,Saos⁃2,MG⁃63 and U⁃2 OS cells,and H2S was determined in normal tissue samples and osteosarcoma cells.Re⁃sultsThere was a higher expression of CBS,CSE and MPST in osteosarcoma samples and cells.The osteosar⁃coma tissue and osteoblast⁃derived normal and malignant cell lines presented different protein levels of CBS,CSE and MPST,among which osteosarcoma cancer cells U⁃2 OS expressed highest.ConclusionH2S and its synthases CBS,CSE,and MPST exist in the human malignant osteoblastic tissues and cells.These findings im⁃ply that high levels of H2S and its biosynthesis may be a new target for osteosarcoma treatment.
Hydrogen sulfide;Osteosarcoma;Osteoblasts;Apoptosis
10.3969/j.issn.1674⁃8573.2016.02.011
湖北省自然科学基金(2011CDB318)
441021湖北襄阳,湖北文理学院附属医院(襄阳市中心医院)骨科
覃巍,E⁃mail:tanwhb123@163.com
(2015⁃06⁃25)