Notch2分子对慢性乙型肝炎患者CD8+T细胞功能的影响及意义
2016-08-15李彧连建奇张野王九萍魏欣张鸿曹宁家田颖白雪帆
李彧 连建奇 张野 王九萍 魏欣 张鸿 曹宁家 田颖 白雪帆
Notch2分子对慢性乙型肝炎患者CD8+T细胞功能的影响及意义
李彧连建奇张野王九萍魏欣张鸿曹宁家田颖白雪帆
目的观察慢性乙型肝炎患者外周血CD8+T细胞中Notch2分子的表达情况,并分析Notch2分子对CD8+T细胞功能的影响。方法选择30例慢性乙型肝炎患者和15名健康对照者,应用密度梯度离心法分离外周血单个核细胞,应用免疫磁珠法分离CD8+T细胞,应用反转录实时定量PCR法检测CD8+T细胞中Notch2 mRNA的表达水平。将分离的CD8+T细胞与HepG2.2.15细胞混合培养,并加入抗Notch2抗体,培养48 h后应用CCK-8法检测细胞增殖,应用ELISA法检测上清中IFN-γ、IL-2及TNF-α的表达水平。结果慢性乙型肝炎患者CD8+T细胞中Notch2 mRNA的表达水平明显升高,较健康对照者升高超过5倍。应用抗Notch2抗体抑制Notch2分子信号通路后,混合培养细胞的增殖水平(8.88±1.56)×105较同型对照组(4.47±1.13)×105和空白对照组(4.39±0.95)×105均明显升高,培养上清中的IFN-γ:3815±807 pg/mL和TNF-α:346.3±77.3 pg/mL的表达水平也较同型对照组IFN-γ:1316±484 pg/mL;TNF-α:139.8±40.1 pg/mL及空白对照IFN-γ:1383±604 pg/mL;TNF-α:124.0±45.5 pg/mL组显著升高,差异均具有统计学意义。结论HBV感染可能通过提高Notch2的表达抑制CD8+T细胞的杀伤功能,诱导机体免疫耐受,导致感染慢性化。
慢性乙型肝炎;Notch1;Notch2;CD8+T淋巴细胞
乙型肝炎严重威胁人类的生命健康。乙型肝炎病毒(HBV)是一种不直接引起细胞破坏的嗜肝DNA病毒,可以导致慢性肝炎、肝硬化乃至肝癌[1]。其肝脏损伤的机制主要是由机体免疫系统介导的,并依赖于病毒的不断复制。在急性自限性乙型肝炎患者体内可以发现多特异性的较高强度的CTL和Th细胞反应,而在慢性HBV感染者体内病毒特异性CTL和Th细胞存在数量和功能上的缺陷[2]。但有关乙型肝炎患者免疫功能及感染机体对抗HBV免疫应答的调控机制研究仍然较少。
Notch分子是一类高度保守的受体蛋白,广泛存在于细胞表面并介导细胞间信号传递。在哺乳动物中,Notch分子可以分为4个类型,即Notch1~Notch4[3]。Notch信号通路调控细胞增殖、分化和凋亡的功能涉及几乎所有的组织和器官,在免疫细胞分化和免疫调控方面也发挥重要作用。研究发现,抗原提呈细胞(APC)可以通过Notch信号通路调节CD4+T细胞的分化[4],而Notch2胞内活化基序(N2ICD)可与磷酸化的转录因子CREB1相互作用,联合转录共激活因子P300共同形成复合物,作用于粒酶B基因启动子区,促进粒酶B基因转录,从而增强CD8+T细胞的细胞毒性作用[5]。但目前尚未见有关Notch2信号在HBV感染中的研究报道。本研究主要检测了慢性乙型肝炎患者CD8+T细胞中Notch2分子的表达水平,并进一步分析Notch2对CD8+T细胞功能的影响。
资料和方法
一、主要试剂和仪器
淋巴细胞分离液为美国Sigma公司产品,CD8+T细胞分离试剂盒为美国美天旎公司产品,RNA提取试剂盒为德国Qiagen公司产品,反转录试剂盒为日本Takara公司产品,实时定量PCR试剂盒为日本Takara公司产品,抗Notch2多克隆抗体为英国Abcam公司产品,CCK-8试剂盒为美国Alexis公司产品,干扰素(IFN)-γ、白细胞介素(IL)-2、肿瘤坏死因子(TNF)-α ELISA检测试剂盒为美国eBioscience公司产品。PCR仪为美国Applied Biosystems公司的ABI 7500,分光光度仪为美国伯乐公司产品。日本Olympus生化分析仪进行肝功能检测,试剂为英国朗道公司产品。ELISA法检测乙型肝炎病毒血清标志物,试剂盒由上海科华试剂有限公司提供。荧光定量RT-PCR法检测血清HBV DNA,试剂盒由中山医科大学达安基因股份有限公司提供。
二、研究对象
慢性乙型肝炎患者30例均为陕西省人民医院感染性疾病科2012年5月至2013年1月的门诊患者,诊断标准均符合2010年发布的《慢性乙型肝炎防治指南》,并经ELISA检测HBsAg、抗HBs、HBeAg、抗HBe和抗HBc,实时定量PCR检测血清HBV DNA载量及肝功能检测和B超检查得以证实。入组患者从未接受过抗病毒治疗,并排除其他肝炎病毒感染及合并自身免疫性、酒精性肝病等疾病。另选15例年龄和性别配对的健康人作为研究对照。入组所有病例及对照均签署知情同意书。各组患者及健康对照入组时情况,见表1。

表1 慢性乙型肝炎患者及健康对照入组时一般情况
三、外周血单个核细胞(PBMCs)和CD8+T细胞的分离
应用EDTA抗凝管采集入组志愿者外周静脉血20 mL,2 h内应用密度梯度离心法分离PBMCs,分离后调整细胞浓度至107个/管冻存于液氮备用。应用CD8免疫磁珠(MACS)分选PBMC中的CD8+T细胞。取107个PBMC,300 g、4℃、离心5 min后弃上清,用80 μL缓冲液重悬细胞,向细胞悬液中加入20 μL CD8免疫磁珠,于4℃孵育50 min后用1 mL缓冲液洗涤,300 g、4℃、离心5 min后弃上清,用500 μL缓冲液重悬细胞。同时,用500μL缓冲液浸润MS分离柱,将分离柱固定于磁力分离架上,将上述细胞悬液加入分离柱中,用重力作用使细胞悬液通过分离柱,CD8+T细胞结合于分离柱中,未结合免疫磁珠的细胞则通过分离柱,用500 μL缓冲液洗涤分离柱3次,然后将分离柱从磁力分离架上取下,用1 mL缓冲液洗涤,将CD8+T细胞洗脱,并计数后进行下一步实验。
四、实时定量PCR
取1×105个CD8+T细胞,应用RNA提取试剂盒提取总RNA,并应用反转录试剂盒将RNA反转录为cDNA,实时定量PCR法检测Notch2分子的表达水平。Notch2的引物序列如下,上游引物:5’-GGC ATT AAT CGC TAC AGT TGT GTC T-3’;下游引物:5’-GGA GGC ACA CTC ATC AAT GTC A-3’。应用18S rRNA作为内参照,引物序列如下,上游引物:5’-CGC CGC TAG AGG TGA AAT TC-3’;下游引物:5’-TTG GCA AAT GCT TTC GCT C-3’。PCR反应条件为:95℃ 10 min 1个循环,95℃ 10 s,60℃ 34 s,共45个循环[6]。应用2-ΔΔCt法分析Notch2 mRNA的相对表达水平。
五、混合细胞培养
从入组的30例慢性乙型肝炎患者中选取11例患者,取2105个CD8+T细胞以RPMI 1640+10% FBS培养,同时加入HBV Core 18-27肽段(10 μg/mL)进行刺激3 d,然后将CD8+T细胞与HepG2.2.15细胞分别以1:6的比例进行混合培养,在混合培养室,试验组加入抗Notch2抗体,对照组加入同型对照的多克隆抗体IgG,空白对照组仅加入等量的培养液。混合培养48 h后,收集细胞及上清。
六、细胞增殖试验
在培养的最后4 h向培养板中加入20 μL的CCK-8溶液。将含有已知数量的PBMC进行倍比稀释,制作标准曲线。应用分光光度仪测量450 nm的吸光度。
七、ELISA检测
应用ELISA检测试剂盒对培养上清中的IFN-γ、IL-2和TNF-α进行检测。
八、统计学分析
数据采用SPSS 17.0进行分析。多组数据间比较采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
结 果
一、Notch2 mRNA在慢性乙型肝炎患者外周血CD8+T细胞中的表达升高
慢性乙型肝炎患者外周血CD8+T细胞中Notch2 mRNA的相对表达水平较健康对照者中明显升高,升高超过5倍,两者比较差异具有统计学意义(P=0.029,图1)。
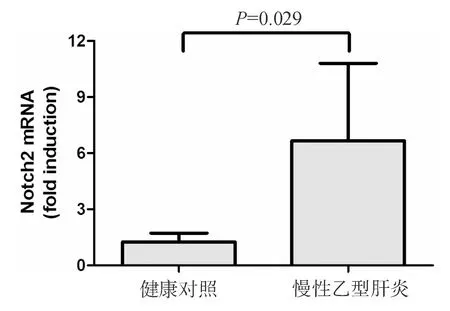
图1 健康对照和慢性乙型肝炎患者外周血CD8+T
二、抑制Notch2分子表达可促进细胞增殖
在混合细胞培养中分别加入抗Notch2抗体、同型对照抗体IgG和培养液,抗Notch2抗体可抑制Notch2分子的表达。如图2所示,同型对照抗体不影响混合培养细胞的增殖[细胞总数为:(4.47±1.13)×105],而加入抗Notch2抗体的混合培养细胞的增殖水平明显升高[细胞总数为:(8.88±1.56)×105],与同型对照组(P=0.0037)和空白对照组[细胞总数为:(4.39±0.95)×105,P=0.0026],比较差异均有统计学意义。
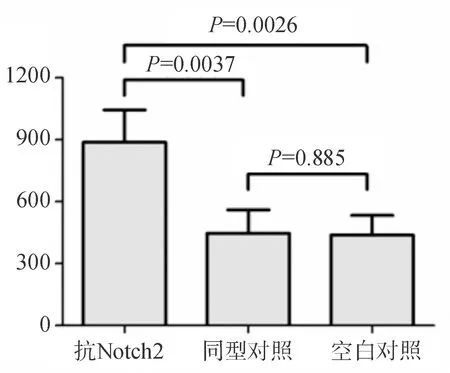
图2 抗Notch2抗体和同型对照抗体对混合培养细胞增殖的影响
三、抑制Notch2分子表达增加IFN-γ和TNF-α的表达
混合培养48 h后收集培养上清,应用ELISA法对培养上清中的IFN-γ、IL-2和TNF-α水平进行检测。在所有细胞培养上清中均未检测到IL-2的表达。如图3所示,抑制Notch2分子表达可明显增加IFN-γ(3815±807) pg/mL和TNF-α(346.3±77.3) pg/mL的表达,与同型对照抗体(IFN-γ:1316±484 pg/mL;TNF-α:139.8±40.1 pg/mL)和空白对照(IFN-γ:1383±604 pg/mL;TNF-α:124.0±45.5 pg/mL)组相比,差异均具有统计学意义。

图3 混合培养上清中IFN-γ(A)和TNF-α(B)的表达水平
讨 论
病毒感染细胞后,病毒抗原或病毒自身均可作为内源性抗原被抗原提呈细胞的MHC-I类分子提呈,主要激发机体T细胞免疫,尤其是CD8+T细胞的CTL功能的激活,是机体清除病毒的主力军。HBV感染亦是如此,CD8+T细胞介导的免疫应答在病毒清除中发挥着中枢作用[7]。而对于HBV感染慢性化的患者而言,机体CD8+T细胞免疫应答的低反应性是造成免疫耐受和免疫逃逸现象的重要原因。在急性自限性HBV感染者体内存在强烈的CD8+T细胞应答,机体可以高效清除病毒感染;而慢性乙型肝炎患者免疫水平底下,机体处于免疫耐受或免疫抑制状态,病毒特异性CD8+T细胞数量和应答水平下降,免疫功能降低甚至消失殆尽,无法清除HBV,导致持续慢性病毒感染[8-11]。但是,CD8+T细胞功能低下的确切机制尚未完全阐明。研究者们试图从高病毒载量和高抗原量导致特异性CD8+T 细胞数量和功能下降、树突状细胞功能低下、肝脏局部免疫耐受、调节性T细胞免疫抑制和免疫抑制分子等角度阐明此问题[11-13]。但现有的研究仍没有取得突破性进展。
Notch信号通路可以调节CD4+T细胞和CD8+T细胞的功能。同时,Notch信号通路也可直接调控肝细胞和肝血窦内皮细胞的生物学活性,在维持肝脏稳态和促进肝细胞再生过程中发挥重要作用[14]。因此,Notch信号通路在HBV感染免疫中也可能发挥重要作用。既往研究发现,HBV X蛋白可通过活化Notch信号通路促进肝细胞的增殖与分化[15]。Pei等[16]对Notch1在HBV中的作用进行了研究,Notch1在慢性乙型肝炎CD4+T细胞中的表达升高,但在急性乙型肝炎中的表达与健康对照者比较未见明显变化。阻断Notch1信号通路可以明显抑制Th2类细胞因子和GATA-3的表达,而Th1类细胞因子和T-bet的表达却显著升高。这提示在慢性乙型肝炎患者中,Notch1信号通路可通过调节转录因子T-bet和GATA-3的表达使Th1/Th2的免疫失衡,促进感染慢性化。而既往研究发现,在生理状态下,Notch2可增强CD8+T细胞的细胞杀伤功能[5]。但本研究发现,在HBV感染过程中,Notch2的表达较健康对照者明显升高,由于慢性乙型肝炎患者存在CD8+T细胞的功能低下,提示在慢性HBV感染过程中Notch2可能抑制CD8+T细胞的功能。进一步应用抗Notch2抗体阻断Notch2信号通路,观察阻断Notch2信号通路对CD8+T细胞功能的影响。研究发现,阻断Notch2信号通路可显著促进培养细胞的增殖,增加细胞因子的分泌。这进一步证实了在HBV感染过程中,Notch2对CD8+T细胞存在负性调控作用。但由于本研究标本数量偏少,且均为体外实验,还需扩大样本及应用HBV转基因小鼠模型进行体内试验进一步证明本结论。
总之,慢性HBV感染可能通过提高Notch2的表达水平进而抑制CD8+T细胞的功能,从而诱导机体的免疫耐受,促进感染慢性化。Notch2也可能作为抗HBV治疗新的靶点,为抗病毒治疗和打破免疫耐受提供新的思路。
[1]Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology, 2001,34:1225-1241.
[2]Chang JJ, Lewin SR. Immunopathogenesis of hepatitis B virus infection. Immunol Cell Biol, 2007,85:16-23.
[3]Weinmaster G, Roberts VJ, Lemke G. Notch2: a second mammalian Notch gene. Development, 1992,116:931-941.
[4]Amsen D, Blander JM, Lee GR, et al. Instruction of distinct CD4 T helper cell fates by different notch ligands on antigen-presenting cells. Cell, 2004,117:515-526.
[5]Maekawa Y, Minato Y, Ishifune C, et al. Notch2 integrates signaling by the transcription factors RBP-J and CREB1 to promote T cell cytotoxicity. Nat Immunol, 2008,9:1140-1147.
[6]Chu D, Zheng J, Wang W, et al. Notch2 expression is decreased in colorectal cancer and related to tumor differentiation status. Ann Surg Oncol, 2009,16:3259-3266.
[7]Guidotti LG, Chisari FV. Immunobiology and pathogenesis of viral hepatitis. Annu Rev Pathol, 2006,1:23-61.
[8]Hoofnagle JH, Doo E, Liang TJ, et al. Management of hepatitis B: summary of a clinical research workshop. Hepatology, 2007,45:1056-1075.
[9]Bertoletti A, Gehring AJ. The immune response during hepatitis B virus infection. J Gen Virol, 2006,87:1439-1449.
[10]Bertoletti A, Maini MK. Protection or damage: a dual role for the virus-specific cytotoxic T lymphocyte response in hepatitis B and C infection. Curr Opin Microbiol, 2000,3:387-392.
[11]Rehermann B, Fowler P, Sidney J, et al. The cytotoxic T lymphocyte response to multiple hepatitis B virus polymerase epitopes during and after acute viral hepatitis. J Exp Med, 1995,181:1047-1058.
[12]Zhang Y, Lian JQ, Huang CX, et al. Overexpression of Toll-like receptor 2/4 on monocytes modulates the activities of CD4(+)CD25(+) regulatory T cells in chronic hepatitis B virus infection. Virology, 2010,397:34-42.
[13]Nan XP, Zhang Y, Yu HT, et al. Circulating CD4+CD25high regulatory T cells and expression of PD-1 and BTLA on CD4+ T cells in patients with chronic hepatitis B virus infection. Viral Immunol, 2010,23:63-70.
[14]Wang L, Wang CM, Hou LH, et al. Disruption of the transcription factor recombination signal-binding protein-Jkappa (RBP-J) leads to veno-occlusive disease and interfered liver regeneration in mice. Hepatology, 2009,49:268-277.
[15]Wang F, Zhou H, Xia X, et al. Activated Notch signaling is required for hepatitis B virus X protein to promote proliferation and survival of human hepatic cells. Cancer Lett, 2010,298:64-73.
[16]Pei J, Tang Z, Zang G, et al. Blockage of Notch1 signaling modulates the T-helper (Th)1/Th2 cell balance in chronic hepatitis B patients. Hepatol Res, 2010,40:799-805.
(本文编辑:易玲)
2015-03-24)
陕西省自然科学基金资助项目(编号:2013JQ4013)
710054陕西西安陕西省人民医院感染性疾病科 (李彧、张鸿、曹宁家);第四军医大学唐都医院感染科(白雪帆、连建奇、张野、魏欣);第四军医大学西京医院感染科(王九萍);陕西省中医医院妇科(田颖)
白雪帆,Email:xfbai2011@163.com
