血小板线粒体调节肺毛细血管屏障功能的实验研究
2016-08-12唐昊祁海峰王耀丽杨雪飞李鹏飞雷洋张鹏周健
唐昊 祁海峰 王耀丽 杨雪飞 李鹏飞 雷洋 张鹏 周健
血小板线粒体调节肺毛细血管屏障功能的实验研究
唐昊祁海峰王耀丽杨雪飞李鹏飞雷洋张鹏周健
400042 重庆, 第三军医大学大坪医院重症医学科
【摘要】目的探讨血小板线粒体对肺损伤(ALI)时肺毛细血管通透性的调节作用。方法建立盐酸(pH 1.2, 1.5 ml/kg)诱发的急性肺损伤动物模型,通过肺毛细血管滤过系数、流式细胞仪检测、共聚焦显微镜方法,观察血小板线粒体对盐酸致急性肺损伤形成中肺毛细血管屏障功能的影响。结果与正常组比较,盐酸致肺损伤模型中肺毛细血管滤过系数增高2.5倍(n=4,P<0.05),灭活血小板线粒体后,肺毛细血管滤过系数增高5倍(n=4,P<0.05)。流式细胞仪分析血小板线粒体转移到白细胞中;共聚焦显微镜发现,血小板与中性粒细胞相互作用促进肺损伤。结论抑制血小板线粒体功能增加盐酸诱导的肺损伤,肺血管内皮屏障依赖于血小板线粒体的功能,线粒体从血小板传递给白细胞可导致增加白细胞粘附到损伤的微血管内皮。
【关键词】急性肺损伤;血小板;肺微血管屏障功能;线粒体
急性肺损伤(acute lung injury, ALI)和/或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是重症医学科临床常见的疾病[1-3]。ARDS的临床特征为难治性低氧血症和进行性呼吸窘迫,其主要病理变化为肺不张、形成透明膜、肺水肿,以通透性增强、肺毛细血管弥漫性损伤为基础。据国内外临床医学统计,其病死率在50%以上,该病预后极差、发展迅猛、起病急骤[4-6]。近年研究发现,血小板与ARDS的发病密切相关[7-12]。一方面,ARDS促进血小板的活化,ARDS时,血小板在数量、结构、功能、生化等方面都会发生改变;另一方面,血小板促进ARDS的发病过程,ARDS时,活化的血小板沉积在受损的肺微血管系统内,有助于引发和加剧肺泡损伤;血小板与白细胞、内皮细胞、细胞因子相互作用促进ARDS的发病,也可通过多种信号转导途径促进ARDS的发病。为此,我们对血小板线粒体在盐酸致肺损伤模型中调节肺毛细血管通透性的作用进行实验研究,旨在为探讨ALI中血小板和内皮细胞、中性粒细胞的相互作用提供理论依据和实验基础。
材料与方法
一、实验材料
选择健康清洁级雄性小鼠(8~12 周龄,C57BL/6,体质量 20~25 g,由哥伦比亚医学实验动物中心提供),CD41、CD45和VE-钙黏素等免疫荧光抗体均购自重庆赛奥生物生物技术有限公司;大鼠抗小鼠的CD144 (VE-cadherin)抗体,大鼠抗小鼠的CD41-FITC, 大鼠抗小鼠的CD45 PE抗体均购自eBioscience公司, 肺毛细血管滤过系数测定实验仪器和软件,共聚焦显微镜仪器和分析软件,由哥伦比亚医学中心Jahar实验室提供。
二、实验动物分组
用完全随机方法将实验动物小鼠60只分为两组,每组30只。①生理盐水对照组(control group);②盐酸诱发ALI组(acid-induced acute lung injury group)。小鼠用戊巴比妥钠腹腔麻醉,然后用 1 mol/L HCl(2 μl/g, pH=1.5)经鼻滴入气管内复制动物模型,于灌注后第 2 h处死,留取血清,右肺组织用 10%福尔马林溶液固定,石蜡包埋,左肺于-80 ℃液氮中保存备用。用免疫组化法测定肺组织中纤维蛋白含量,通过病理切片HE染色及天狼星红染色观察肺组织胶原纤维沉积情况;用离体肺进行体外肺毛细血管滤过系数的测定及共聚焦显微镜观察。
三、检测指标与方法
参照文献[10-11]报道的方法,建立了离体血液灌注鼠肺的准备,保持肺动脉压、左心房压、气道压力分别在12, 3和5 cmH2O,以恒定的血流量(0.5 ml/min),流量(0.5 ml/min,37 ℃);灌输生理盐水或盐酸至气管内,获得过滤系数后1 h,利用小鼠离体肺灌流模型,采用肺重量分析法测定肺毛细血管滤过系数 (Kf); 用EDT法,4 ℃条件下,新鲜分离肺微血管内细胞,免疫染色后,应用流式细胞仪进行检测和分析,进一步封片用激光共聚焦显微镜观察蛋白CD41、CD45和VE-钙黏素等的表达;用 EDT法,4 ℃条件下,分离肺微血管内皮细胞,进一步用抗体 IκBα、TF、vWF、VE-钙黏素和 P-选择素免疫荧光染色,应用流式细胞仪进行检测和分析不同抗体在不同细胞上的表达,封片并用适时激光共聚焦显微镜观察其在细胞中的表达及定位。
四、统计学方法
结 果
一、血小板灌注对肺微血管滤过系数的影响
正常对照组基线Kf是0.22±0.04 ml/(cmH2O·min·100 g wet lung weight)。盐酸滴注气道后,Kf是对照组的2.5倍,说明微血管损伤。鱼藤酮治疗的血小板组Kf升幅5倍,而未经处理的血小板组,Kf升幅2.5倍。鱼藤酮治疗血小板增加肺损伤。由此,抑制血小板线粒体功能会增加肺微血管滤过系数,见图1。
二、鱼藤酮对血小板聚集和体外血小板线粒体转移的影响
为了探讨血小板转移线粒体的可能性,确定了血小板特异性蛋白作为标志物,CD41和线粒体黛(绿色)。我们标记分离的细胞为血小板用CD41(α2B,Ⅱb / Ⅲa受体复合物),血小板线粒体黛绿色,在控制血小板数量的条件下,对照组血小板表达CD41和MTG的数量少,鱼藤酮提高血小板表达CD41和MTG的数量,表明血小板线粒体被转移到其他的血小板。流式细胞技术检测显示,线粒体从对鱼藤酮中毒血小板朝着健康的血小板迁移,见图2。


图2 鱼藤酮对血小板聚集和体外血小板线粒体转移的影响
三、线粒体从血小板转移到白细胞
盐酸诱导肺微血管的适时肺成像,肺微血管被灌注入红色荧光钙黄绿素红(5 μM,20 min,蓝),血小板表达DsRed的(红)和白细胞表达钙黄绿素绿(绿色)。共聚焦显微镜呈像表示血小板白细胞共定位。从血小板线粒体转移到白细胞导致增加白细胞粘附到受伤的肺微血管。红色和绿色荧光的共定位是由黄色在微血管白细胞呈现的,见图3。
讨 论
研究证明,线粒体从血小板转移到白细胞导致白细胞黏附到受损微血管的数量增加,抑制血小板线粒体电子传递可使肺微血管渗透性增加。在盐酸引起的肺损伤模型实验中,血小板可促进肺泡毛细血管内膜损伤,造成渗透性肺水肿。通过本实验,推测激活的血小板介导的ALI可能通过包括聚合、 介质的释放,以及内皮细胞的信号传导,并与多形核白细胞和单核细胞,共同引发或扩增了炎性损伤的相互作用的机制,这种相互作用可能是基于血小板线粒体的功能。线粒体不仅是必需的,而且在大多数的细胞中作为供能以稳定内环境。该细胞器还通过产生活性氧调节胞内的信号,并通过细胞色素C的释放引发细胞凋亡。在小鼠盐酸引起的肺损伤模型中,与对照组相比,线粒体从血小板转移到白细胞导致白细胞黏附于微血管的数量增加,从而导致肺损伤。
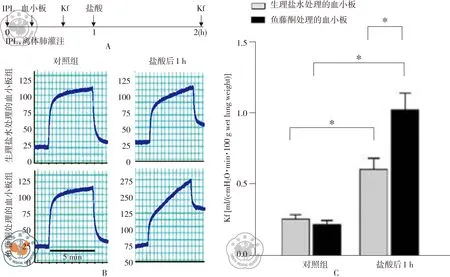
图1抑制血小板线粒体功能增加肺微血管滤过系数

图3鱼藤酮对血小板聚集和体外血小板线粒体转移的影响
这些发现证实了急性肺损伤相关的血管功能障碍机制,血小板可增强内皮细胞促凝血蛋白表达,可能原因是酸性损伤增加了CD45片段的VE-钙黏附分子上血小板蛋白CD41和CD42b的表达,指示血小板蛋白转移到内皮。蛋白表达的原因是因为细胞上的游离血小板来源的蛋白增强了内皮促凝血反应[13-18]。肺的炎症损伤通过内皮表面血小板衍生蛋白的沉积引起促凝血表型在肺部的表达。本研究同时支持一个新的关于组织因子(tissue factor, TF)出现在内皮表面的机制[4]。对于TF大多数的理解来源于体循环,主要是基于TF通过纤维母细胞,血管平滑肌细胞和周细胞表达。病理状态下,例如脓毒症,TF可在单核细胞和人血小板中表达[8-10]。酸性物质损伤内皮表面表达的TF可能不是来源于血管平滑肌,而完全来源于血小板。内皮表达的CD41和CD42b的酸性损伤证实来源于血小板的蛋白具有体外活性[9],这种变化的发生是内皮游离血小板持续黏附和脱离的结果。此外,这些血小板表达中对酸性损伤的增强是血小板内皮通过肺血管表面与构成VE钙黏蛋白在肺血管表面广泛的区域相互作用的证据[11-12]。既然活化的血小板释放了CD41+和CD42b+微粒,很可能血小板微粒在蛋白转移中发挥了作用。在最小程度上,白细胞也有助于TF在内皮细胞上的表达。肺损伤时,内皮血小板决定血管内皮的促炎-抗凝表型的形成。肺损伤中血小板的作用大多数认为对白细胞起激活作用[9-13]。
本研究结果显示,线粒体从血小板转移到白细胞。循环中的血小板含有少数具有完整功能的线粒体。越来越多的证据显示,这些线粒体不仅通过产生能量而且通过氧化还原反应和细胞凋亡的启动,调节血小板形成血栓的功能[2,4,10]。除了止血的调节,传统认为血小板的作用可作为识别和研究人类线粒体功能障碍性疾病,因为与其他代谢活跃的组织相比血小板容易获取。生理状态下,血小板通过循环接近内皮,但是血液流动以及抗凝物质可防止血小板黏附形成血栓。然而当血管损伤时,血小板开始通过快速以及复杂的信号通路,加快三级放大的凝血反应[4, 7-9]。第一步,血小板通过特殊的表面受体相互作用与暴露的内皮下因子(例如von Willebrand 因子、胶原蛋白、血小板反应蛋白和层连蛋白)一起黏附至受损的内皮;第二步,血小板的聚合,主要通过血小板表面的G蛋白耦联受体捆绑的ADP和凝血酶调节,从而启动了细胞的一系列信号放大反应。这些信号级联反应,包括磷脂酶C的抑制,磷脂酰肌醇三激酶的活化,主要引起血小板的变形以及其他血小板的活化和黏附。最后第三步,血小板释放包括来自血小板颗粒的ADP在内的可溶性因子和表达性炎症介质。此外表面糖蛋白Iib/IIIa的表达增加了血小板的间接聚合,最后形成血栓[1,3]。
线粒体从血小板转移到白细胞为一种新的ALI/ARDS的调节途径,血小板的激活和聚集在急性呼吸窘迫综合征发病中起着重要的作用,血小板与内皮细胞相互作用促进肺损伤,研究结果表明,线粒体与血小板活化和凋亡的调节相关[15-16]。越来越多的证据表明血小板活化增强、线粒体超极化和ROS产生,均参与肺损伤。许多研究表明,血小板数量减少及血小板功能受损,同样会引起不同程度的肺损伤[17-19]。已有研究表明,线粒体从骨髓基质干细胞转移至肺泡上皮细胞,可增加肺泡的ATP,从而起到保护肺的作用[11]。
综上所述,血小板不仅在血栓形成中起作用,同样在炎症的发生发展中起着重要作用,血小板活化、内皮损伤和纤维蛋白原之间相互作用参与了ARDS过程,而且可能是主要的致病因素之一。血小板与ARDS发病的关系十分复杂。在ARDS时,血小板本身既是受损靶细胞,又可通过自身结构和功能的改变加速ARDS的进程。有针对性的进行抗血小板治疗,有望改变ALI/ARDS的自然病程。
参考文献
1范晓枝, 刘宏. 血小板在急性呼吸窘迫综合征发病中的作用[J]. 国外医学医学地理分册, 2015, 36(2): 142-147.
2槐永军, 张绍敏, 马壮, 等. 急性呼吸窘迫综合征预后的影响因素探讨[J]. 临床军医杂志, 2010, 38(6): 943-945.
3中华医学会重症医学分会. 急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)[J]. 中华急诊医学杂志, 2007, 16(4): 343-349.
4钱桂生. 急性肺损伤和急性呼吸窘迫综合征的诊断与治疗[J]. 解放军医学杂志, 2009, 46(4): 121-126.
5金发光. 急性肺损伤的诊治研究现状及进展[J/CD]. 中华肺部疾病杂志:电子版, 2013, 6(1): 1-3.
6施卉, 任成山. 急性肺损伤/急性呼吸窘迫综合征基础及临床研究进展[J/CD]. 中华肺部疾病杂志, 2013, 6(4):350-355.
7Swerdlow RH. Role and treatment of mitochondrial DNA-related mitochondrial dysfunction in sporadic neurodegenerative diseases[J]. Curr Pharm Des, 2011, 7(31): 3356-3373.
8Agnati LF, Guidolin D, Baluska F, et al. A new hypothesis of pathogenesis based on the divorce between mitochondria and their host cells: possible relevance for Alzheimer′s disease[J]. Curr Alzheimer Res, 2010, 7(4): 307-322.
9Safdar Z, Yiming M, Grunig G, et al. Inhibition of acid-induced lung injury by hyperosmolar sucrose in rats[J]. Am J Respir Crit Care Med, 2005, 172(8): 1002-1007.
10Emin MT, Sun L, Huertas A, et al. Platelets induce endothelial tissue factor expression in a mouse model of acid-induced lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(11): L1209-L1220.
11Islam MN, Das SR, Emin MT, et al. Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury[J]. Nat Med, 2012, 18(5): 759-765.
12Zharikov S, Shiva S. Platelet mitochondrial function: from regulation of thrombosis to biomarker of disease[J]. Biochem Soc Trans, 2013, 41(1): 118-123.
13Risitano A, Beaulieu LM, Vitseva O, et al. Platelets and platelet-like sect1icles mediate intercellular RNA transfer[J]. Blood, 2012, 119(26): 6288-6295.
14陈波. 不同转归重症肺炎患儿血小板动态变化情况分析及意义[J]. 中国卫生标准管理, 2015, 17 (6) : 146-148.
15李妮妮, 陈威成, 芮蕾, 等. 负荷量氯吡格雷对脓毒症血小板聚集和急性肺损伤影响的实验研究[J]. 广西医学, 2014, 36(2): 151-153.
16Brus F, Van Oeveren W, Okken A, et at. Number and activation of circulating polymorphonuclear leukocytes and platelets are associated with neonatal respiratory distress syndrome severity[J]. Pediatrics, 1997, 99(5): 672-680.
17杨默, 杨杰, 桂霞, 等. 新生儿肺损伤可能导致血小板减少[J]. 中华儿科杂志, 2001, 39 (3): 189-191.
18赵初环, 林洁, 钱红兰, 等. 体外循环对血小板的影响及其与术后急性肺损伤的关系[J] . 药物研究, 2011, 20 (12): 23-24.
19Dixon JT, Gozal E, Roberts AM. Platelet-mediated vascular dysfunction during acute lung injury[J]. Arch Physiol Biochem, 2012, 118(2): 72-82.
(本文编辑:黄红稷)
唐昊,祁海峰,王耀丽,等. 血小板线粒体调节肺毛细血管屏障功能的实验研究[J/CD]. 中华肺部疾病杂志: 电子版, 2016, 9(3): 258-262.
DOI:10.3877/cma.j.issn.1674-6902.2016.03.005
基金项目:国家自然科学基金青年资助项目(81200057)
通讯作者:王耀丽,Email: wangylchen2005@aliyun.com
中图法分类号:R563.1
文献标识码:A
Corresponding author:Wang Yaoli, Email: wangylchen2005@aliyun.com
(收稿日期:2016-01-21)
Platelet mitochondria modulate lung microvascular barrier function in acid-induced lung injury
TangHao,QiHaifeng,WangYaoli,YangXuefei,LiPengfei,LeiYang,ZhangPeng,ZhouJian.Desect1mentofCriticalCareMedicine,DapingHospital,ResearchInstituteofSurgery,theThirdMilitaryMedicalUniversity,Chongqing, 400042,China
【Abstract】ObjectiveTo determine the role of platelet mitochondria in lung microvascular barrier regulation in the mouse model of acid-induced acute lung injury(ALI). MethodsTo induce ALI, HCl (pH 1.2, 1.5 ml/kg) was used in the isolated mouse lungs by airway instillation. After 1 h, it was determined the microvascular filtration coefficient (Kf) to quantify lung microvascular barrier properties. pulmonary vascular cells were isolated for flow cytometry and confocal microscopy to detect the role of platelet mitochondria in lung microvascular barrier regulation in the mouse model of acid-induced ALI. ResultsAcid instillation increased Kf 2.5-fold above baseline (n=4, P<0.05), indicating that acid instillation caused major microvascular injury. In isolated mouse lung perfused with rotenone-treated platelets, acid instillation increased Kf 5-fold above baseline (n=4, P<0.05). The presence of platelet mitochondria in the leukocyte was evident optically, as well as by the flow cytometry and confocal microscopy. ConclusionsInhibiting platelet mitochondrial function increases lung injury in the acid-aspiration model of ALI. Lung endothelial barrier protection depends on functioning platelet mitochondria. The mitochondrial transfer from platelet to leukocyte resulted in increased leukocyte adhesion to injuried microvessel.
【Key words】Acute lung injury;Platelet;Lung microvascular barrier function;Mitochondria
