克罗诺杆菌生物学特性及其婴幼儿食品中控制措施研究进展
2016-08-01林学海龚金炎王伟军魏培莲肖功年尤玉如
林学海,龚金炎,王伟军,魏培莲,肖功年,尤玉如
(1.浙江科技学院生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,杭州310023;2.贝因美婴童食品股份有限公司,杭州311106)
克罗诺杆菌生物学特性及其婴幼儿食品中控制措施研究进展
林学海1,龚金炎1,王伟军2,魏培莲1,肖功年1,尤玉如1
(1.浙江科技学院生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,杭州310023;2.贝因美婴童食品股份有限公司,杭州311106)
通过阐述克罗诺杆菌(阪崎肠杆菌)生物学分类和耐受性讨论了其生物学特性,论述了生物膜的形成与其生物学特性的相关性,通过阐述自然宿主、食品加工环境和流行病学,着重分析了其污染源与污染途径。针对克罗诺杆菌的污染特征,探讨了以在线监测系统为主导的加工环境控制措施的重要性,以及利用益生菌和益生元抑制其生长的机理和作用效果。
克罗诺杆菌;生物膜;污染源;控制措施
0 引言
克罗诺杆菌(原阪崎肠杆菌)是一种兼性厌氧的革兰氏阴性肠杆菌[1],在光学显微镜下其菌体形态粗短、无芽孢,能寄生于人和动物肠道内,同时对培养要求不高[2],在自然界中广泛存在。克罗诺杆菌作为食源性条件致病菌,虽然对健康成人无较大影响,却容易引起早产儿、低体重儿、免疫力低下儿的侵袭性感染。通常婴幼儿感染克罗诺杆菌的临床表现为新生儿脑膜炎、坏死性小肠结肠炎和菌血症,严重时能导致机体死亡,且死亡率高达50%~80%[3],即使治愈,也容易造成神经系统性后遗症。婴幼儿食品作为婴幼儿最主要食物,在该菌的传播与感染环节中居于重要位置,中国国家标准要求婴幼儿食品中不得检出该菌,因此乳粉生产企业十分重视该菌的监控分析与控制技术研究。
1 克罗诺杆菌污染状况调查
近10年来,我国有关克罗诺杆菌婴幼儿食品污染事件时有发生,针对婴幼儿食品的污染状况调查研究也一直在积极的开展,表1总结了近10年以来的针对该菌的调查结果。
根据表1可知,我国10年内克罗诺杆菌污染婴幼儿食品时有发生,在所有的监测研究中均有检出,检出率在0.56%~21.62%之间,统计均值为11.54%,说明我国对克罗诺杆菌的研究与控制还远远不能满足实际生产的需要。为此论文在讨论了克罗诺杆菌生物学特性的基础上,通过阐述自然宿主、食品加工环境和流行病学,着重分析了其污染源与污染途径,以期探索出针对婴幼儿食品靶向选择有效、安全和生产在线的克罗诺杆菌控制措施,为婴幼儿食品提供安全保障。
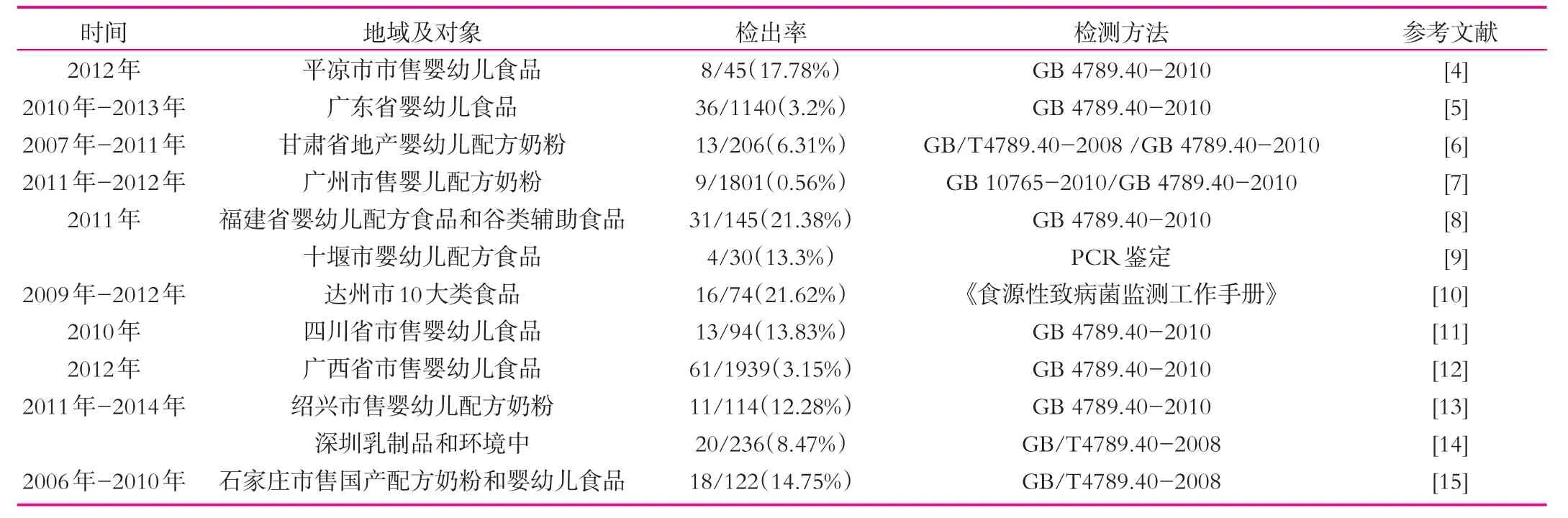
表1 我国各地克罗诺杆菌婴幼儿食品污染情况
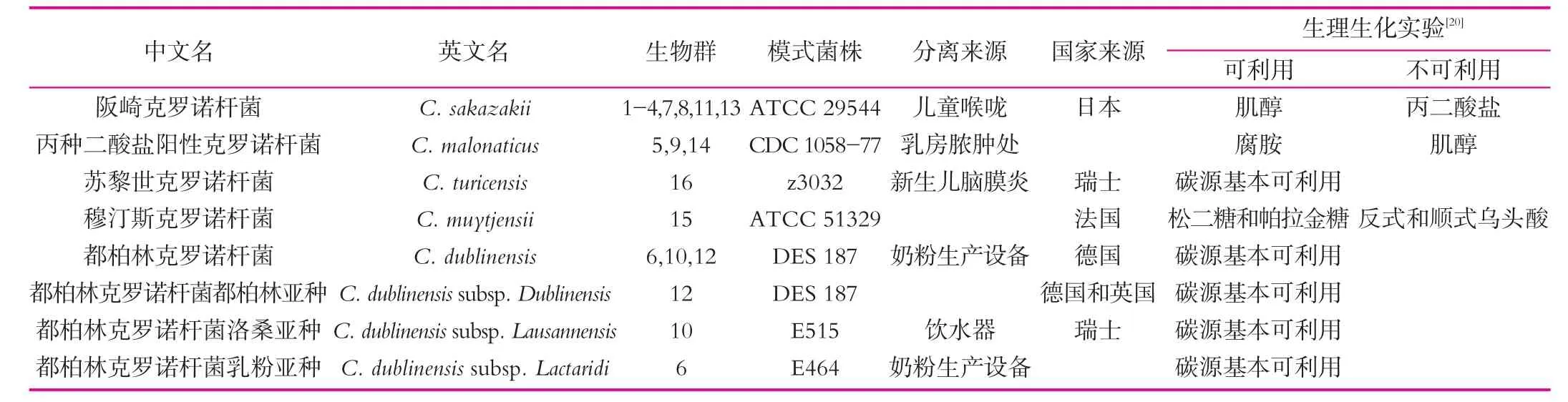
表2 克罗诺杆菌属内分类
2 克罗诺杆菌生物学特性
虽然对克罗诺杆菌的了解和研究已经长达50年之久,但对于克罗诺杆菌生物学特性研究目前仍不够清晰,尚不足以为克罗诺杆菌污染源与污染途径的分析及其控制措施的选择提供完善与系统的理论支持。为此本文首先对克罗诺杆菌生物学分类和耐受性等生物学特性进行了讨论。
2.1 生物学分类
1980年,Farmer等[16]将产黄色素的疑似阴沟肠杆菌(Enterobacter cloacae)更名为阪崎肠杆菌(E.Sakazakii),由15个生物群组成,到2006年,Iversen等[17]发现了第16个生物群。2008年,Iversen等[18]根据16S RNA基因序列、核糖体分型、荧光扩增片段长度多态性和DNA-DNA杂交实验,提议将阪崎肠杆菌生物群重新进行系统学分类,成为肠杆菌科1个新属,即克罗诺杆菌属(Cronobacter spp.),属内包括5个种和3个亚种,其中阪崎克罗诺杆菌(C.sakazakii,以细菌学家Riichi Sakazaki命名)是该属模式菌种,为临床感染病例中最常见的条件致病菌,见表2。2012年,Joseph等[19]将康帝蒙提克罗诺杆菌(C.condimenti)和尤尼沃斯克罗诺杆菌(C.universalis)新增到克罗诺杆菌属中,使其增加到7个种。
2.2 耐受性
克罗诺杆菌作为危害性肠杆菌,可在多种胁迫环境中生存,主要与其耐受性相关,特别是耐干燥性和渗透压性。克罗诺杆菌的耐受性在相关文章中已经报道,尤其在25℃或45℃的环境下比其他肠杆菌更具耐受性[21],能在水分活度只有0.2的婴幼儿奶粉中存活2年,这也就解释了为何婴幼儿奶粉可能成为克罗诺杆菌污染与传播的途径,需重点加以控制的原因。2003年,Breeuwer等[22]报道克罗诺杆菌的耐受性与生物膜(Biofilm)中的海藻糖密切相关,大量海藻糖可维持细胞渗透压稳定,保护生物膜中的微生物抵抗各种胁迫环境。Aparna和Sarita[23]发现微生物在生物和非生物表面都可形成生物膜,通过生物膜形成水通道,而生物膜中的成分可作为其营养来源,从而增强克罗诺杆菌在胁迫环境中的生存能力。
生物膜是微生物附着于生物或非生物表面,分泌黏性胞外基质(Extracellular Polymeric Substances,EPS)将其自身包裹其中,为适应环境而形成的高度组织化、自由化微菌落膜性聚集物。一般而言,微生物附着于物体表面后,逐渐形成菌群,随后依附环境条件形成生物膜,到一定阶段后将会有微生物从成熟的生物膜中释放出,不同种类的微生物形成的生物膜各不相同。生物膜的形成受到各种环境条件以及微生物间信号分子传递,如群体感应系统、寡类分子和环二鸟苷酸等共同影响。
Iversen等[24]研究克罗诺杆菌在婴幼儿配方奶粉中的生物膜形成时发现,生物膜可使其黏附在乳胶、聚碳酸酯、硅胶和不锈钢管表面,作为粘附的物质基础和防御屏障,可有效保护其抵抗抗菌剂、营养、温度和流体剪切力等多种胁迫环境,增强耐受性。Lehner等[25]总结可能提高克罗诺杆菌耐受性的4个因素:(1)可黏附在亲水性或疏水性物质表面;(2)EPS的产生;(3)生物膜的形成及EPS中海藻糖的存在;(4)具有产生微生物间信号分子的能力。生物膜的形成与其生理性和耐受性等生物学特性有很大相关性,直接影响了克罗诺杆菌存活的可能性。为此,深入研究生物膜可大大促进克罗诺杆菌的研究与控制。
3 污染源与污染途径
研究克罗诺杆菌的污染源与污染途径可更加深入了解和掌握其习性,对于防止及控制其污染具有主导性意义,然而,迄今为止尚不能确定其污染源与污染途径。本文通过阐述自然宿主、食品加工环境和流行病学分析其污染源与污染途径。
3.1 自然宿主
自然宿主是克罗诺杆菌重要的生存栖息地,研究其自然宿主有助于了解其污染源与污染途径,但至今为止尚不能确定其自然宿主。
有研究分别从健康马的鼻孔[26]和螨虫的内脏[27]中分离出了克罗诺杆菌,也有研究从蟑螂[28]、甲壳虫[29]和厩螫蝇[30]等昆虫的内脏中分离出了该菌,目前,普遍认为昆虫是其重要的自然宿主。2012年Monica等[31]从苍蝇的内脏中分离出了克罗诺杆菌,分离率为14%,主要为C.sakazakii、C.turicensis和C.universalis。2015年,Monica等[32]再次从苍蝇的内脏中分离出了克罗诺杆菌,分离率为19%。此外,Monica等[33]从携带克罗诺杆菌的苍蝇产下的卵中也分离出了该菌,表明苍蝇可将其传播给后代的可能性。研究克罗诺杆菌与昆虫之间的生态关联性将有助于更加深入了解其传播途径,减缓传播污染。
Jaradat等[34]和Niharika等[35]相继对克罗诺杆菌的自然宿主进行了大规模系统的研究,结果见表3。

表3 克罗诺杆菌自然宿主研究[34-35]
两次调查结果显示婴幼儿配方奶粉均有一定的分离率,但均较低,而香草和香料样品分离率却是最高。2009年,Schmid等[36]从土豆和玉米等植物根部分离出了克罗诺杆菌,均具有致病性,研究发现植物根部具有其生存的条件,如矿物质的溶解,吲哚乙酸的产生以及含铁细胞的增殖,这些均可增加植物成为其自然宿主的可能性。
3.2 食品加工环境
近年来,已从加工食品中分离出克罗诺杆菌,如乳制品、干制肉品、水和米等,取样环境也各有不同,如家庭环境、牲畜工具、食品加工设备,尤其是婴幼儿食品加工设备。需说明的是,并非婴幼儿食品要比其他食品更易受到该菌的感染,而是因其主要危害对象是婴幼儿,美国与中国两国的FDA均将其作为婴幼儿食品的重点监控对象,使其在婴幼儿食品的监测频率大大高于其它食品。
婴幼儿食品作为克罗诺杆菌的污染途径之一,最主要的特征是外源性,即外部环境的影响。Müller等[37]分别从医院和乳品厂,尤其是婴幼儿配方奶粉加工环境中分离出了克罗诺杆菌。Craven等[38]从5个奶粉厂中随机挑取298个环境样品,分离出了32株克罗诺杆菌菌株,然而引人注意的是非加工环境(49%)的分离率反而要高于加工环境(29%)的分离率,分离率最高的是停产维修时的奶粉区域(81%),而恢复生产且遵循卫生操作时分离率却是最低(6%)。另有研究报道FAO/WHO组织[39,40]从未开封的婴幼儿配方奶粉罐装中分离出了克罗诺杆菌,平均数量为100 CFU/g,看似为内源性污染源,但经进一步的研究分析发现多为婴幼儿配方奶粉生产后期(喷雾干燥后)的环境污染,故仍具外源性。研究发现从喷雾干燥塔的外顶部、空气处理器和人流交叉较频繁的区域分离出的菌株都具有普遍性和显著耐受性。克罗诺杆菌通过外部污染源经交叉污染带入到喷雾干燥设备中的传播途径应予以重视,外源和内源污染的相关性清晰地说明了其可能存在的3种传播途径:(1)通过进出风口、器械外表面和员工的鞋子等带入到喷雾干燥设备中;(2)喷雾干燥设备的控制房间、走廊和员工流动较频繁的交叉污染;(3)空气和粉末的流动污染。
另外,Craven等[38]根据调查得出,克罗诺杆菌污染具有暂时性和概率性的特点,即并非在同一个地方会一直取到相同的菌样。研究从分离到克罗诺杆菌的7个地点再次取样,只有3处菌样鉴定结果与原来的一致。然而,无论菌株的出现是暂时性还是持续性,在该区域的出现就意味着该区域具有适宜克罗诺杆菌生存的条件,出现的概率也相应增加,可被鉴定为疑似分布区域以及被作为优先洁净区域,预防克罗诺杆菌污染产品。
3.3 克罗诺杆菌的流行病学
克罗诺杆菌感染病的事例比较少,通常不会被报道,尤其是在发展中国家,因此,很少有报道研究克罗诺杆菌的流行病学。新生儿在出生时就有受感染的可能,有报道怀疑部分新生儿的感染可能来自孕妇的产道[41]。Nazarowec-White和Farber[42]经过11年的研究,发现从医院分离出的克罗诺杆菌各菌株间相似度高,难以区分。Smeets等[43]发现从婴幼儿食品中分离出的菌株和从3个病人分离出的菌株完全相同,类似报道从医生的听诊器和幼儿园的食品制作设备中也得到相同分离,如勺子和搅拌器[44]。以上报道均表明克罗诺杆菌具有流行病学相互间关联的可能性,往往受污染物品没有经过适当的处理,就会成为污染的媒介,造成更大范围的污染。
4 婴幼儿食品中的控制措施
为有效控制在婴幼儿食品加工环境中的克罗诺杆菌,建立一个在线监测系统为主导的加工环境控制措施至关重要,克罗诺杆菌的污染最终体现在产品的品质上,可在婴幼儿食品中添加天然、安全的抑菌剂,如益生菌和益生元等。
4.1 快速检测与监测技术
克罗诺杆菌在婴幼儿食品加工环境中广泛存在,可能与空气和粉末的流动或员工交叉污染有关,为研究克罗诺杆菌在婴幼儿食品加工环境中能够持续存在的传播途径,有必要建立一个快速、准确的在线监测系统。克罗诺杆菌在婴幼儿食品加工环境中的污染是一个现代普遍性难题,在线监测系统可提供其在加工环境中的分布状态,通过分析其流行相关性,准确寻找污染源,再利用适当控制措施,可以从污染源头有效控制污染。
用克罗诺杆菌选择培养基鉴定克罗诺杆菌,会使不同菌株在培养基中表现出相同的形态,难以体现出菌样本身的代表性,不能准确推测出其在环境中的流行相关性,此外,鉴定结果往往会出现假阳性和假阴性的现象,需以API生化试验作进一步验证,此流程不但繁琐,且花费时间多,不符合工厂中的效率原则。近年来快速发展的PCR技术可弥补这一缺陷,相继研究出的荧光定量PCR技术和环介导恒温扩增法等方法,具有灵敏度高、准确性好、简便快速等优点,但仍需实验寻找特定的保守基因序列作为引物,也会出现假阴性和假阳性现象,同时耗费较大,故尚不宜作为在线监测的方法。脉冲场凝胶电泳(pulse-field gel electrophoresis,PFGE)以电场作为引导力,根据DNA分子量的不同而使大于20 kb的DNA分子得以分离。PFGE分型技术可鉴别菌株间的亲源性,分析各菌样的流行相关性,以此作为追溯污染源的判断依据,实现在此基础上采取适当措施控制污染源。Masaki等[45]以PFGE分型技术证实了用来清洗玻璃瓶的刷子被克罗诺杆菌感染后,成为了3例病例的感染来源。该技术具有稳定性、重复性、高分辨率和标准化的优点,被认为是微生物分子生物学分型技术的“金标准”。美国已有多种菌种的标准PFGE操作方法,并建立了全美检测网络PulseNet和PFGE指纹图谱数据库[46],然而目前尚未见克罗诺杆菌标准的PFGE分析方法报道,故此方法应用于克罗诺杆菌的在线监测仍需进一步研究,但发展潜力巨大。
4.2 工厂卫生与环境控制
光氢离子化(Photohydrocatalytic,PHI)技术利用宽频谱、高强度紫外线和多重稀有金属发生催化反应,其反应释放的高级氧化粒子具有强氧化性,能去除空气中的微生物、异味等污染物。目前,我国对PHI技术的研究较少,尹湘毅等[47]和史利克等[48]利用PHI空气净化器分别处理车间和医院空气,发现空气中的细菌量均明显下降,同时可很好地去除异味。PHI技术具有生产在线控制车间空气中微生物的优势,且不使用任何化学制剂。
目前,企业控制微生物的主要手段是紫外线(UV)、臭氧(O3-)和过氧乙酸等,处理效果都比较明显。Ha和Kang[49]研究以紫外线(UV)和红外线(NIR)作为处理手段,观察其对婴幼儿配方奶粉中的克罗诺杆菌杀菌效果,发现以UV-NIR联合使用比各自单独使用效果要好。Torlak和Sert[50]以气态O3-处理脱脂奶粉120 min,质量浓度为2.8 mg/L和5.3 mg/L的O3-量可以使最初浓度为5.92 g-1(对数值)的克罗诺杆菌分别减少2.71和3.28 g-1(对数值),在全脂奶粉可达到1 g-1(对数值)杀菌效果。
4.3 益生菌和益生元的抑制作用
益生菌有利于体内肠道菌群的环境稳定,为机体提供必要营养元素,近年来,有学者研究益生菌对克罗诺杆菌的影响。2014年,Weng等[51]研究发现,双歧杆菌生长所产生的物质可减缓小鼠因克罗诺杆菌而引起的肠道炎症现象,使回肠上皮细胞恢复繁殖能力,维持体重。益生元具有抗微生物粘附活性,减少对机体的危害。Quintero等[52]将克罗诺杆菌培养在玻璃盖玻片上,以低聚半乳糖(GOS)和聚葡萄糖处理,结果显示当GOS的处理量质量浓度为16 g/L时,可以减少56%~71%的黏附量,表明这些益生元可抑制克罗诺杆菌感染的最初步骤。此外,人乳中含有的一类寡糖也具有抗粘附活性,有研究报道将这类食品级寡糖作为益生元,具有影响肠杆菌和沙门氏菌的感染效果[53]。有理由相信,随着以后的研究发展,将益生菌和益生元应用于婴幼儿食品中抑制克罗诺杆菌的生长将成为可能
5 结论和展望
克罗诺杆菌对婴幼儿具有潜在致病性,且范围广、危害大,在婴幼儿食品行业一直备受关注。生物膜形成与克罗诺杆菌生理性和耐受性等生物学特性有很大相关性,并受到信号分子传递和各种环境条件的共同影响。
克罗诺杆菌污染具有流行相关性,婴幼儿食品作为婴幼儿感染该菌的主要途径之一,其本身受污染特征具有外源性,此外,该菌污染还具有暂时性和概率性的特点,因此,通过在线监测系统为主导的加工环境控制措施显得尤为重要。通过分析克罗诺杆菌在婴幼儿食品加工环境的外源传播特征,准确寻找污染源,靶向选择有效、安全和生产在线的克罗诺杆菌控制措施,从污染源头有效控制该菌污染,是婴幼儿食品行业迫切需要的技术,也是以后的研究方向和发展趋势。
[1]NAZAROWEE-WHITE M,FARBER J M.Enteratacter sakazakii:a review[J].International Journal of Food Microbiology,1997,34(2): 103-113.
[2]DRUGGANP,IVERSEN C.Culturemedia for the isolation of Cronobacter spp[J].InternationalJournalofFoodMicrobiology,2009,136(2): 169-178.
[3]HEALY B,COONEY S,O'BRIEN S,et al.Cronobacter(Enterobacter sakazakii):an opportunistic foodborne pathogen[J].Foodborne Pathogens and Disease,2010,7(4):339-350.
[4]何军霞,贾忠建,寇建军,等.2012年平凉市市售婴幼儿食品中阪崎肠杆菌污染调查分析[J].中国卫生检验杂志,2015,25(13): 2222-2224.
[5]周少君,邓小玲,朱海明等.2010年-2013年广东省婴幼儿食品中阪崎肠杆菌污染情况调查[J].中国卫生检验杂志,2014,24(15): 2248-2251.
[6]权玉玲,胡晓宁,兰光,等.甘肃省地产婴幼儿配方奶粉阪崎肠杆菌污染调查分析[J].中国卫生检验杂志,2013,23(4):990-993.
[7]吴环,聂炎炎,黄宇锋,等.广州市售婴儿配方粉阪崎肠杆菌污染情况调查[J].中国乳业,2013,135:48-49.
[8]李闽真,叶玲清,陈伟伟.福建省2011年婴幼儿配方食品和谷类辅助食品中阪崎肠杆菌污染状况调查[J].海峡预防医学杂志,2012,18(6):55-56.
[9]吕均,李玉芳,郑向梅等.十堰市市售婴幼儿配方食品阪崎肠杆菌污染状况调查分析[J].中国预防医学杂志,2012,13(9):710-711.
[10]陈松,李红,周汉洪,等.2009-2012年达州市食源性致病菌监测结果分析[J].预防医学情报杂志,2014,30(11):918-920.
[11]黄玉兰,杨小蓉,赵晋,等.2010年四川省市售婴幼儿食品阪崎肠杆菌监测与分析[J].预防医学情报杂志,2013,3(29):208-210.
[12]姚雪婷,唐振柱,刘展华,等.2012年广西市售婴幼儿食品食源性致病菌监测与分析[J].中国食品卫生杂志,2012,27(1):85-88.
[13]章迎春,陆永梅.绍兴市售婴幼儿配方粉中阪崎肠杆菌污染状况分析[J].中国卫生检验杂志,2015,25(15):2608-2612.
[14]朱凤,李维克,俞慕华,等.深圳乳制品和环境中阪崎肠杆菌污染状况调查[J].现代预防医学,2012,39(16):4107-4109.
[15]李秀娟,李丽婕,高伟利,等.石家庄市售国产配方奶粉和婴幼儿食品中阪崎肠杆菌污染调查[J].中国卫生检验杂志,2010,20(4): 886-888.
[16]FARMER J J,ASBURY M A,HICKMAN F W,et al.Enterobacter sakazakii:A New Species of“Enterobacteriaceae”Isolated from Clinical Specimens[J].International Journal of Systematic and Evolutionary Microbiology,1980,30(3):569-584.
[17]IVERSEN C,WADDINGTON M,FARMER J J,et al.The biochemical differentiation of Enterobacter sakazakii genotypes[J].BioMed Central Microbiology,2006,6:94.
[18]IVERSEN C,MULLANE N,MCCARDELL B,et al.Cronobacter gen.nov.,a new genus to accom13 modate the biogroups of Enterobacter sakazakii,and proposal of Cronobacter sakazakii gen.nov.,comb. nov.,Cronobacter malonaticus sp.nov.,Cronobacter turicensis sp.nov.,Cronobacter muytjensii sp.nov.,Cronobacter dublinensis sp.nov.,Cronobacter genomospecies 1,and of three subspecies,Cronobacter dublinensis subsp.dublinensis subsp.nov.,Cronobacter dublinensis subsp.lausannensis subsp.nov.and Cronobacter dublinensis subsp.lactaridi subsp.nov.[J]. International Journal Ststematic and Evolutionary Microbiology,2008,58(6):1442-1447.
[19]JOSEPH S,CETINKAYA E,DRAHOVSKA H,et al.Cronobacter condimenti sp.nov.,isolated from spiced meat and Cronobacter universalis sp.nov.,a novel species designation for Cronobacter sp.genomospecies 1,recovered from a leg infection,water,and food ingredients[J]. International Journal Ststematic and Evolutionary Microbiology,2012,62(Pt 6):1277-1283.
[20]CHRISTOPHER JG,MICHAEL LK,KAREN AP,et al.Pan-genome analysis of the emerging foodborne pathogen Cronobacter spp. suggests a species-level bidirectional divergence driven by niche adaptation[J].Biomedical Genomics,2013,14:366.
[21]KIVES J,ORGAZ B,SANJOS C.Polysaccharide differences between planktonic and biofilm-associated EPS from Pseudomonas fluorescens B52[J].Colloids and Surfaces B:Biointerfaces,2006,52(2): 123-127.
[22]BREEUWER P,LARDEAU A,PETERZ M,et al.Desiccation and heat tolerance of Enterobacter sakazakii[J].Journal of Applied Microbiology,2003,95(5):967-973.
[23]APARNA MS,YADAV S.Biofilms:microbes and disease[J].Brazilian Journal of Infectious Diseases,2008,12(6):526-530.
[24]IVERSEN C,LANE M,FORSYTHE S J.The growth profile,thermotolerance and biofilm formation of Enterobacter sakazakii grown in infant formula milk[J].Letters in Applied Microbiology,2004,38(5): 378-382.
[25]LEHNER A,RIEDEL K,EBERL L,et al.Biofilm Formation,Extracellular Polysaccharide Production,and Cell-to-Cell Signaling in Various Enterobacter sakazakii Strains:Aspects Promoting EnvironmentalPersistence[J].JournalofFoodProtection,2005,68(11): 2287-2294.
[26]HOLY O,MATOUSKOVA I,HOLY V,et al.Isolation of Cronobacter spp.(formerly Enterobacter sakazakii)from nostrils of healthy stable horse-short communication[J].Epidemiologie Mikrobiologie Imunologie,2011,60(4):167-169.
[27]HUBERT J,KOPECKY J,PEROTTI M A,et al.Detection and identification of species-specific bacteria associated with synanthropic mites[J].Microbial Ecology,2012,63(4):919-928.
[28]GARCIA F,NOTARIO M J,CABANAS J M,et al.Incidence of bacteria of public health interest carried by cockroaches in different food-related environments[J].Journal of Medical Entomology,2012,49(6):1481-1484.
[29]CHANNAIAH LH,SUBRAMANYAM B,ZUREK L.Survival of Enterococcus faecalis OG1RF:pCF10 in poultry and cattle feed:vector competence of the red flour beetle,Tribolium castaneum(Herbst)[J]. Journal of Food Protection,2010,73(3):568-573.
[30]HAMILTON J V,LEHANE M J,BRAIG H R.Isolation of Enterobacter sakazakii from midgut of Stomoxys calcitrans[J].Emerging Infectious Diseases,2003,9(10):1355-1356.
[31]PAVA-RIPOLL M,PEARSON R E,MILLER AK,et al.Prevalence and relative risk of Cronobacter spp.,Salmonella spp.,and Listeria monocytogenes associated with the body surfaces and guts of individual filth flies[J].Applied and Environmental Microbiology,2012,78(22): 7891-7902.
[32]PAVA-RIPOLL M,PEARSON R E,MILLER A K,et al.IngestedSalmonella enterica,Cronobacter sakazakii,Escherichia coli O157:H7,and Listeria monocytogenes:transmission dynamics from adult house flies to their eggs and first filial(F1)generation adults[J].BioMed Central Microbiology,2015,15:150.
[33]PAVA-RIPOLL M,PEARSON R E,MILLER A K,et al.Detection of foodborne bacterial pathogens from individual filth flies[J]. Journal of visualized experiments,2015,(96):e52372.
[34]JARADAT Z W,ABABNEH Q O,SAADOUN I M,et al.Isolation of Cronobacter spp.(formerly Enterobacter sakazakii)from infant food,herbs and environmental samples and the subsequent identification and confirmation of the isolates using biochemical,chromogenic assays,PCR and 16S rRNA sequencing[J].Biomed Central Genomics,2009,9:225.
[35]NIHARIKA S,GUNJAN G,MAMTA R.Prevalence and Characterization of Cronobacter spp.from Various Foods,Medicinal Plants,and Environmental Samples[J].Current Microbiology,2015,71(1): 31-38.
[36]SCHMID M,IVERSEN C,GONTIA I,et al.Evidence for a plant-associated natural habitat for Cronobacter spp[J].Research in Microbiology,2009,160(8):608-614.
[37]MÜLLER A,STEPHAN R,FRICKER-FEER C,et al.Genetic diversity of Cronobacter sakazakii isolates collected from a Swiss infant formula production facility[J].Journal of Food Protection,2013,76(5):883-887.
[38]CRAVEN H M,MCAULEY C M,DUFFY L L,et al.Distribution,prevalence and persistence of Cronobacter(Enterobacter sakazakii)in the nonprocessing and processing environments of five milk powder factories[J].Journal of Applied Microbiology,2010,109(3):1044-1052.
[39]FAO/WHO.Expert meeting on Enterobacter sakazakii and Salmonella in powdered infant formula.Rome;2006.
[40]FAO/WHO.Enterobacter sakazakii(Cronobacter spp.)in powdered follow-up formulae.Microbiological Risk Assessment Series No.15. Washington:Joint FAO/WHO Food Standards Programme;2008.
[41]TOWNSEND S,HURRELL E,FORSYTHE S.Virulence studies of Enterobacter sakazakii isolates associated with a neonatal intensive care unit outbreak[J].BioMed Central Microbiology,2008,8:64.
[42]NAZAROWEC-WHITE M,FARBER J M.Phenotypic and genotypic typing of food and clinical isolates of Enterobacter sakazakii[J]. Journal of Medical Microbiology,1999,48(6):559-567.
[43]SMEETS L C,VOSS A,MUYTJENS H L,et al.Genetische karakterisatie van Enterobacter sakazakii-isolaten van Nederlandse patie¨nten met neonatale meningitis[J].Nederlands Tijdschrift Voor Medische Microbiologie,1998,6:113-115.
[44]BAR-OZ B,PREMINGER A,PELEG O,et al.Enterobacter sakazakii infection in the newborn[J].Acta Paediatrica,2001,90(3): 356-358.
[45]MASAKI H,ASOH N,TAO M,et al.Detection of Gram-Negative Bacteria in Patients and Hospital Environments at a Room in Geri-atric Wards under the Infection Control Against MRSA[J]. Journal of the Japanese Association for Infectious Diseases,2001,75: 144-150.
[46]SWAXNINATHAN B,BARRETT T J,HUNTER S B,et al. PulseNet:the molecular subtyping network for foodborne bacterial disease surveillance,United States[J].Emerging Infectious Diseases,2001,7(3):382-389.
[47]尹湘毅,张皖瑜,黄慧敏,等.迅洁(RGF)空气净化设备在医院重点部门的应用及效果观察[J].质控与安全,2010,31(5):108-109.
[48]史利克,刘燕,王悦,等.RGF空气消毒净化器的消毒效果观察[J].临床工程,2008,24(4):68-69.
[49]HA J W,KANG D H.Synergistic bactericidal effect of imultaneous near-infrared radiant eating and UV adiation against Cronobacter sakazakii in powdered infant formula[J].Applied and Environmental Microbiology,2014,80(6):1858-1863.
[50]TORLAK E,SERT D.Inactivation of Cronobacter by gaseous ozone in milk powders with different fat contents[J].International Dairy Journal,2013,32(2):121-125.
[51]WENG M,GANGULI K,ZHU W,et al.Conditioned medium from Bifidobacteria infantis protects against Cronobacter sakazakii-induced intestinal inflammation in newborn mice[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2014,306(9): G779-G787.
[52]QUINTERO M,MALDONADO M,PEREZ-MUNOZ M,et al. Adherence inhibition of Cronobacter sakazakii to intestinal epithelial cells by prebiotic oligosaccharides[J].Current Microbiology,2011,62(5):1448-1454.
[53]SEARLE L E,BEST A,NUNEZ A,et al.A mixture containing galactooligosaccharide,produced by the enzymic activity of bifidobacterium bifidum,reduces Salmonella enterica serovar Typhimurium infection in mice[J].Journal of Medical Microbiology,2009,58(Pt1):37-48.
Review of biological characteristics and controlling of Cronobacter spp.in dairy products
LIN Xue-hai1,GONG Jin-yan1,WANG Wei-jun2,WEI Pei-lian1,XIAO Gong-nian1,YOU Yu-ru1
(1.School of Biological and Chemical Engineering,Zhejiang provincial Key Lab for Chem&Bio Processing Technology of Farm produces,Zhejiang University of Science and Technology,Hangzhou 310023,China;2.Beingmate Baby& Child Food Co.,Ltd,Hangzhou 311106,China)
This paper describes biological characteristics of Cronobacter spp.by elaborate its taxonomy and tolerability.It discusses the correlation between biofilm formation and biological characteristics of Cronobacter spp.Simultaneously,it analyzes source of pollution and routes of transmission via nature vectors,food processing environmental and epidemiology for proving contamination of Cronobacter spp.associated with extrinsic and inter-related epidemiologic.It considers that the establishment of an online monitor-control system in processing environment is particularly important.In addition,it clarifies the mechanism and effect of probiotics and prebiotics to inhibit the growth of Cronobacter spp.
Cronobacter spp;biofilm;source of pollution;control measures
Q936
B
1001-2230(2016)08-0037-06
2015-12-18
浙江省重大科技专项重大农业项目(No.2014C02012,2014C 02016);浙江省自然科技基金项目(No.LY14C200007);杭州市科技计划项目(No.20140432B106,20140533B74)。
林学海(1991-),男,硕士研究生,从事乳品微生物控制研究。
尤玉如
