黔产艾纳香对镉胁迫的生理响应及其体内镉分布特征
2016-07-23梁娟周华芳任建国
梁娟++周华芳++任建国


摘要:为探明黔产艾纳香对镉(Cd)胁迫的生理响应及其体内Cd分布特征,采用沙培试验研究不同浓度Cd(0、10、30、60、120 mg/L)处理下艾纳香生理生化指标的变化规律及Cd在其体内器官和亚细胞分布特征。结果表明:随着Cd胁迫浓度的增加,叶绿素含量整体上逐渐降低,丙二醛(MDA)、脯氨酸(Pro)、可溶性蛋白含量均有不同程度的升高,超氧化物歧化酶(SOD)活性呈先升高后降低的变化;艾纳香各器官Cd含量随处理浓度的增加而增加,并表现为根>茎>叶;根、茎和叶细胞中Cd主要分布在可溶组分、细胞壁中,根、茎、叶可溶组分中Cd的分配比例分别为519%~69.7%、45.4%~69.7%、52.5%~57.9%,根、茎、叶细胞壁中Cd的分配比例分别为26.0%~37.8%、244%~45.6%、36.8%~41.4%;随着Cd处理浓度的增加,细胞壁中Cd含量所占比例呈上升趋势,而可溶组分所占比例呈下降趋势。总的看出,黔产艾纳香对Cd胁迫具有一定的生理适应性,细胞壁对Cd的滞留和可溶组分对Cd的区室化可能是其主要的解毒机制。
关键词:艾纳香;镉(Cd);器官分布;亚细胞分布;生理响应
中图分类号: S567.23+9.01文献标志码: A文章编号:1002-1302(2016)05-0271-04
镉(Cd)是环境中继汞(Hg)、铅(Pb)之后对环境、人类健康危害最大的第3种重金属元素[1],具有移动性强、毒性大、易吸收积累等特征[2]。Cd是植物生长发育的非必需元素,但是与其他重金属相比,却更容易被植物吸收[3]。大量研究表明,Cd在植物体内累积到一定程度后会引起生理代谢紊乱,并抑制生长发育,严重时可导致死亡[4-5];同时,蓄积在植物可食部分的Cd还可以进入食物链威胁人类健康。
艾纳香[Blumea balsamifera (L.) DC.]是制取冰片的药用植物[6],其叶、嫩枝、根均可入药,具有温中活血、祛风除湿、杀虫等功效。作为贵州省十大苗药之一,艾纳香是贵州省许多名牌中成药产品的原料药[7],如金骨莲胶囊、心胃止痛胶囊、咽立爽等[8]。有调查显示,贵州省农业土壤中存在Cd的重污染[9],而且黔产艾纳香对Cd也表现出较强的富集作用[10-11],因此了解Cd胁迫对艾纳香生理生态的影响具有重要的现实意义,但是目前相关的基础研究比较缺乏。本研究通过沙培试验,探讨不同浓度Cd对黔产艾纳香几个典型生理指标的影响以及艾纳香体内Cd的分布特征,以期为艾纳香的安全性用药和无公害种植提供一定的理论依据。
1材料与方法
1.1供试材料
选取贵州省罗甸县同一艾纳香生产质量管理规范(GAP)种植示范基地内生长良好、长势基本一致的艾纳香根生春苗作为供试植物。盆栽河沙均用去离子水洗净、风干备用。
1.2试验方法
试验于2014年6月在贵州医科大学(北京路校区)内进行。用自来水将供试幼苗根部的泥沙冲洗干净,并用蒸馏水冲洗数次,然后移栽至盛有等量河沙的聚丙烯塑料花盆中,每盆定植1株,采用改良Hoagland营养液(pH值5.5~6.5)进行浇灌培养。缓苗7 d后,将存活艾纳香苗随机分成5组,进行Cd胁迫处理。将分析纯CdCl2·2.5H2O加入到营养液中,设置5个Cd处理水平:0(CK)、10、30、60、120 mg/L(以纯Cd2+计),每个处理10株苗。人工避雨,自然光照条件,视河沙湿度不定期浇入等体积含相应浓度Cd的营养液。处理 10 d 后,随机从各组选取5株测定生理生化指标:叶绿素含量、可溶性蛋白的鲜质量含量、脯氨酸(Pro)的鲜质量含量、丙二醛(MDA)的鲜质量含量、超氧化物歧化酶(SOD)活性(鲜质量)。30 d后收获剩余植株,用自来水、蒸馏水冲洗根部、地上部,再用20 mmol/L EDTA-2Na浸泡根部20 min,以去除根表面吸附的Cd2+;最后再用去离子水冲洗2~3次,吸干植物表面的水分,按根、茎、叶分别取样,将一部分鲜样置于 -80 ℃ 冰箱待分析Cd的亚细胞分布,其余样品于105 ℃杀青30 min,75 ℃烘干至恒质量,研细后过1 mm筛,用于各器官Cd含量的测定。大部分试验用水为超纯水。
1.2.1生理生化指标测定[12]取植株相同部位叶片(植株顶端第4~6张叶)用于测定叶绿素、可溶性蛋白、Pro、MDA含量,SOD活性用根进行测定。叶绿素含量的测定采用95%乙醇浸提法,MDA含量的测定采用硫代巴比妥酸(TBA)法,SOD活性的测定采用氮蓝四唑(NBT)比色法,Pro含量的测定采用酸性茚三酮比色法,可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法。
1.2.2各器官Cd含量测定分别称取一定量研磨后的根、茎、叶干样,按体积比加入5 ∶2的HNO3-H2O2混合酸,用Milestone ETH型微波消解仪进行消解,然后用原子吸收光谱仪(contrAA700,德国)测定Cd含量。
1.2.3亚细胞组分Cd含量测定亚细胞组分分离参照Wang等的方法[13]并略作改动,取冷冻的新鲜根、茎、叶样本,按料液比1 g ∶10 mL加入预冷的提取缓冲液充分研磨成匀浆液。提取缓冲液组成:250 mmol/L蔗糖、pH值7.5的 50 mmol/L Tris-HCl、1 mmol/L二硫代苏糖醇。匀浆液过300目尼龙网,过滤后的残渣为含细胞壁的残渣部分,滤液在15 000 r/min下离心30 min,沉淀为细胞器组分,上清液为可溶物质组分(含细胞质、液泡内高分子和大分子有机物质、无机离子)。试验操作均在4 ℃条件进行。细胞壁、细胞器组分参照“1.2.2”节进行消解和Cd含量的测定;可溶物质组分用超纯水定容后再用原子吸收光谱仪测定Cd含量。
1.3数据分析
采用SPSS 16.0软件进行数据录入和统计分析。试验数据以“均值±标准差(x±s)”表示,多样本均数的比较采用单因素方差分析,组间比较用LSD-t法,α=0.05。采用GraphPad Prism 5软件完成作图。
2结果与分析
2.1Cd胁迫对艾纳香生理生化特性的影响
2.1.1Cd胁迫对叶绿素含量的影响从表1可以看出,艾纳香叶片内叶绿素a、b及总叶绿素含量随着Cd处理浓度的增加总体上逐渐降低。当Cd浓度≥10 mg/L时,叶绿素a、总叶绿素含量与CK相比差异显著(P<0.05);但叶绿素b含量在Cd浓度增加到30 mg/L以上后,与CK比较差异才显著(P<0.05);叶绿素组成(叶绿素a/叶绿素b)随Cd浓度增加而逐渐增大,但各组间差异不显著。
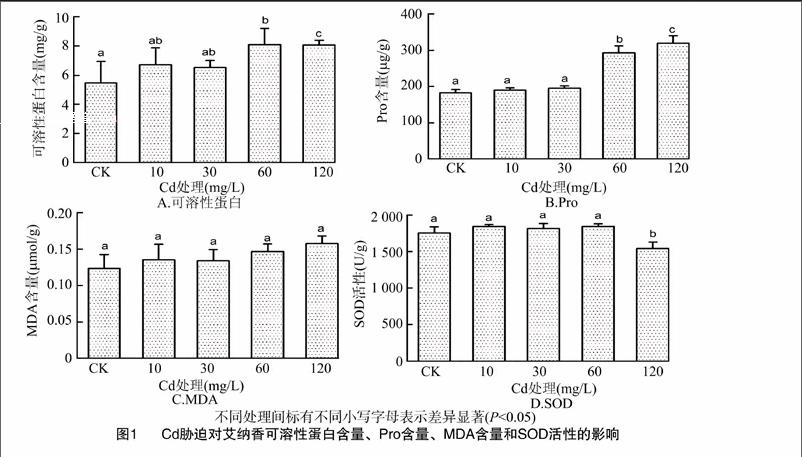
2.1.2Cd胁迫对Pro、可溶性蛋白含量的影响由图1-A、图1-B看出,随着Cd处理浓度增加,艾纳香叶片内的可溶性蛋白、Pro含量总体上呈升高趋势,表明Cd胁迫能促进可溶性蛋白、Pro的合成。在30 mg/L及以下的Cd处理浓度下,可溶性蛋白、Pro含量与CK相比差异不显著;Cd浓度增加至60 mg/L时,可溶性蛋白含量达最大值,与CK相比增加了48.2%;在60、120 mg/L Cd处理浓度下,与其他各处理间Pro含量差异均显著(P<0.05)。
2.1.3Cd胁迫对MDA含量、SOD活性的影响由图1-C可知,Cd处理组的艾纳香叶片内的MDA含量均较CK组有所增加,但各组间差异不显著。当Cd处理浓度≤60 mg/L时,艾纳香根部的SOD活性均较CK有所增加,但差异不显著;在Cd处理浓度增加至120 mg/L时,SOD活性表现出明显的降低,与其他处理之间差异均显著(P<0.05)(图1-D)。表明低浓度的Cd使SOD活性增强,高浓度Cd抑制SOD活性。
2.2Cd在艾纳香体内的器官分布
由表2可知,除了对照组的叶中Cd含量未检出外,其他处理组的根、茎、叶中的Cd含量均随着Cd处理浓度的增加而增加,且各器官各处理组的Cd含量差异都显著(P<0.05)。艾纳香各器官Cd含量的分布大小为:根>茎>叶。
2.3Cd在艾纳香体内的亚细胞分布
由表3可知,Cd在艾纳香根、茎、叶亚细胞组分中的分布均表现为:可溶组分(F3)>细胞壁(F1)>细胞器(F2),根、茎、叶中F3、F1 2个部分总的Cd含量分别占总量的 88.1%~95.7%、91.0%~94.2%、90.6%~94.7%。可见Cd主要积累在细胞壁和可溶部分,细胞器中含量相对较少。随着Cd处理浓度的增加,各组分中的Cd含量均逐渐增加;
根、茎、叶可溶组分中Cd的分配比例随着Cd处理浓度的增加总体上呈下降趋势,细胞壁中Cd的分配比例却随着Cd处理浓度的增加总体上呈上升趋势。
3讨论与结论
植物在逆境胁迫下,当其质膜受损后,细胞会启动一系列的响应机制,具体表现为电解质、某些小分子有机物的渗漏、酶活性的改变、渗透调节物质含量的增加(如脯氨酸、可溶性糖)以及叶绿素含量降低等[14]。
叶绿素含量是衡量植物叶片生理功能的重要生理指标,其变化既可以反映植物叶片光合作用的强弱,也可用以表征植物组织、器官的衰老状况[15]。本研究结果显示,随着Cd处理浓度的提高,艾纳香叶绿素含量总体上呈现下降趋势,这与以往相关研究结果一致[14,16]。Cd胁迫导致叶绿素含量降低与其间接抑制叶绿素的合成以及直接破坏叶绿体结构和功能有关[17-18]。各处理组间的叶绿素组成(叶绿素a/叶绿素b)差异无统计学意义,可能是因为Cd对艾纳香叶片捕光系统中色素的影响速率相似[19]。
可溶性蛋白大多是参与植物体内各种代谢的酶类,其含量增多有助于维持植物细胞的正常代谢,从而提高植物的抗逆性[20]。Pro作为重要的渗透调节物质,其积累有着对逆境适应的意义,被认为是测定各种逆境胁迫的理想指标[21]。在本研究中,随着Cd处理浓度的增加,艾纳香叶片内可溶性蛋白、Pro含量呈上升趋势,有助于维持细胞的正常代谢,从而缓解Cd的伤害。李清飞等在研究麻疯树、大豆幼苗等其他植物时也得到了相似的结果[16,22]。但张琼等却发现,随着Cd处理浓度的增加,Pro含量呈现先升后降的变化[23],其原因可能是植物抗逆性能力的有限性,低浓度的Cd能通过促进体内Pro的积累来维持正常代谢,高浓度的Cd会使细胞机能丧失,导致Pro含量的下降。
在重金属胁迫下,植物体内产生的活性氧类物质(ROS)攻击膜脂上的多不饱和脂肪酸,引发过氧化反应[24]。MDA是细胞膜脂质过氧化的重要产物,可与蛋白质、核酸、氨基酸等活性物质交联,形成不溶性化合物(脂褐素)沉积,干扰细胞的正常生命活动[25],通常作为衡量脂质过氧化损伤的指标。同时,植物体内也将通过抗氧化酶[SOD、过氧化物酶(POD)、过氧化氢酶(CAT)等]和非酶物质[谷胱甘肽(GSH)、疏基(SH)等]消除ROS。在抗氧化酶中,SOD是一种重要的活性氧防御酶,在消除ROS过程中起重要作用。本研究中,Cd处理组的艾纳香叶片内MDA含量均较对照组有所增加,但是各组间差异不显著,表明叶片细胞膜还没有受到明显的伤害,其完整性、功能性尚好;随着Cd处理浓度增加,根的SOD活性先升高后降低,表明低浓度Cd能使SOD活性增强,高浓度Cd可能破坏了清除ROS酶系统的平衡。
Cd被植物吸收后,大部分富集在根部,迁移到地上部的一般较少[26]。大量研究显示,根部是植物富集Cd的主要部位,它作为植物对Cd胁迫的一种有效应对机制,能限制Cd向植物地上部迁移,从而减轻对地上部分的毒害作用[27-28]。在本研究中,艾纳香各器官Cd含量大小为:根>茎>叶,说明根也是艾纳香积累Cd的主要器官,这可能是艾纳香抵御Cd毒害的机制之一。
细胞壁被认为是保护原生质体免受重金属毒害的第一道屏障,细胞壁的多糖分子、蛋白质分子含有大量的羧基、羟基、氨基酸残基和醛基等亲金属离子的配位基团,可与进入植物体内的金属离子配位而贮存部分金属离子,从而减少金属离子进入原生质体,以维持细胞的正常生理代谢功能[29]。植物可溶组分包括细胞质、液泡2个部分,液泡是植物细胞代谢副产品和囤积废物的场所,它含有多种能与重金属离子结合而使金属离子在细胞内被区隔化的物质(蛋白质和有机酸等)。因此,细胞壁对重金属的滞留、可溶组分对重金属的区室化被认为是植物解毒的2个重要途径[30]。在本研究中,艾纳香根、茎、叶亚细胞组分中Cd的分布表现为:可溶组分>细胞壁>细胞器,表明可溶组分的液泡区室化可能是艾纳香解毒的原因之一。随着Cd处理浓度的增加,艾纳香根、茎、叶的细胞壁中Cd所占比例呈上升趋势,而可溶组分中Cd所占比例呈下降趋势,表明细胞壁对Cd的固持作用增强,减少了进入可溶组分中的Cd,也限制了Cd向活性较强的细胞器中转运,这种方式可能也起到了重要的解毒作用。
综上所述,在本试验条件下,Cd胁迫能降低黔产艾纳香叶绿素含量,提高可溶性蛋白、Pro、MDA的积累,使SOD活性发生改变。根是积累Cd的主要器官,细胞中的Cd则主要分布在细胞壁、可溶组分中。说明黔产艾纳香对镉胁迫具有一定的生理适应性,细胞壁对Cd的滞留和可溶组分对Cd的区室化可能是其主要解毒机制。
参考文献:
[1]柳絮,范仲学,张斌,等. 我国土壤镉污染及其修复研究[J]. 山东农业科学,2007(6):94-97.
[2]张鑫,李昆伟,陈康健,等. 镉胁迫对丹参生长及有效成分积累的影响研究[J]. 植物科学学报,2013,31(6):583-589.
[3]陈圣安. 镉污染对水稻生理生化的影响[J]. 农技服务,2011,28(7):1033-1035.
[4]Dalcorso G,Farinati S,Maistri S,et al. How plants cope with cadmium:staking all on metabolism and gene expression[J]. Journal of Integrative Plant Biology,2008,50(10):1268-1280.
[5]Yoshihara T,Hodoshima H,Miyano Y,et al. Cadmium inducible Fe deficiency responses observed from macro and molecular views in tobacco plants[J]. Plant Cell Reports,2006,25(4):365-373.
[6]江兴龙,潘俊锋,司健. 艾纳香人工栽培技术[J]. 林业科技开发,2005,19(2):68-70.
[7]夏稷子,赵智,安军,等. 不同产地艾纳香药材的GC指纹图谱研究[J]. 中国药事,2011,25(12):1191-1194.
[8]师琴丽,覃军章,王用平,等. 贵州优势苗族药物艾纳香及其产品[J]. 中药材,2003,26(增刊1):87-88.
[9]宋春然,何锦林,谭红,等. 贵州省农业土壤重金属污染的初步评价[J]. 贵州农业科学,2005,33(2):13-16.
[10]刘峰,黄先飞,秦樊鑫,等. 贵州省艾纳香种植基地土壤重金属污染现状评价[J]. 安徽农业科学,2009,37(9):4249-4253.
[11]刘峰,胡继伟,秦樊鑫,等. 黔产艾纳香对土壤中重金属的吸收富集特征研究[J]. 时珍国医国药,2009,20(3):629-631.
[12]李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[13]Wang X,Liu Y G,Zeng G M,et al. Subcellular distribution and chemical forms of cadmiun in Bechmeria nivea (L.) Gaud[J]. Environmental & Experimental Botany,2008,62(3):389-395.
[14]孙宁骁,宋桂龙. 紫花苜蓿对镉胁迫的生理响应及积累特性[J]. 草业科学,2015,32(4):581-585.
[15]Huff A. Peroxidase-catalysed oxidation of chlorophyll by hydrogen peroxide[J]. Phytochemistry,1982,21(2):261-265.
[16]李清飞,仇荣亮. 麻疯树对镉胁迫的生理耐性及富集特征研究[J]. 农业环境科学学报,2012,31(1):42-47.
[17]Prasad D D K,Prasad A R K. Effect of lead and mercury on chlorophyll synthesis in mung bean seedlings[J]. Phytochemistry,1987,26(26):881-883.
[18]Stobart A K,Griffiths W T,Ameen-Bukhari I,et al. The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J]. Physiologia Plantarum,1985,63(3):293-298.
[19]Liu N,Peng C L,Lin Z F,et al. Changes in photosystem Ⅱ activity and leaf reflectance features of several subtropical woody plants under simulated SO2 treatment[J]. Journal of Integrative Plant Biology,2006,48(11):1274-1286.
[20]常云霞,王红星,陈龙. 水杨酸对锌胁迫下小麦幼苗生长抑制的缓解效应[J]. 西北植物学报,2011,31(10):2052-2056.
[21]张金彪,黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报,2000,20(3):514-523.
[22]陈璨,常云霞,古红梅,等. 重金属及有机物复合污染对大豆生理特性和DNA损伤效应的影响[J]. 大豆科学,2012,31(6):915-919.
[23]张琼,陈晓燕,陈梅,等. 镉对绿豆幼苗生长影响的研究[J]. 漳州师范学院学报:自然科学版,2006,19(4):106-111.
[24]Kaufman S,Pecker J C. Effect of cadmium on lipid peroxidation,superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings[J]. Plant Science,2001,161(1):1135-1144.
[25]徐勤松,施国新,杜开和. 镉胁迫对水车前叶片抗氧化酶系统和亚显微结构的影响[J]. 农村生态环境,2001,17(2):30-34.
[26]Kelly J M,Parker G R,McFee W W. Heavy metal accumulation and growth of seedlings of five forest species as influenced by soil cadmium level[J]. Journal of Environmental Quality,1979,8(3):361-364.
[27]方继宇,贾永霞,张春梅,等. 马缨丹对镉的生长响应及其富集、转运和亚细胞分布特点研究[J]. 生态环境学报,2014(10):1677-1682.
[28]邹金华,张忠贵,魏爱琪. 毛葱的镉吸收积累及亚细胞分布特征[J]. 天津师范大学学报:自然科学版,2014,34(1):72-77.
[29]Zhong H T,Pan W B,Zhang T P,et al. Subcellular distribution and chemical forms of cadmium in Euphorbia thymifolia L.[J]. Environmental Protection Science,2013,39(3):50-54.
[30]Brune A,Urbach W,Dietz K J. Compartmentation and transport of zinc in barley primary leaves as basic mechanisms involved in zinc tolerance[J]. Plant Cell & Environment,1994,17(17):153-162.袁丛军,杨冰,戴晓勇,等. 特有植物厚壳红瘤果茶自然种群生命表及生存力分析[J]. 江苏农业科学,2016,44(5):275-280.
