艾纳香中艾纳香素的提取工艺优化及抗菌消炎活性评价Δ
2023-10-16齐维金刘瑞秀潘淑娟何贤芳王鸿颖贵州大学药学院贵阳550025贵州大学西南特色药用生物资源开发利用教育部工程研究中心贵阳550025
齐维金,刘瑞秀,潘淑娟,何贤芳,王鸿颖,王 鲁(1.贵州大学药学院,贵阳 550025;2.贵州大学西南特色药用生物资源开发利用教育部工程研究中心,贵阳 550025)
艾纳香Blumea balsamifera(L.)DC.为菊科艾纳香属植物,具有抗肿瘤、抗氧化、消炎、抗菌、镇痛等多种药理活性[1],在苗族、黎族、壮族等少数民族地区有着悠久的用药历史,是一种重要的民族药。种植户常用水蒸气蒸馏法提取艾纳香中的“艾片”和“艾油”,剩下的水溶性物质及药渣常被作为废弃物丢弃,但其废弃物中包含具有抗肿瘤、抗血栓等药理活性的黄酮类成分[2—3]。艾纳香素是艾纳香中一种重要的黄酮类化合物,能够对实验性肝损伤起保护作用,对口腔癌细胞及肥大细胞活化脱颗粒反应均存在有效的抑制作用[4—5]。但艾纳香素作为艾纳香的主要活性成分之一,是否具有艾纳香那样良好的抗菌消炎活性目前尚不得知。据文献报道,艾纳香中艾纳香素的含量最高可达2.60 mg/g[6],但艾纳香素的提取工艺研究较少,导致其价格昂贵,从而阻碍了艾纳香素的开发。因此,本研究采用Box-Behnken 响应面法优化从艾纳香中提取艾纳香素的工艺,并通过体内外实验评价艾纳香素的抗菌消炎活性,以期为艾纳香的合理利用(包括其提取废弃物的回收利用)、新型抗菌消炎药物的研发,以及进一步实现艾纳香素的工业化生产提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Agilent 1260型高效液相色谱(HPLC)仪(美国Agilent公司)、SW-CJ-ID型单人净化工作台(苏州净化设备有限公司)、ZQLY-180N型振荡培养箱(上海知楚仪器有限公司)、AR1530/C 型电子分析天平(美国Ohaus公司)等。
1.2 主要药品与试剂
艾纳香茎叶购自贵州罗甸县种植户,经贵州大学植物物种鉴定中心王华磊教授鉴定为艾纳香B. balsamifera(L.) DC.原植物[鉴定号2018(033)];艾纳香素标准品(用于HPLC 和核磁共振-质谱鉴定,批号20052223,纯度>98%)购自上海同田生物技术有限公司;艾纳香素(用于抗菌消炎活性检测,纯度>98%)由贵州省生化工程中心自提;地塞米松(批号201112,纯度99.3%)购自浙江仙琚制药有限公司;头孢呋辛钠(批号20220804,纯度99.25%)购自北京索莱宝科技有限公司;化脓链球菌(ATCC 19615)、金黄色葡萄球菌(ATCC 13565)、无乳链球菌(ATCC 13813)、变异链球菌(ATCC 25175)、枯草芽孢杆菌(ATCC 6633)、藤黄微球菌(ATCC 7468)均购自中国食品药品检定研究院;10%氯化钠胰酪胨大豆肉汤(批号200226)购自上海博微生物科技有限公司;其他试剂均为国产分析纯。
1.3 实验动物
SPF 级昆明小鼠200 只,雌雄各半,体重(20±2) g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号为SCXK(京)2019-0010。本实验经贵州大学实验动物伦理分委员会审核批准(伦理批件号为EAE-GZU-2021-T018)。
2 方法与结果
2.1 艾纳香素的含量测定
2.1.1 溶液的制备
精密称取艾纳香素标准品适量,以甲醇配制成质量浓度为78 µg/mL 的艾纳香素标准品溶液。精密称取艾纳香干燥茎叶粉末,经超声提取2 h(提取温度40 ℃、功率180 W、频率40 kHz)后过滤,取续滤液作为供试品溶液。
2.1.2 色谱条件
色谱柱为Agilent-C18(250 mm×4.6 mm,5 µm);流动相为甲醇-0.1%磷酸溶液(60∶40,V/V);柱温为30 ℃;流速为0.8 mL/min;检测波长为290 nm;进样量为10 μL。在该色谱条件下,标准品和供试品溶液中艾纳香素的保留时间约为11.30 min,其HPLC图见图1(空白对照的图谱略)。

图1 艾纳香素标准品溶液和供试品溶液的HPLC图
2.1.3 线性关系考察
精密吸取艾纳香素标准品溶液4、8、12、16、20 μL,按“2.1.2”项下色谱条件进样检测,记录峰面积。以进样量为横坐标(X)、峰面积为纵坐标(Y)进行线性回归,得回归方程为Y=449.89X—138.96(R²=0.998 0)。结果表明,艾纳香素的进样量在0.31~1.56 μg范围内与峰面积线性关系良好。
2.1.4 精密度试验
精密吸取同一批供试品溶液,按“2.1.2”项下色谱条件连续进样测定6次,记录峰面积。结果显示,峰面积的RSD为0.75%(n=6),表明方法精密度良好。
2.1.5 重复性试验
取艾纳香干燥茎叶粉末,按“2.1.1”项下方法平行制备6份供试品溶液,按“2.1.2”项下色谱条件进样检测,记录峰面积,以外标法计算样品含量。结果显示,样品平均含量的RSD为1.66%(n=6),表明方法重复性良好。
2.1.6 稳定性试验
取同一批供试品溶液,分别于室温(25 ℃)放置0、4、8、12、24、48 h 后,按“2.1.2”项下色谱条件进样检测,记录峰面积。结果显示,峰面积的RSD 为0.94%(n=6),表明供试品溶液在室温下放置48 h内稳定性良好。
2.1.7 加样回收率试验
精密量取已知样品含量的同一批供试品溶液9 份,分为3 组,分别加入0.1、0.2、0.4 mL 艾纳香素标准品溶液,按“2.1.2”项下色谱条件进样检测,记录峰面积,以外标法计算样品含量,并计算加样回收率。结果显示,艾纳香素的平均加样回收率分别为99.52%、101.02%、101.21%,RSD 分别为0.83%、1.22%、1.15%(n=3),表明方法准确度良好。
2.2 提取工艺的单因素实验
2.2.1 提取溶剂的筛选
精密称取艾纳香干燥茎叶粉末20 g,按液料比10∶1(mL/g)分别加入甲醇、95%乙醇、二氯甲烷、乙酸乙酯,选择提取温度为提取溶剂沸点值,回流提取2 h,考察不同提取溶剂对艾纳香素得率的影响。结果显示,艾纳香素的得率分别为1.70、1.68、0.51、0.49 mg/g。综合考虑艾纳香素得率和环保因素,最终选择95%乙醇作为提取溶剂。
2.2.2 提取时间的筛选
精密称取艾纳香干燥茎叶粉末20 g,按液料比10∶1(mL/g)加入95%乙醇,于80 ℃分别回流提取1、2、3、4、5、6 h,考察不同提取时间对艾纳香素得率的影响。结果显示,艾纳香素的得率分别为1.36、1.55、1.50、1.47、1.42、1.37 mg/g,以提取2 h的得率最高,故选择提取时间为2 h。结果见图2A。

图2 提取时间、乙醇体积分数、液料比对艾纳香素得率的影响
2.2.3 乙醇体积分数的筛选
精密称取艾纳香干燥茎叶粉末20 g,按液料比10∶1(mL/g)分别加入体积分数为30%、50%、70%、90%、95%的乙醇,于80 ℃回流提取2 h,考察不同体积分数乙醇对艾纳香素得率的影响。结果显示,艾纳香素的得率分别为0.61、1.14、1.25、1.69、1.51 mg/g,以90%乙醇提取的得率最高,故选择乙醇体积分数为90%。结果见图2B。
2.2.4 液料比的筛选
精密称取艾纳香干燥茎叶粉末20 g,分别按液料比10∶1、12∶1、14∶1、16∶1、18∶1、20∶1(mL/g)加入95%乙醇,于80 ℃回流提取2 h,考察不同液料比对艾纳香素得率的影响。结果显示,艾纳香素的得率分别为1.51、1.68、1.72、1.90、1.73、1.42 mg/g,以液料比16∶1(mL/g)的得率最高,故选取液料比为16∶1(mL/g)。结果见图2C。
2.3 Box-Behnken响应面法优化艾纳香素提取工艺
2.3.1 响应面实验的设计及结果
通过单因素实验结果,选择乙醇体积分数(A)、提取时间(B)和液料比(C)作为艾纳香素提取工艺优化的因素,设计合适的因素与水平(表1),并以艾纳香素的得率为响应值(R),利用Box-Behnken Design原理通过Design-Expert 8.0.6 软件设计响应面实验,共进行了17 组实验,结果见表2。用二阶多项式回归模型预测响应值,得到二次多项表达式R=1.94+0.145A+0.002 5B—0.002 5C+0.02AB—0.01BC—0.152A2—0.052B2—0.102C2。对 回归方程进行方差分析,得回归模型的F值为39.615 0,差异显著(P<0.01);失拟项(P>0.05)不显著;模型的相关系数R2=0.98,大于0.9,说明该实验模型与实际实验的相关性较好,可真实反映所考察因素对响应值的影响。结果见表3。

表1 艾纳香素提取工艺响应面实验的因素与水平

表2 艾纳香素提取工艺响应面实验的设计与结果

表3 艾纳香素提取工艺响应面实验的方差分析结果
通过Design-Expert 8.0.6 软件绘制各因素的响应面图及等高线图(图3),并结合方差分析结果进行分析,可得各因素对艾纳香素得率影响的强弱顺序为:A>C>B,即乙醇体积分数>液料比>提取时间;同时预测艾纳香素的最优提取工艺为:乙醇体积分数89.80%,液料比15.17∶1,以80 ℃回流提取2.02 h。为了便于实际操作,本研究对预测的最优提取工艺进行了微调,即得乙醇体积分数90%,液料比15∶1,以80 ℃回流提取2 h;在此条件下,预测艾纳香素的得率为1.98 mg/g。

图3 各因素交互作用对艾纳香素得率影响的等高线及响应面图
2.3.2 验证实验
取艾纳香干燥茎叶粉末40 g,按上述最优提取工艺平行操作3次进行验证实验,所得艾纳香素的得率分别为1.95、1.96、2.00 mg/g,平均得率为1.97 mg/g(RSD=1.34%),与预测值基本相符,说明提取工艺稳定可靠。
2.4 艾纳香素的体外抗菌活性考察
采用微量稀释法进行抗菌活性考察[7]。取艾纳香素(自提)与头孢呋辛钠(阳性对照)以10%二甲基亚砜溶解配制为适宜浓度梯度的溶液,分别取稀释好的化脓链球菌、金黄色葡萄球菌、无乳链球菌、变异链球菌、枯草芽孢杆菌、藤黄微球菌的菌液180 µL与药液20 µL加入96 孔板中,菌液终浓度为105CFU/mL,药物终浓度为1.56~1 600 µg/mL;于37 ℃恒温培养箱中培养24 h,裸眼观察,以孔内液体澄清无沉淀的最小质量浓度为最低抑菌浓度(minimum inhibitory concentration,MIC)。选择艾纳香素MIC 值较小的化脓链球菌与金黄色葡萄球菌测定最低杀菌浓度(minimum bactericidal concentration,MBC),即取上述两种菌2MIC、4MIC、8MIC质量浓度的孔内液体接种于琼脂平板,于37 ℃恒温培养箱中培养24 h,以平板内菌落个数小于4 的最小质量浓度为MBC。结果见表4。
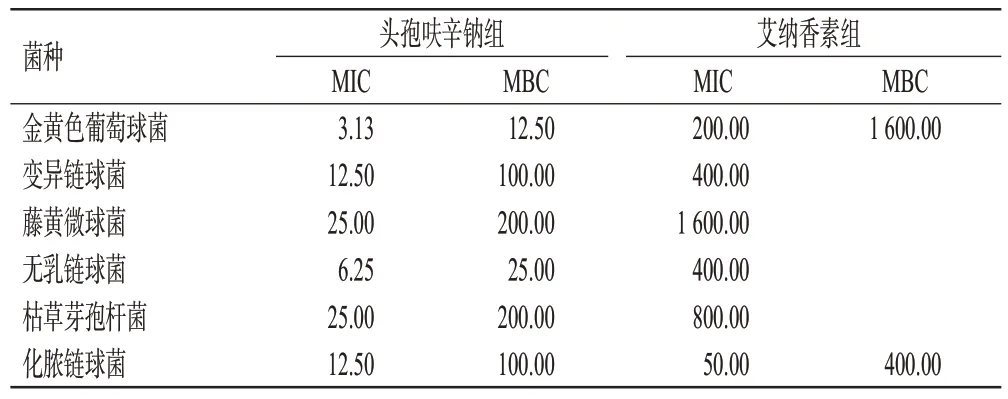
表4 艾纳香素体外抗菌活性考察结果(µg/mL)
由表4可知,上述几种菌株对艾纳香素的敏感度为:化脓链球菌>金黄色葡萄球菌>无乳链球菌=变异链球菌>枯草芽孢杆菌>藤黄微球菌;其中,艾纳香素对化脓链球菌的MIC值达50 µg/mL,仅比头孢呋辛钠对化脓链球菌的MIC值高37.50 µg/mL。
2.5 艾纳香素的消炎活性评价
2.5.1 对二甲苯所致小鼠耳廓肿胀的影响
将50 只昆明小鼠随机分为5 组,即阳性对照组(地塞米松,10 mg/kg),空白对照组,艾纳香素(自提)低、中、高剂量组(7.5、15、30 mg/kg),每组10只。各给药组按上述剂量腹腔注射给药,空白对照组给予等量生理盐水。在给药5 h 后,每只小鼠右耳涂抹30 µL 二甲苯致炎,左耳不涂任何药物。30 min 后处死小鼠,以6 mm 打孔器打下耳片并称重,以左右耳片的差值为耳廓肿胀度[8],并计算肿胀抑制率:肿胀抑制率(%)=(空白对照组平均耳廓肿胀度—药物组平均耳廓肿胀度)/空白对照组平均耳廓肿胀度×100%。平行2次实验。
结果显示,与空白对照组比较,阳性对照组和艾纳香素各剂量组小鼠的耳廓肿胀度均显著降低(P<0.05或P<0.01),但随着艾纳香素剂量的升高,其肿胀抑制率反而下降。与阳性对照组比较,艾纳香素中、高剂量组小鼠的耳廓肿胀度均显著升高(P<0.05或P<0.01)。结果见表5。
表5 艾纳香素对二甲苯所致小鼠耳廓肿胀影响的结果(±s,n=10)

表5 艾纳香素对二甲苯所致小鼠耳廓肿胀影响的结果(±s,n=10)
—:无相应数据;a:与空白对照组比较,P<0.01;b:与阳性对照组比较,P<0.05;c:与空白对照组比较,P<0.05;d:与阳性对照组比较,P<0.01。
组别空白对照组阳性对照组艾纳香素低剂量组艾纳香素中剂量组艾纳香素高剂量组肿胀度/mg 7.28±2.99 1.27±0.89a 1.82±0.61a 3.44±1.25ab 5.10±1.38cd肿胀抑制率/%—82.92 75.03 52.69 29.94
2.5.2 对醋酸所致小鼠毛细血管通透性的影响
取50只昆明小鼠,分组及给药同“2.5.1”项下。在给药5 h后,于小鼠尾静脉注入0.5%伊文思蓝生理盐水溶液10 mL/kg,腹腔注射0.6%醋酸生理盐水溶液0.20 mL,20 min 后处死小鼠,开腹用生理盐水洗涤腹腔,收集洗涤液后加入生理盐水至10 mL,以2 000 r/min 离心15 min,取上清液用酶标仪在590 nm波长处检测吸光度(A)值[8],并计算各组小鼠腹腔毛细血管通透性的抑制率:抑制率(%)=(空白对照组的平均A值—药物组的平均A值)/空白对照组的平均A值×100%。平行2 次实验。
结果显示,与空白对照组比较,阳性对照组和艾纳香素各剂量组小鼠的A值均显著降低(P<0.05 或P<0.01),但随着艾纳香素剂量的升高,其抑制率反而下降。与阳性对照组比较,艾纳香素高剂量组小鼠的A值显著升高(P<0.01),其抑制率降低。结果见表6。
表6 艾纳香素对醋酸所致小鼠毛细血管通透性影响的结果(±s,n=10)

表6 艾纳香素对醋酸所致小鼠毛细血管通透性影响的结果(±s,n=10)
—:无相应数据;a:与空白对照组比较,P<0.01;b:与空白对照组比较,P<0.05;c:与阳性对照组比较,P<0.01。
组别空白对照组阳性对照组艾纳香素低剂量组艾纳香素中剂量组艾纳香素高剂量组A值(×10)3.44±1.16 1.07±0.68a 1.32±0.84a 1.75±0.64a 2.47±0.99bc抑制率/%—68.94 61.64 49.09 28.32
3 讨论
目前艾纳香中已发现的活性成分超过140 种[9],除挥发性成分外,黄酮类化合物艾纳香素也有很好的生物活性,具有一定的开发潜力。对艾纳香素的提取与纯化,目前报道的研究主要围绕纯化方式,而少见提取工艺研究。由于天然产物都是先提取再纯化,因此艾纳香素提取工艺的优化研究对其工业化生产具有重要意义。基于此,本研究以艾纳香素得率为考察指标,在单因素实验的基础上采用Box-Behnken 响应面法进行优化,得到提取艾纳香素的最优工艺为:乙醇体积分数90%,液料比15∶1,以80 ℃回流提取2 h。验证实验表明优化后的提取工艺稳定可靠、重复性好。本研究受限于植物储存量,并未进行更大规模的研究,这也是本研究的不足之处;若该工艺进行中试实验,可能需要进一步调试参数。但该工艺将为艾纳香素的进一步分离纯化提供良好的物质基础,也可为其工业化生产提供参考数据。
本研究为探讨艾纳香素是否存在抗菌消炎活性,采用体外抗菌实验及动物炎症模型进行了评价。大多数天然产物对细菌的MIC值都很大,有的甚至达到了mg/mL级别[10]。本研究发现,艾纳香素对化脓链球菌具有一定的抗菌活性,其MIC为50.00 µg/mL,仅比阳性对照头孢呋辛钠的MIC值高37.5 µg/mL,因此值得被进一步开发成抗菌药物。另外,在艾纳香素消炎活性的考察中,艾纳香素只进行了1次腹腔注射给药,结果就具有良好的消炎活性;但值得注意的是,艾纳香素存在消炎活性与剂量呈负相关的现象。对此,本研究对更低剂量的艾纳香素(3.75 mg/kg)进行了小试,发现该剂量的艾纳香素不具有消炎活性,故推测可能存在高剂量艾纳香素影响体内吸收的情况,这也是未来进一步研究的方向。一定量的艾纳香素与阳性对照地塞米松的作用并无显著差异,这将为艾纳香素的药理学研究提供实验数据,也说明艾纳香素在临床上替代激素类消炎药存在可能性。
综上所述,本研究优化所得的艾纳香素提取工艺稳定可行;所提取的艾纳香素对化脓链球菌具有一定的抗菌活性,且具有良好的消炎活性。
