不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢及脂肪细胞分化的作用研究
2016-07-19杨玉彬
杨玉彬,柯 斌,秦 鉴
·论著·
不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢及脂肪细胞分化的作用研究
杨玉彬,柯 斌,秦 鉴
510080广东省广州市,中山大学附属第一医院中医科
【摘要】目的探讨不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢和脂肪细胞分化的作用。方法2013年10月—2014年3月选取SPF级5周龄Wistar雄性大鼠40只,采用随机数字表法分为两组,空白组(n=5)采用普通饲料喂养,高脂饮食组(n=35)采用高脂饲料喂养。8周后选取高脂饮食组符合胰岛素抵抗肥胖模型造模标准的大鼠,采用随机数字表法分为模型组、热量限制50%组(CR50%组) 、间断禁食组(IF组) 。空白组大鼠继续给予普通饲料,模型组大鼠继续给予高脂饲料,CR50%组大鼠每日高脂饲料供给量为模型组前1 d平均供给量的50%,IF组大鼠给予间断禁食方法,干预时间均为8周。实验结束后处死大鼠,取上层血清检测空腹血糖水平、空腹胰岛素水平、稳态模型胰岛素抵抗指数(HOMA-IR)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)水平。分别采用实时荧光定量反转录-聚合酶链式反应(RT-qPCR)及Western blotting法检测过氧化物酶体增殖剂激活受体(PPAR)α、PPARβ、PPARγ mRNA及其蛋白表达水平。结果造模后,高脂饮食组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR较空白组升高(P<0.05)。干预8周后,模型组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR较空白组升高(P<0.05);CR50%组大鼠空腹血糖水平较模型组降低(P<0.05);IF组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR较模型组和CR50%组降低(P<0.05)。模型组大鼠血清TC、LDL-C水平较空白组升高(P<0.05);CR50%组大鼠血清LDL-C水平较模型组降低(P<0.05);IF组大鼠血清TC水平较模型组降低,血清HDL-C水平较模型组升高,血清LDL-C水平较CR50%组升高(P<0.05)。模型组大鼠PPARβ mRNA及其蛋白表达水平较空白组降低,PPARγ mRNA及其蛋白表达水平较空白组升高(P<0.05);CR50%组、IF组大鼠PPARβ mRNA及其蛋白表达水平较模型组升高,PPARγ mRNA及其蛋白表达水平较模型组降低(P<0.05)。结论CR50%和IF可通过调节脂肪细胞分化的作用,改善胰岛素抵抗肥胖大鼠的糖脂代谢,IF对胰岛素抵抗有更好的改善作用,其作用机制可能是通过PPRA信号转导通路发挥作用。
【关键词】胰岛素抵抗;肥胖症;脂代谢障碍;脂细胞;大鼠
杨玉彬,柯斌,秦鉴.不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢及脂肪细胞分化的作用研究[J].中国全科医学,2016,19(18):2156-2161.[www.chinagp.net]
Yang YB,Ke B,Qin J.Effects of different calorie restriction methods on glycolipid metabolism and adipocytes differentiation in obesity and insulin resistance rat[J].Chinese General Practice,2016,19(18):2156-2161.
胰岛素是由胰岛细胞分泌的内分泌激素,与其受体结合后通过一系列信号传递的网络级联反应,引起基因表达改变,生成效应蛋白,参与体内代谢调节。胰岛素作用的外周靶器官或靶组织主要有肝脏、脂肪组织、骨骼肌。胰岛素抵抗是指胰岛素作用的靶器官对胰岛素作用的敏感性下降。胰岛素抵抗与十余种代谢性疾病有关,包括中心性肥胖、脂代谢紊乱〔高三酰甘油血症和/或高密度脂蛋白胆固醇(HDL-C)水平降低〕、高血压、冠心病、糖代谢异常、2型糖尿病、微量清蛋白尿、非酒精性脂肪性肝病(NAFLD)等,胰岛素抵抗是这些疾病的共同发病基础。1988年,Reaven[1]在美国糖尿病学会(ADA)第48届年会的报告中率先提出了以胰岛素抵抗为基本特征的“X综合征(syndrome X)”概念,这种综合征包括高胰岛素血症、葡萄糖耐量减低、极低密度脂蛋白胆固醇、三酰甘油(TG)、总胆固醇(TC)水平升高、HDL-C水平降低、高血压和冠心病等。1992年DeFronzo[2]将之命名为“胰岛素抵抗综合征(insulin resistance syndrome,IRS)”,强调了在这一综合征诊断中胰岛素抵抗的核心作用。
热量限制是指有计划地减少由食物提供热量的进食方式,一般是指在生物体所摄入营养成分保证其不发生营养不良的情况下,将正常自由进食(ad libitum,AL)的热量按一定比例减少。控制饮食是胰岛素抵抗治疗方案中的重要内容。但是目前国内对胰岛素抵抗热量限制具体方法和量效关系等方面研究较少,尚未见从脂肪细胞分化角度探讨热量限制对胰岛素抵抗作用机制的研究。本研究观察不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢的作用,并从脂肪细胞分化角度探讨热量限制的作用机制。
本研究背景及创新点:
我国自1978年改革开放以来,经济发展取得了举世瞩目的成就,人民生活条件得到极大改善,可是健康状况并没有得到相应的提高。不正确的生活方式导致越来越多慢性代谢性疾病,如肥胖、高血压、糖尿病、血脂异常、代谢综合征等,已成为威胁国民健康的突出问题,而普遍认为,胰岛素抵抗是上述疾病共同的病理基础。目前,针对胰岛素抵抗的一线用药有双胍类、噻唑烷二酮类(TZDs)等。但大量的报道(包括《新英格兰医学》《柳叶刀》等)提到此类药物可能增加心血管事件以及肝损害、肌溶解综合征、患癌风险等不良反应发生率。因此,探索治疗胰岛素抵抗安全有效的药物或方法已成为全球研究热点和亟待解决的难题。热量限制作为一种古老的自然疗法已被证实是改善糖脂代谢、胰岛素抵抗的安全有效的方法,本研究从分子生物学角度探讨热量限制的作用机制。
1材料与方法
1.1实验动物2013年10月—2014年3月选取SPF级5周龄Wistar雄性大鼠40只,购于中山大学动物实验中心,体质量(60±12)g,分笼(4只/笼)饲养于中山大学附属第一医院动物实验中心明暗各12 h的动物实验室内,普通饲料适应性饲养1周。
1.2饲料普通饲料含57.0%无氮浸出物、16.0%蛋白质、9.0%水分、5.0%粗灰分、4.0%维生素和矿物质、4.0%粗纤维、3.0%脂肪、1.3%赖氨酸、0.7%蛋氨酸+胱氨酸,产热系数309 kcal/100 g,由广东省医学实验动物中心提供。高脂饲料含45.2%无氮浸出物、18.0%粗蛋白、16.2%脂肪、8.6%水分、5.0%粗灰分、3.0%粗纤维、2.0%矿物质、1.3%赖氨酸、0.7%蛋氨酸+胱氨酸,产热系数379 kcal/100 g,购于上海斯莱克实验动物有限公司。
1.3胰岛素抵抗肥胖模型造模及干预方法(1)分组:适应性饲养1周后,40只大鼠采用随机数字表法分为两组,空白组(n=5)大鼠采用普通饲料喂养,高脂饮食组(n=35)大鼠采用高脂饲料喂养,均自由饮水,连续喂养8周。(2)胰岛素抵抗肥胖模型造模:8周后采用随机数字表法抽取高脂饮食组大鼠10只及空白组大鼠5只,禁食不禁水12 h,尾静脉采血,测定空腹血糖、空腹胰岛素水平,并计算稳态模型胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5。根据参考文献[3]所述,高脂饮食组大鼠HOMA-IR较空白组明显升高,提示胰岛素抵抗模型造模成功。根据参考文献[4]所述,在胰岛素抵抗模型大鼠中挑选空腹体质量大于空白组大鼠空腹平均体质量20%作为大鼠肥胖的成模标准。(3)干预方法:采用随机数字表法将符合胰岛素抵抗肥胖模型造模标准的肥胖大鼠分为模型组、热量限制50%组(CR50%组)、间断禁食组(IF组)。空白组大鼠继续给予普通饲料;模型组大鼠继续给予高脂饲料;CR50%组大鼠每日高脂饲料供给量为模型组前1 d平均供给量的50%;IF组大鼠给予间断禁食方法,1个周期包括2 d禁食(不禁水),5 d自由进食,共重复8个周期。各组干预时间均为8周。
1.4血液及组织标本的采集干预8周后,禁食12 h,处死大鼠。0.3%戊巴比妥钠(1 ml/100 g)腹腔麻醉,麻醉状态下仰卧位固定大鼠,沿腹正中线逐层打开腹腔,下腔静脉取血约6 ml,4 ℃ 3 000 r/min离心15 min(离心半径8 cm),取上清液,-20 ℃存放,用于检测空腹血糖、空腹胰岛素、血脂〔TC、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)〕水平。快速取肝脏、骨骼肌、内脏脂肪组织(肠系膜、附睾和肾周脂肪)称重,分别剪取部分组织,液氮保存,用于检测基因、蛋白表达水平。
1.5实验室指标检测方法采用微量血糖仪测定空腹血糖水平,采用放射免疫分析法测定空腹胰岛素水平,采用全自动生化分析仪测定血清TC、TG、HDL-C、LDL-C水平。
1.6实时荧光定量反转录-聚合酶链式反应(RT-qPCR)法检测过氧化物酶体增殖剂激活受体(PPAR)α、PPARβ、PPARγ mRNA表达水平RT-qPCR具体步骤:应用Trizol试剂(武汉优尔生科技股份有限公司)提取大鼠内脏脂肪组织细胞总RNA,紫外分光光度试剂盒测定RNA浓度及鉴定纯度。使用PrimeScript RT kit(Takara,大连)将0.5 μg总RNA反转录成cDNA。使用ABI 7500进行qPCR检测。以β-actin作为内参,以PPARα、PPARβ、PPARγ作为目的基因。β-actin上游引物为5′- TGCTATGTTGCCCTAGACTTCG-3′,下游引物为5′- TGCTATGTTGCCCTAGACTTCG-3′,扩增产物长度129 bp;PPARα上游引物为5′- GACGCTGGGTCCTCTGGTT-3′,下游引物为5′- TCAGTCTTGGCTCGCCTCTA-3′,扩增产物长度128 bp;PPARβ上游引物为5′- TCACACAACGCTATCCGTTT-3′,下游引物为5′- TGCACGCCATACTTGAGAAG-3′,扩增产物长度143 bp;PPARγ上游引物为5′- TCCAAGAATACCAAAGTGCG-3′,下游引物为5′- GCTTCAATCGGATGGTTCTT-3′,扩增产物长度135 bp。qPCR反应体系20 μl:蒸馏水(dH2O)7 μl,上、下游引物各1 μl,cDNA 1 μl,Taq酶10 μl。PCR反应条件:95 ℃预变性10 s,95 ℃变性10 s,58 ℃退火5 s,72 ℃延伸10 s,共45个循环。使用2-ΔΔCT法测定目的基因mRNA表达水平。每组重复检测3次取均值。
1.7Western boltting 法检测PPARα、PPARβ、PPARγ表达水平将同组内所有样品进行等量混合以消除组内差异,取混合物50 mg进行液氮研磨,加入150 μl RIPA裂解液及1.5 μl 苯甲基磺酰氟(PMSF)液冰上孵育30 min,4 ℃ 1 500 r/mim离心15 min(离心半径13.5 cm),取上清液,BCA法测定蛋白浓度。每个样本各取50 μg进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),转聚偏氟乙烯(PDVF)膜,5%脱脂牛奶室温封闭1 h,TBST冲洗3次,加入一抗(1∶1 000),4 ℃孵育过夜,HRP偶联的山羊抗兔二抗(1∶3 000)室温孵育1 h,ECL化学发光法在IS 2000 MM图像工作站进行曝光拍照,Molecular Imaging Software Version 4.0(美国Media Cybernetics公司) 软件分析条带灰度值,以β-actin作为内参。每组重复检测3次,取均值。

2结果
2.1空白组与高脂饮食组大鼠造模后空腹血糖水平、空腹胰岛素水平、HOMA-IR比较造模后,高脂饮食组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR较空白组升高,差异有统计学意义(P<0.05,见表1)。高脂饮食组35只大鼠中符合胰岛素抵抗肥胖模型造模标准的大鼠16只,成模率为45.7%。其中模型组5只,CR50%组5只,IF组6只。
2.24组大鼠干预8周后空腹血糖水平、空腹胰岛素水平、HOMA-IR比较干预8周后,空白组、模型组、CR50%组、IF组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR比较,差异均有统计学意义(P<0.05);其中模型组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR较空白组升高,差异均有统计学意义(P<0.05);CR50%组大鼠空腹血糖水平较模型组降低,差异有统计学意义(P<0.05);IF组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR较模型组和CR50%组降低,差异均有统计学意义(P<0.05,见表2)。
2.34组大鼠血脂水平比较干预8周后,空白组、模型组、CR50%组、IF组大鼠血清TC、HDL-C、LDL-C水平比较,差异均有统计学意义(P<0.05);其中模型组大鼠血清TC、LDL-C水平较空白组升高,差异均有统计学意义(P<0.05);CR50%组大鼠血清LDL-C水平较模型组降低,差异有统计学意义(P<0.05);IF组大鼠血清TC水平较模型组降低,血清HDL-C水平较模型组升高,血清LDL-C水平较CR50%组升高,差异均有统计学意义(P<0.05,见表3)。
2.44组大鼠PPARα、PPARβ、PPARγ mRNA及其蛋白表达水平比较空白组、模型组、CR50%组、IF组大鼠PPARα mRNA及其蛋白表达水平比较,差异均无统计学意义(P>0.05)。空白组、模型组、CR50%组、IF组大鼠PPARβ、PPARγ mRNA及其蛋白表达水平比较,差异均有统计学意义(P<0.05);其中模型组大鼠PPARβ mRNA及其蛋白表达水平较空白组降低,PPARγ mRNA及其蛋白表达水平较空白组升高,差异均有统计学意义(P<0.05);CR50%组、IF组大鼠PPARβ mRNA及其蛋白表达水平较模型组升高,PPARγ mRNA及其蛋白表达水平较模型组降低,差异均有统计学意义(P<0.05,见表4)。
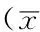
Table 1Comparison of levels of FBG,fasting insulin and HOMA-IRbetween control group and HFT group after modeled
注:HOMA-IR=稳态模型胰岛素抵抗指数
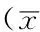
Table 2Comparison of levels of FBG,fasting insulin and HOMA-IR among four groups of rats after 8 weeks
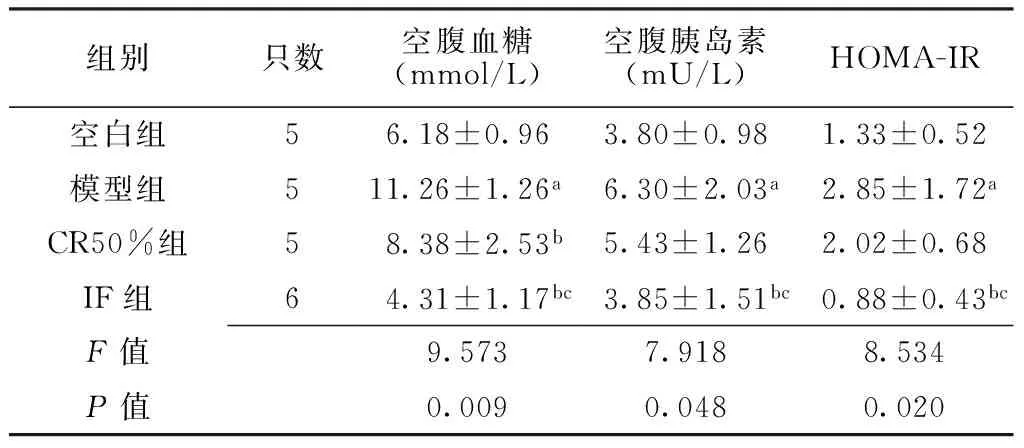
组别只数空腹血糖(mmol/L)空腹胰岛素(mU/L)HOMA-IR空白组56.18±0.963.80±0.981.33±0.52模型组511.26±1.26a6.30±2.03a2.85±1.72aCR50%组58.38±2.53b5.43±1.262.02±0.68IF组64.31±1.17bc3.85±1.51bc0.88±0.43bcF值9.5737.9188.534P值0.0090.0480.020
注:CR50%=热量限制50%,IF=间断禁食;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与CR50%组比较,cP<0.05
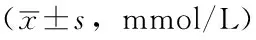
表3 4组大鼠血脂水平比较
注:TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与CR50%组比较,cP<0.05

表4 4组大鼠PPARα、PPARβ、PPARγ mRNA及其蛋白表达水平比较
注:PPAR=过氧化物酶体增殖剂激活受体;与空白组比较,aP<0.05;与模型组比较,bP<0.05
3讨论
大量研究已证实,热量限制可增强胰岛素敏感性[5],降低空腹血糖、空腹胰岛素、血脂水平[6],改善炎症状态,减少动脉粥样硬化和冠心病发生风险[7]。在超重或肥胖人群中,热量限制能改善胰岛素抵抗,降低2型糖尿病发病率[8]。除此之外,热量限制还可以降低心血管疾病、神经系统疾病、肿瘤等发病率[9]。本研究中发现,CR50%组大鼠空腹血糖水平较模型组降低,但空腹胰岛素水平及HOMA-IR与模型组无差异,提示CR50%对空腹血糖的控制较好,但对空腹胰岛素及胰岛素敏感性的提高有待进一步探讨。与CR50%组比较,IF组大鼠空腹血糖水平、空腹胰岛素水平、HOMA-IR均明显降低,提示在改善糖代谢、胰岛素抵抗方面,IF可能比热量限制更有优势。
既往研究关于肥胖、胰岛素抵抗与血清LDL-C水平的线性回归分析发现,两者与血清LDL-C水平呈高度正相关,提示随着肥胖和胰岛素抵抗严重程度增加,血清LDL-C水平升高,脑血管疾病的发生风险也明显增加[10]。人体试验和动物实验均证实,TC和LDL-C是动脉粥样硬化的独立危险因素[11],降低TC水平可以降低脑血管疾病患者病死率[12],而HDL-C是机体的保护因素,可以回收体内衰老细胞和死亡细胞上的胆固醇,并将其运送至肝脏而被代谢和清除,血清HDL-C水平升高可降低动脉粥样硬化的发生风险。在本研究中,模型组大鼠血清TC、LDL-C水平较空白组升高,说明高脂饮食可以诱导胰岛素抵抗肥胖模型大鼠的脂代谢紊乱;与模型组和IF组比较,CR50%组大鼠血清LDL-C水平降低,提示长期低热量饮食可通过降低血清LDL-C水平进而降低动脉粥样硬化、脑血管疾病的患病风险;与模型组比较,IF组大鼠血清TC水平降低,HDL-C水平升高,提示IF可能具有较好的心血管保护作用。
根据脂肪组织的形态和功能划分,人体有两种脂肪组织,白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)[13]。WAT是以TG的形式储存能量,主要由大量蕴含丰富脂滴的白色脂肪细胞组成。当机体能量摄入不足时,WAT通过释放游离脂肪酸的形式供能;当机体能量过剩时,多余的能量以脂肪形式储存,导致脂肪细胞数量的增加和体积的过度增大,最终导致肥胖。肥胖的发生是遗传、基因突变、饮食、行为等因素综合作用的结果,其核心环节在于脂肪细胞的过度增殖和分化,产生了过多的WAT[14]。肥胖是糖尿病、冠心病、动脉粥样硬化、高血压、高脂血症等多种疾病的共同危险因素,因此近十年来,脂肪细胞分化逐渐成为肥胖和糖尿病等代谢性疾病研究领域所关注的热点问题。脂肪细胞分化与肥胖、胰岛素抵抗有着密切的关系[14]。通过调节WAT内脂肪细胞的大小和体积、减少脂肪促炎因子的分泌,是改善胰岛素抵抗的有效途径。
PPAR作为核受体超家族的成员,是一种激素激活核受体和转录因子,目前已知有3种亚型:PPARα、PPARβ/δ和PPARγ。PPAR是调节脂肪细胞生成、胰岛素敏感性、炎性反应、脂质代谢、细胞生长和分化的重要因子[15],其中PPARα主要存在于与脂肪酸分解代谢密切相关的组织中,包括肝脏、肾脏、心脏以及肌肉中。PPARα在脂代谢中发挥重要作用,激活 PPARα 可上调ApoA-Ⅴ表达水平,下调ApoC-Ⅲ表达水平,由此减少乳糜微粒和极低密度脂蛋白(VLDL)对TG的运送情况[16]。具有PPARα活性的贝特类调脂药物目前广泛用于高脂血症的治疗[17],本研究结果显示,各组大鼠PPARα mRNA及其蛋白表达水平无差异,分析原因可能为PPARα主要分布在肝脏、肾脏、心脏以及肌肉,在脂肪中表达极低,因此未出现组间差异。PPARβ广泛分布在人体各组织中,PPARβ激活后可促进脂肪和肌肉组织中的脂肪酸β氧化,通过抑制STAT3的转录活性,参与白介素6(IL-6)介导的肝脏胰岛素抵抗的形成[18],因此PPARβ有望成为开发胰岛素抵抗药物新的有效靶点[19]。研究发现,PPARβ活化可以升高血清HDL-C水平,降低血清TC水平、改善高脂饮食诱发的肥胖及糖代谢紊乱[20]。本研究结果显示,模型组大鼠内脏脂肪组织PPARβ mRNA及其蛋白表达水平较空白组降低,CR50%组和IF组大鼠内脏脂肪组织PPARβ mRNA及其蛋白表达水平较模型组均升高,这可能是热量控制可以提高胰岛素抵抗肥胖模型大鼠血清HDL-C水平的机制之一。
PPARγ基因转录时由于所用启动子和拼接方式的不同产生PPARγ1、PPARγ2 和PPARγ3 3种不同的亚型,PPARγ2主要在脂肪组织中表达,是脂肪细胞分化过程中的关键转录调节因子,除此之外还参与脂肪酸氧化和脂质代谢[21],噻唑烷二酮类降糖药(thiazolidinediones,TZDs)作为PPARγ的激活剂广泛用于糖尿病的治疗。本研究推测在高脂饮食的诱导下,胰岛素抵抗肥胖大鼠内脏脂肪细胞中被激活的PPARγ启动了脂肪细胞内基因转录和分化调控,促进了前脂肪细胞过度增殖和分化。因此,本研究通过高脂饮食成功诱导建立了胰岛素抵抗肥胖大鼠模型,其机制可能是促进了前脂肪细胞增殖和过度分化,这可能是模型大鼠肥胖、胰岛素抵抗及糖脂代谢紊乱的机制之一。本研究中模型组大鼠PPARγ mRNA及其蛋白表达水平较空白组升高,而CR50%组、IF组大鼠PPARγ mRNA及其蛋白表达水平较模型组降低,提示CR50%和IF两种热量限制的干预方法可能抑制了前脂肪细胞增殖,减少了脂肪细胞数量,降低了内脏脂肪含量,减轻了脂毒性,进一步调节了糖脂代谢和改善了胰岛素抵抗。
本课题组前期研究已证明,热量限制不良反应少,安全可行,能明显改善胰岛素抵抗、降低体质指数、调节糖脂代谢[22]。本研究中也发现,热量限制能降低空腹血糖、空腹胰岛素水平,改善胰岛素抵抗,改善脂肪代谢,其机制可能与通过抑制被激活的PPARγ,抑制内脏脂肪组织的过度增殖和分化有关,但其内在的分子机制尚需进一步研究。
综上所述,热量限制作为胰岛素抵抗肥胖大鼠治疗环节的首要内容,伴随着治疗的始末。本研究初步探讨了不同热量限制对胰岛素抵抗肥胖大鼠的作用效应及可能机制,临床中可根据患者能量代谢情况设置不同的热量限制方法。
作者贡献:杨玉彬进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;柯斌进行实验实施、评估、资料收集;秦鉴进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Reaven GM.Role of insulin resistance in human disease[J].Diabetes,1988,37(12):1595-1607.
[2]DeFronzo RA.Insulin resistance,hyperinsulinmia,and coronary heart disease:a complex metabolic web[J].J Cardiovasc Pharacol,1992,20(Suppl 11):S1-16.
[3]Wang JY,Gao YL,Zuo L,et al.High-glucose and high-fat diet induced insulin resistance rat model and its evaluation[J].Journal of South-Central University for Nationalities(Natural Science Edition),2013,32(1):54-57.(in Chinese)
王继勇,高云丽,左洛,等.高糖高脂饮食诱导大鼠胰岛素抵抗模型和评价[J].中南民族大学学报:自然科学版,2013,32(1):54-57.
[4]Tang JH,Yan HD.Establishment and evaluation of rats model with nutritional obesity[J].Journal of Tongji University(Medical Science),2010,31(1):32-34.(in Chinese)
汤锦花,严海东.营养性肥胖大鼠模型的建立及评价[J].同济大学学报:医学版,2010,31(1):32-34.
[5]Baumeier C,Kaiser D,Heeren J,et al.Caloric restriction and intermittent fasting alter hepatic lipid droplet proteome and diacylglycerol species and prevent diabetes in NZO mice[J].Biochim Biophys Acta,2015,1851(5):566-576.
[6]Omodei D,Fontana L.Calorie restriction and prevention of age-associated chronic disease[J].FEBS Lett,2011,585(11):1537-1542.
[7]Bales CW,Kraus WE.Caloric restriction:implications for human cardiometabolic health[J].J Cardiopulm Rehabil Prev,2013,33(4):201-208.
[8]Sung MM,Dyck JR.Age-related cardiovascular disease and the beneficial effects of calorie restriction[J].Heart Fail Rev,2012,17(4/5):707-719.
[9]Ryder JR,Vega-López S,Djedjos CS,et al.Abdominal adiposity,insulin resistance,and oxidized low-density lipoproteins in Latino adolescents[J].Diabetol Metab Syndr,2013,5(1):72.
[10]Wilkins JT,Li RC,Sniderman A,et al.Discordance between apolipoprotein B and LDL-Cholesterol in young adults predicts coronary artery calcification:the CARDIA study[J].J Am Coll Cardiol,2016,67(2):193-201.
[11]Zhu CG,Zhang Y,Xu RX,et al.Circulating non-HDL-C levels were more relevant to atherogenic lipoprotein subfractions compared with LDL-C in patients with stable coronary artery disease[J].J Clin Lipidol,2015,9(6):794-800.
[12]Mazalin Protulipac J,Sonicki Z,Reiner Z.Cardiovascular disease(CVD) risk factors in older adults-perception and reality[J].Arch Gerontol Geriatr,2015,61(1):88-92.
[13]Hilton C,Karpe F,Pinnick KE.Role of developmental transcription factors in white,brown and beige adipose tissues[J].Biochim Biophys Acta,2015,1851(5):686-696.
[14]Alponti RF,Silveira PF.Adipocyte aminopeptidases in obesity and fasting[J].Mol Cell Endocrinol,2015,415:24-31.
[15]Mello T.Nuclear receptors in the regulation of lipid metabolism[J].Curr Cardiovasc Risk Rep,2010,4(2):142-149.
[16]Desai NK,Ooi EM,Mitchell PD,et al.Metabolism of apolipoprotein A-Ⅱ containing triglyceride rich ApoB lipoproteins in humans[J].Atherosclerosis,2015,241(2):326-333.
[17]Liu S,Hatano B,Zhao M,et al.Role of peroxisome proliferator-activated receptor δ/β in hepatic metabolic regulation[J].J Biol Chem,2011,286(2):1237-1247.
[18]Serrano-Marco L,Barroso E,El Kochairi I,et al.The peroxisome proliferator-activated receptor(PPAR) β/δ agonist GW501516 inhibits IL-6-induced signal transducer and activator of transcription 3(STAT3) activation and insulin resistance in human liver cells[J].Diabetologia,2012,55(3):743-751.
[19]Bojic LA,Burke AC,Chhoker SS,et al.Peroxisome proliferator-activated receptor δ agonist GW1516 attenuates diet-induced aortic inflammation,insulin resistance,and atherosclerosis in low-density lipoprotein receptor knockout mice[J].Arterioscler Thromb Vasc Biol,2014,34(1):52-60.
[20]Tenenbaum A,Fisman EZ.Balanced pan-PPAR activator bezafibrate in combination with statin:comprehensive lipids control and diabetes prevention?[J].Cardiovasc Diabetol,2012,11:140.
[21]Tontonoz P,Hu E,Spiegelman BM.Stimulation of adipogenesis in fibroblasts by PPAR gamma 2,a lipid-activated transcription factor[J].Cell,1994,79(7):1147-1156.
[22]Yang YB,Qin J,Ke B,et al.Effect of linguizhugan decoction on hyperlipidemia rats with intermittent fasting[J].J Tradit Chin Med,2013,33(2):250-252.
(本文编辑:陈素芳)
Effects of Different Calorie Restriction Methods on Glycolipid Metabolism and Adipocytes Differentiation in Obesity and Insulin Resistance Rat
YANGYu-bin,KEBin,QINJian.
DepartmentofTraditionalChineseMedicine,theFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China
【Abstract】ObjectiveTo explore the effects of different calorie restriction methods on glycolipid metabolism and adipocytes differentiation in obesity and insulin resistance(IR) rat.MethodsFrom October 2013 to March 2014,40 Wistar male of SPF grade rats aged 5 weeks were randomly divided into control group(n=5) and high fat diet(HFD) group(n=35) by random number table method.Rats in control group were fed with standard diet,and rats in HFD group were fed with high fat diet.Obesity & IR rats were randomly divided into three groups by random number table method:model group,CR50% group and IF group.Rats in control group were keep on fed with standard diet,and rats in model group were keep on fed with high fat diet,Diet supplied for CR50% group was one half that of model group,rats in IF group were fed with incontinuous diet,8 weeks.After the experiment,all rats were sacrificed.Serum levels of FBG,fasting insulin,homeostasis model assessment for insulin resistance(HOMA-IR),total cholesterol(TC),triglyceride(TG),low density lipoprotein-cholesterol(LDL-C) and high density lipoprotein-cholesterol(HDL-C) were measured.Expression levels of mRNA and protein of PPARα,PPARβ,PPARγ were determined by RT-qPCR and Western blotting.ResultsAfter modeled,levels of FBG,fasting insulin and HOMA-IR of rats in HFD group were significantly higher than those of rats in control group(P<0.05).After 8 weeks,levels of FBG,fasting insulin and HOMA-IR of rats in model group were significantly higher than those in control group(P<0.05).FBG level of rats in CR50% group were significantly lower than that in model group(P<0.05).Levels of FBG,fasting insulin and HOMA-IR of rats in IF group were significantly lower than those in model group and CR50% group(P<0.05).Levels of TC and LDL-C of rats in model group were significantly higher than those in control group(P<0.05).LDL-C level of rats in CR50% group was significantly lower than that in model group(P<0.05).TC level of rats in IF group was significantly lower than that in model group,HDL-C level of rats in IF group was significantly higher than that in model group,LDL-C level of rats in IF group was significantly higher than that in CR50% group(P<0.05).Expression levels of mRNA and protein of PPARβ in model group were significantly lower than those in control group,expression levels of mRNA and protein of PPARγ in model group were significantly higher than those in control group(P<0.05).Expression levels of mRNA and protein of PPARβ in CR50% group and IF group were significantly higher than those in model group,expression levels of mRNA and protein of PPARγ in CR50% group and IF group were significantly lower than those in model group(P<0.05).ConclusionFor obesity and IR rats,CR50% and IF can improve their glycolipid metabolism by adjusting adipocyte differentiation,IF can improve insulin resistance better.The mechanism may be related to PPRA signal transduction pathway.
【Key words】Insulin resistance;Obesity;Lipid metabolism disorders;Adipocytes;Rats
基金项目:广东省自然科学基金博士科研启动项目(2014A030310249);广东省中医药管理局科研课题(20151160)
通信作者:秦鉴,510080广东省广州市,中山大学附属第一医院中医科;E-mail:myxs32@126.com
【中图分类号】R 589.25
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.18.009
(收稿日期:2015-08-16;修回日期:2016-03-02)
