前列腺素E1/目标温度控制联合干预措施对心肺复苏后大鼠微血栓形成抑制效应的初步探讨*
2016-06-24赖世超
魏 薇,赖世超,谢 勇,聂 虎
四川大学华西医院 急诊科(成都 610041)
·论著·
前列腺素E1/目标温度控制联合干预措施对心肺复苏后大鼠微血栓形成抑制效应的初步探讨*
魏薇,赖世超,谢勇,聂虎△
四川大学华西医院 急诊科(成都 610041)
【摘要】目的探讨前列腺素E1(PGE1)和目标温度控制(TTM)联合策略对心跳骤停后成功复苏大鼠的微血栓广泛形成的抑制效应。方法采用经食道交流电致颤方式,建立大鼠心肺复苏模型。设立空白对照组(B组,n=14),另将56只成功复苏的恢复自主循环(ROSC)大鼠随机分为4组:ROSC对照组(R组,n=14)、PGE1干预组(P组,n=14)、TTM干预组(T组,n=14)和PGE1/TTM联合干预组(PT组,n=14)。分别在0.5、4、8 h 3个时间点,对每组5只大鼠进行血小板计数、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(Fib)、血栓调节蛋白(TM)和D-dimer的 ELISA检测。每个时间点,每组处死3只大鼠,进行心肌组织苏木精伊红(HE)染色以及血管内皮钙黏蛋白(VE-cadherin)mRNA的PCR检测。实验结束时,对每组处死的大鼠进行心肌组织VE-cadherin/血管内皮生长因子受体(VEGFR)荧光双染。结果PGE1、TTM及其联合干预措施可以不同程度地减少心肌组织微血栓的形成,缓解微血管内皮细胞VE-cadherin蛋白的破坏,并在复苏后0.5 h有效抑制VE-cadherin mRNA表达水平的上升(P<0.05),且以PT组更为明显。3种干预方式都能减缓复苏后血浆TM和D-dimer水平的陡然上升(P<0.05),且联合干预措施较单独干预措施的抑制效应更加突出(P<0.05)。结论 PGE1和TTM能够通过不同的抗凝途径和内皮细胞保护效应来改善微血管内血栓的广泛形成,且二者联合治疗可能存在协同作用。
【关键词】心肺复苏;前列腺素E1; 目标温度控制; 微血栓形成
据统计,院外心跳骤停(out hospital cardiac arrest, OHCA)的发生率约为每年92~189/10万人[1]。现代急救技术的迅猛发展可使心跳骤停患者在短期内恢复自主循环(return of spontaneous circula-tion, ROSC),但是,在后续治疗期间伴发的涉及多器官、多系统的缺血再灌注损伤,使得心跳骤停患者的远期康复率并不理想。其中,凝血和纤溶系统的紊乱在心跳骤停后综合征(post cardiac arrest syndrome, PCAS)的发病机制中扮演重要角色[2]。心跳骤停后,生理状态下的凝血/纤溶平衡不断遭受摧毁。研究[3]已证实,心脏骤停后的缺血再灌注损伤可导致内皮细胞功能受损、血小板激活、弥漫性血管内凝血、相对的纤溶下降以及广泛性的微循环血栓形成倾向。临床研究[4]结果显示,凝血的激活与纤溶的停滞严重影响PCAS患者的后期器官功能恢复。中性粒细胞弹性蛋白酶介导的纤溶激活无法战胜复苏后的纤溶停滞,这将导致多器官功能衰竭(multiple organs dysfunction syndrome, MODS)的发生发展。 迄今为止,对于心跳骤停患者,常规使用抗凝治疗不仅没有显示出良好的抗血栓效用,且大大增加出血风险[2]。因此,探寻减缓凝血/纤溶平衡失调的治疗方法将具有很重要的临床意义。
目标温度控制(target temperature manage-ment, TTM)在经历了数年的争论后,目前被认为是一种能够确切改善死亡率和神经学预后的治疗方法。根据一系列大规模的临床实验结果,2015年美国心脏病协会(American heart association, AHA)发布的心肺复苏指南中,更是明确提出了“对心跳骤停ROSC后的昏迷患者使用TTM”的建议[5]。低温可以降低血小板的数量和功能,抑制酶的激活,减少大量凝血因子产生,从而改善微循环,阻止心跳骤停后微血栓的形成[2]。但是,TTM实施期间给予的亚低温并不能完全、彻底地纠正复苏后的微循环障碍。此外,在探寻PCAS的一系列综合性的治疗措施时,需要考虑TTM期间对其他药物代谢和效用的影响。
前列腺素E1(prostaglandin E1, PGE1)是一种天然前列腺素类物质。除了明显扩张血管的作用之外,还有抑制血小板聚集、降低血液粘滞度和红细胞聚集、保护血管内皮细胞等效用,使其在缺血再灌注期间,也能明显改善多个脏器的微循环[6]。 PGE1通过抑制上调细胞内腺苷酸环化酶(adenylate cyclase, AC),促进细胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的产生和钙离子释放,从而具备潜在拮抗血小板的作用[7]。但对心跳骤停后形成的微血栓,PGE1是否仍然具有抑制效应,目前尚无相关研究。
本研究旨在利用大鼠心跳骤停复苏模型,初步探讨联合使用PGE1和TTM治疗,能否使复苏后缺血再灌注损伤引起的微血栓形成得以改善。
1材料和方法
1.1实验动物
清洁级健康成年雄性Sprague-Dawley大鼠,12~14周龄,体质量(370±20) g,由四川达硕生物科技有限公司提供。动物饲养于四川大学华西医院实验动物中心,实验前适应性饲养1周,明暗周期12 h,自由取食和饮水,分笼饲养,每笼5只,室温(20±2)℃,相对湿度40%~60%。
1.2主要试剂
主要实验试剂包括5 μg/mL前列地尔注射液(北京泰德制药有限公司)、VE-cadherin 抗体和大鼠D-dimer ELISA试剂盒(Cell Signaling Technology公司,美国)、大鼠血栓调节蛋白(thrombomodulin, TM)、 ELISA试剂盒(Abcam公司,香港)、VEGFR抗体(Bioworld公司,美国)。RNA提取RNAprep pure试剂盒,反转录Quant cDNA和荧光定量以及SuperReal PreMix试剂盒购自北京天根生化科技有限公司。
1.3实验动物模型建立
使用Select Secure Model 3830双极心脏起搏电极导线用于诱发室颤(Medtronic公司,美国)。采用频率50 Hz,电流量6 mA,波宽4 ms的电流参数,将SD大鼠经食道进行电击致颤。持续电击150 s以后,维持至4 min,建立大鼠心跳骤停模型[8]。此后,采用自行设计并制作的小动物胸外按压器,对心跳骤停大鼠以200 次/min的频率进行胸外按压。分离右侧股动脉置管,连接测压管监测动脉压。复苏时间为按压开始至大鼠平均动脉压(mean arterial pressure, MAP)达到60 mm Hg后停止按压的时间。所有大鼠的复苏时间不超过1 min。大鼠ROSC的判定标准为MAP达到60 mm Hg以上,并持续10 min,从而建立大鼠心跳骤停后ROSC模型[9]。 将体温探头置入大鼠肛门,监测肛温。
1.4实验分组及流程
设立空白对照组(B组,n=14),将56只成功建立心肺复苏ROSC模型的大鼠随机分4组,ROSC对照组(R组,n=14),PGE1干预组(P组,n=14),按照1 ug/kg 剂量将PGE1配置成为1 mL溶液,采用微泵以1 mL/min的速度匀速泵入,TTM干预组(T组,n=14),采用体外物理降温的方式在0.5 h内将大鼠体温降低至(33±1)℃,PGE1/TTM联合干预组(PT组,n=14),诱导亚低温同时亦给予PGE1。分别在0.5、4、8 h3个时间点,从每组的5只大鼠左侧股静脉置管中抽取静脉血进行血小板计数、凝血酶原时间(prothrombin time, PT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、纤维蛋白原(fibrinogen,Fib)、血栓调节蛋白(thrombomodulin, TM)和D-dimer的ELISA检测。在每个时间点处死3只大鼠,取心肌组织,进行苏木精伊红(hematoxylineosin, HE)染色以及血管内皮钙黏蛋白(vascular Endothelial Cadherin, VE-cadherin)mRNA PCR检测。在8 h时间点,对每组处死的大鼠进行心肌组织VE-cadherin/血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)荧光双染。
1.5组织病理学观察
对心肌组织进行常规石蜡切片。HE染色后,在光镜下观察细胞水肿、炎性细胞浸润、坏死及微血栓的形成情况。
1.6组织免疫荧光染色
将处死大鼠的心肌组织进行VE-cadherin/ VEGFR荧光双染后,比较心肌组织中微血管内皮细胞VE-cadherin蛋白的表达情况,从而反映微血管内皮的损伤程度。
1.7组织匀浆荧光定量-PCR
用动物组织总RNA提取试剂盒提取心肌组织RNA。采用紫外分光光度法测定核酸含量和纯度完成RNA定量检测,并通过2%琼脂糖电泳观察28、18、5 s条带比例,进行所提取RNA的质量检测,从而完成RNA鉴定。用荧光定量PCR试剂盒进行反转录和定量扩增,记录扩增结果,计算目的基因相对于内参Actin的表达倍数,然后分析比较试验组与对照组基因表达的差异,测定心肌组织匀浆中VE-cadherin和VCAM-1的mRNA表达水平。
1.8数据统计学分析
2结果
2.1各组大鼠生理特征基线
复苏前,各组大鼠的体质量、心率、MAP和肛温生理特征值比较,差异无统计学意义(P>0.05);复苏后,各组大鼠的心率、MAP和肛温较复苏前有所下降,但差异无统计学意义(P>0.05)。除B组外,其他各组大鼠的复苏时间差异无统计学意义(P>0.05)(表1)。
2.2大鼠心脏组织的HE染色
B组大鼠的心肌纤维排列整齐,可见分支,细胞核位于肌纤维中央,心肌及间质未见明显血栓和炎性细胞浸润。复苏后,各组大鼠的心肌细胞排列稀疏,心肌细胞纤维呈波浪状,心肌纤维出现断裂、溶解、坏死,横纹不清晰,间质水肿明显,间隙增大,可见少量炎性细胞浸润。微血管内可见明显增多的微血栓,以R组为甚。随着时间的延长,P组、T组和PT组的微血栓形成有所缓解,且以PT组更加明显(图1)。
2.3血小板计数和凝血检测
在0.5、4、8 h时间点,对每组的5只大鼠抽取静脉血进行血小板计数和凝血检测。不同干预措施下,各组的血小板计数、PT、APTT以及Fib的变化如下(表2)。
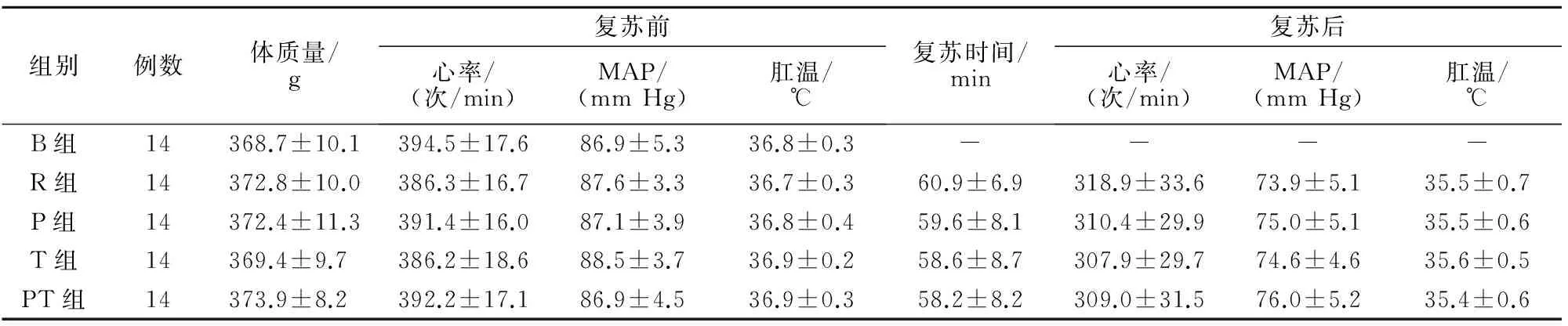
表1 各组大鼠生理特征基线
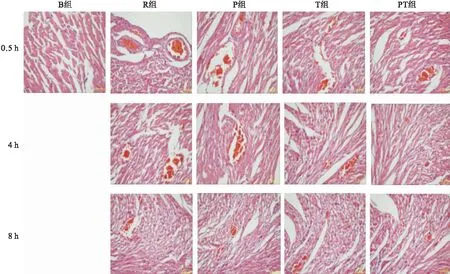
图1不同干预措施对ROSC大鼠心脏组织HE染色的影响
2.3.1血小板计数ROSC后,R组大鼠血小板计数较B组明显下降(P<0.05),并随着时间的延长而更加明显。P组和PT组血小板计数下降幅度较缓,相较B组差异无统计学意义(P>0.05),到8 h时间点,P组和PT组与R组差异有统计学意义(P<0.05)。T组大鼠血小板计数下降程度与R组相似,在4、8 h时间点与B组、P组差异有统计学意义(P<0.05)。结果显示,复苏后缺血再灌注期间,大鼠血小板数量明显减少,PGE1在复苏后8 h能明显延缓血小板计数的下降,而TTM对血小板计数影响差异无统计学意义(P>0.05)。
2.3.2PT时间在0.5 h时间点,各组之间差异无统计学意义(P>0.05)。4 h时间点,R组和T组的PT时间相较B组明显延长(P<0.05),且T组比R组延长更为明显(P<0.05)。P组的PT时间与R组和B组差异无统计学意义(P>0.05),但在4、8 h时间点,与T组和PT组差异有统计学意义(P<0.05)。可以看出,TTM能在ROSC的基础上明显延长PT时间,而PGE1能在一定程度上缓冲TTM对PT时间的延长。
2.3.3APTT时间APTT时间的变化不同于PT时间。0.5 h时间点,仅有TTM显示出延长APTT的作用,因而使T组与B组和R组差异有统计学意义(P<0.05),而此时PT组与R组差异有统计学意义(P<0.05)。随着时间延长,各组与B组之间差异有统计学意义(P<0.05),但各干预组之间差异无统计学意义(P>0.05)。这说明除了在TTM诱导早期,其后无论是TTM还是PGE1对APTT都没有明显影响。
2.3.4Fib的变化ROSC复苏4 h后,R组的Fib含量相较B组明显下降(P<0.05)。而在各个时间点,T组和PT组显示出的对Fib的影响(P<0.05),表明TTM会将Fib的减少提前至复苏后0.5 h。PGE1在8 h时间点能明显缓解R组和T组的Fib下降(P<0.05)。
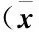
表2 不同干预措施对血小板计数和凝血参数的影响±s)
注:与B 组比较,#P<0.05;与 R 组比较,*P<0.05;与 P 组比较,&P<0.05;与 T 组比较,△P<0.05
2.4大鼠心脏微血管内皮细胞VE-cadherin水平
使用VEGFR免疫荧光标记血管内皮细胞为绿色,VE-cadherin标记物为红色,当血管内皮细胞表达VE-cadherin时,两种荧光叠加为粉红色。结果显示,B组VE-cadherin蛋白在心脏微血管内皮细胞表达均匀、清晰。复苏后,R组表达明显减少,而P组和T组均有少部分表达,PT组表达数量较两种干预措施单独作用时有所增多(图2)。
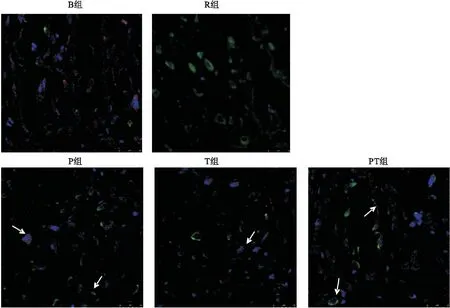
图2不同干预措施对ROSC大鼠心脏组织微血管内皮细胞VE-cadherin表达的影响
2.5大鼠心脏组织VE-cadherin mRNA表达水平
复苏后心脏组织VE-cadherin mRNA表达水平陡然上升,0.5、4 h时间点,R组、P组、T组和PT组均与B组差异有统计学意义(P<0.05)。但随着时间延长,干预组的VE-cadherin mRNA表达水平逐渐下降,8 h时间点,仅有P组与B组差异有统计学意义(P<0.05)。在0.5 h时间点,P组、T组和PT组与R组差异有统计学意义(P<0.05),各干预组之间差异无统计学意义(P>0.05)(图3)。
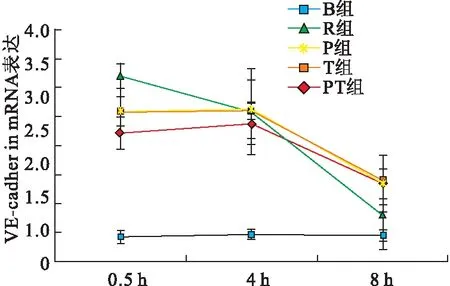
图3不同干预措施下大鼠脑组织VE-cadherin mRNA表达水平
2.6ROSC大鼠血浆TM水平的变化
在0.5、4、8 h 3个时间点,各组之间总体方差分析结果差异有统计学意义(P<0.05)。除8 h时间点,B组与PT组差异无统计学意义(P>0.05)外,0.5、4 h时间点,B组与其他组差异有统计学意义(P<0.05)。在3个时间点,P组、T组和PT组的TM水平明显比R组降低,差异有统计学意义(P<0.05),且PT组明显比采用单独干预措施的P组和T组的效果更加明显(P<0.05)(图4)。
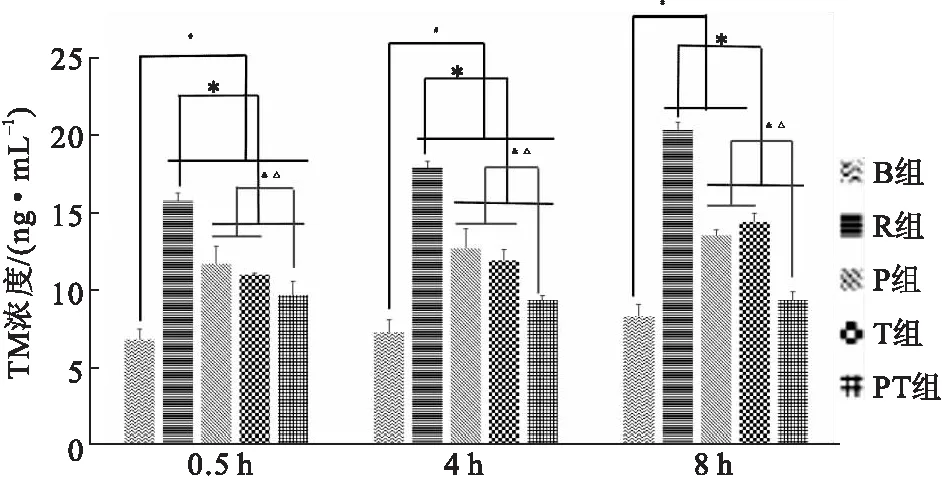
图4不同干预措施对ROSC大鼠TM水平的影响
注: 与B组比较,#P<0.05;与 R 组比较,*P<0.05;与 P 组比较,&P<0.05;与T组比较,△P<0.05
2.7大鼠D-dimer的变化
复苏后,各组大鼠的D-dimer水平迅速提升。在3个时间点,3种干预方式都能减缓R组D-dimer水平的陡然上升,故R组与P组、T组和PT组之间差异有统计学意义(P<0.05)。同时,采用联合干预措施的PT组较单独干预措施的P组和T组对D-dimer水平升高的抑制效应更加突出,差异有统计学意义(P<0.05)(图5)。
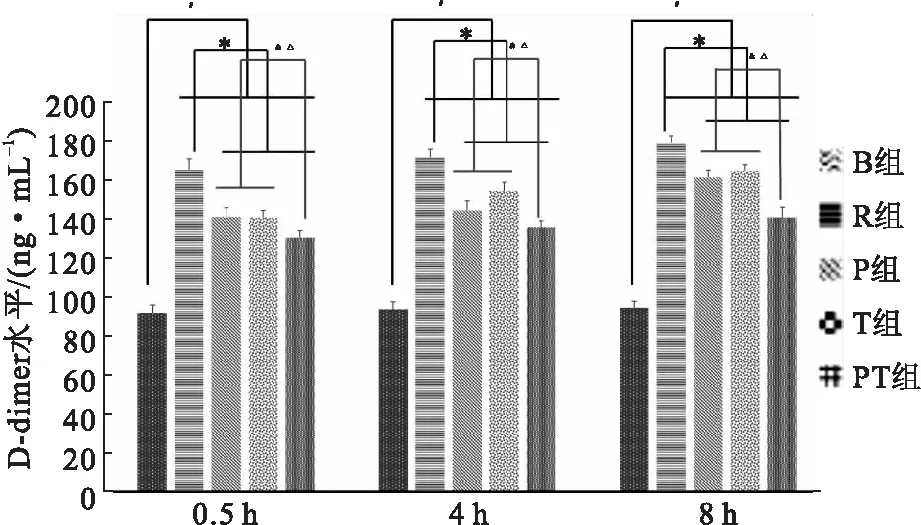
图5不同干预措施对ROSC大鼠D-dimer水平的影响
注: 与B组比较,#P<0.05;与R组比较,*P<0.05;与P组比较,&P<0.05;与T组比较,△P<0.05
3讨论
正常生理状态下,凝血和纤溶系统之间维持着动态平衡。但是,在心跳骤停发生的瞬间,此平衡即被打破。循环崩溃后的数分钟内,凝血系统的改变显而易见。心肺复苏期间所应用的治疗手段以及缺血组织的再灌注,会引起内源性凝血系统改变的进一步加重[2]。心脏骤停时,低氧会导致内皮细胞损伤,机体脏器灌注不足以及复苏过程中直接的组织损伤会导致一系列促炎因子的释放,同时,诸如一氧化氮和前列环素之类的负向调节,抗炎复合物含量明显降低[10]。作为凝血激活标志物之一的凝血酶/抗凝血酶复合物持续增高,包括抗凝血酶和蛋白S、蛋白C在内的抗凝因子降低。复苏患者中,广泛存在纤溶酶/抗纤溶酶复合物以及D-dimer的升高,这意味着纤溶的激活,同时,在部分复苏患者中发现凝血酶原激活因子-1(plasminogen activator inhibitor-1, PAI-1)的增加,又说明了纤溶的抑制[10]。 正是由于凝血/抗凝和纤溶/抗纤溶系统激活程度的不匹配,导致了以血栓形成和纤维蛋白沉积为特征的弥漫性血管内凝血的发生,广泛的微血管血栓形成,以及组织的“无复流”现象,从而引起包括神经功能在内的器官功能衰竭[11]。本研究通过对ROSC大鼠心肌组织的HE染色,展现了复苏后初期,不同时间点微血管血栓的广泛形成。同时,由于VE-cadherin是衡量内皮细胞功能的理想标志物,而血浆TM含量的增加亦代表着内皮细胞的受损[12],故本研究采用VE-cadherin/ VEGFR荧光双染、心肌组织VE-cadherin mRNA实时PCR和血浆TM的ELISA检测,表明了心肺复苏缺血再灌注损伤对微血管内皮细胞以及细胞黏附分子的明确损伤。此外,ROSC大鼠血小板计数和Fib明显减少,D-dimer 明显提升,以及PT和APTT的逐渐延长,都证实了复苏后凝血/纤溶系统的紊乱。
为了抑制复苏后机体广泛的血管内微血栓的形成,尝试过对心肺复苏患者给予抗凝药物(主要是肝素或阿司匹林)或溶栓制剂的治疗方案。溶栓药物即刻直接降解血栓,而肝素可以阻止血栓的后续产生,抑制PAI-1,从而使机体能够从内源性机制增强血栓降解。同时,这些药物也大大增加了凝血功能已经极其脆弱的复苏患者的出血概率[2]。虽然,有1篇关于溶栓制剂和肝素的Meta分析[13]结果显示,其能够在一定程度上改善ROSC、24 h存活率、存活出院率以及长期的神经功能等,但就目前数据而言,仍然仅推荐对考虑其心跳骤停原因为大面积肺栓塞和无法进行PCI的ST段抬高性心肌梗死患者使用溶栓治疗[14]。 因此,本研究选择了从非器官局限性的血管内皮细胞保护的角度,初步探讨抑制心肺复苏后广泛微血栓形成的新治疗策略的可能性。
PGE1{(1R,2R,3R)-3-羟基-2-[(E)-(3S)-3-羟基-1-辛烯基]-5-氧代环戊烷庚酸}具有极强的生理活性,能够通过多种机制和途径改善机体脏器的微循环。其中,抗血小板效应至关重要[6]。 PGE1能延缓血小板脱颗粒(骨桥蛋白释放),减少血小板表面与促凝酶复合物相关的受体表达,抑制凝血复合物的形成,从而阻止爆发性的纤维蛋白形成,明显延缓血栓生成的启动和扩增阶段[7]。 本研究中,对ROSC大鼠给予PGE1后,其HE染色切片中心肌微血管内血栓的形成较复苏组明显减少。而VE-cadherin/ VEGFR荧光双染的结果提示了PGE1能降低复苏后缺血再灌注损伤对大鼠微血管内皮细胞VE-cadherin蛋白的破坏,并且在复苏后0.5 h减缓心肌组织VE-cadherin mRNA表达的陡然上升。同时,PGE1对复苏后血浆TM释放水平的抑制也表明了其对微血管内皮损伤的保护效应。复苏后8 h,PGE1能明显延缓ROSC大鼠血小板计数和Fib的下降幅度。在整个实验过程中,PGE1都能有效抑制D-dimer的升高水平,而对PT和APTT均无明显影响。这也说明了PGE1能够通过减少血小板的激活,降低血栓的形成和Fib的消耗,而非通过凝血因子途径影响凝血/纤溶系统,有效避免了出血情况的发生。
目前,对于心跳骤停复苏后重新获得自主循环的昏迷患者使用TTM的策略,是把温度控制在32~34 ℃[5]。在此温度范围内,血小板的功能和数量,以及纤溶都会被抑制,而PT和APTT时间会被明显延长[15]。本研究中,对ROSC大鼠采用TTM后所监测到D-dimer、PT和APTT的数据变化规律与之相同,但未发现TTM对于血小板计数和Fib有明显影响,这可能和研究时限较短有关。另一方面,其对微血管内皮细胞的保护效应直观地表现为ROSC大鼠使用TTM后,心肌组织微血管内皮VE-cadherin蛋白的破坏有所缓解,从而不会出现缺血再灌注损伤后,机体为了补偿VE-cadherin的急剧下降,而引发的VE-cadherin mRNA的陡然升高。此外,实验过程中,TTM可以明显抑制血浆TTM的提升。这都说明TTM对微血管内皮细胞的直接保护效应。其他研究者[16]采用体外模型的研究结果表明,通过激活JNK1/2,增强MKP-1的表达,TTM能够明显减轻对缺血再灌注损伤后血管内皮细胞的凋亡。由于TTM对凝血的抑制和对血管内皮细胞的保护,使其在本研究中体现出能够改善广泛微血栓形成的效应。
综上所述,心肺复苏后,机体组织器官的缺血再灌注损伤显而易见。TTM所具备的抗凝效应可以在ROSC早期减少凝血因子的合成,而PGE1能够弥补TTM对于血小板数量和功能的抑制。同时,二者对血管内皮细胞都表现出一定的保护效应。本研究对内皮细胞损伤修复和凝血系统指标的测定结果表明,PGE1/TTM联合干预显示出比单独干预更加明显的保护作用。所以, PGE1/TTM联合治疗对改善ROSC后微血管内广泛血栓的形成,可能存在协同作用。
【参考文献】
[1]Holzer M. Targeted temperature management for comatose survivors of cardiac arrest[J]. N Engl J Med, 2010, 363(13):1256-1264.
[2]Weidman JL, Shook DC, Hilberath JN. Cardiac resuscitation and coagulation[J]. Anesthesiology, 2014, 120(4):1009-1014.
[3]Dargin JM, Emlet LL. Thrombolysis during out-of-hospital cardiac arrest: a lesson in the law of diminishing returns[J]. Critical Care, 2010, 14(2):304.
[4]Wada T, Gando S, Mizugaki A,etal. Coagulofibrinolytic changes in patients with disseminated intravascular coagulation associated with post-cardiac arrest syndrome--fibrinolytic shutdown and insufficient activation of fibrinolysis lead to organ dysfunction[J]. Thromb Res, 2013, 132(1):64-69.
[5]Callaway CW, Donnino MW, Fink EL,etal. Part 8: Post-Cardiac Arrest Care: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care[J]. Circulation, 2015, 132(2):465-482.
[6]白丽娜, 周旻, 李月红. 前列地尔脂微球载体制剂的药理作用机制的研究进展[J]. 中日友好医院学报, 2008, 22(1):47-50.
[7]Butenas S, Cawthern KM, van′t Veer C,etal. Antiplatelet agents in tissue factor-induced blood coagulation[J]. Blood, 2001, 97(8):2314-2322.
[8]周俊, 黄国庆, 李湘民, 等. 不同刺激参数及其组合对经食道电刺激诱导大鼠心搏骤停的影响[J]. 中国急救复苏与灾害医学杂志, 2013, 8(7):596-598.
[9]Chen MH, Liu TW, Xie L,etal. Ventricular fibrillation induced by transoesophageal cardiac pacing: a new model of cardiac arrest in rats[J]. Resuscitation, 2007, 74(3):546-551.
[10] Adrie C, Monchi M, Laurent I,etal. Coagulopathy after successful cardiopulmonary resuscitation following cardiac arrest: implication of the protein C anticoagulant pathway[J]. J Am Coll Cardiol, 2005, 46(1):21-28.
[11] Adrie C, Laurent I, Monchi M,etal. Postresuscitation disease after cardiac arrest: a sepsis-like syndrome[J]. Curr Opin Crit Care, 2004, 10(3):208-212.
[12] Martin FA, Murphy RP, Cummins PM. Thrombomodulin and the vascular endothelium: insights into functional, regulatory, and therapeutic aspects[J]. Am J Physiol Heart Circ Physiol, 2013, 304(12):1585-1597.
[13] Li X, Fu QL, Jing XL,etal. A meta-analysis of cardiopulmonary resuscitation with and without the administration of thrombolytic agents[J]. Resuscitation, 2006, 70(1):31-36.
[14] Jaff MR, McMurtry MS, Archer SL,etal. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association[J]. Circulation, 2011, 123(16):1788-1830.
[15] Gong P, Zhang M-Y, Zhao H,etal. Effect of Mild Hypothermia on the Coagulation-Fibrinolysis System and Physiological Anticoagulants after Cardiopulmonary Resuscitation in a Porcine Model[J]. Plos One, 2013(6):67476.
[16] Yang D, Guo S, Zhang T,etal. Hypothermia attenuates ischemia/reperfusion-induced endothelial cell apoptosis via alterations in apoptotic pathways and JNK signaling[J]. FEBS Lett, 2009, 583(15):2500-2506.
Preliminary Study of Inhibitory Effect of Prostaglandin E1 Combined with Target Temperature Management on the Micro-thrombogenesis of ROSC Rats
WeiWei,LaiShichao,XieYong,NieHu△.
EmergencyDepartment,WestChinaHospital,SichuanUniversity,Chengdu610041,China
【Abstract】ObjectiveTo investigate the inhibitory effect of Prostaglandin E1 (PGE1) combined with target temperature management (TTM) on the micro-thrombogenesis of ROSC rat. MethodsVentricular fibrillation (VF) was induced by transoesophageal alternating current was used to establish cardiopulmonary resuscitation (CPR) model in rats. Blank control group was set (group B, n=14). 56 successfully resuscitated rats regained ROSC were divided into 4 groups: return of spontaneous circulation (ROSC) group (R group, n=14), PGE1 intervention group (P group, n=14), TTM intervention group (T group, n=14) and PGE1/TTM joint intervention group (PT group, n=14). Blood platelet count, prothrombin time (PT), activated partial thromboplastin time (APTT), fibrinogen (Fib), thrombomodulin (TM) and D-dimer were evaluated with ELISA using blood samples from 5 rats of each group at 0.5, 4 and 8 hours after ROSC. Three rats of every group were sacrificed at each time point to assess hematoxylin and eosin (HE) staining and the vascular endothelial (VE)-cadherin mRNA expression with PCR. In the end, VE-cadherin/ vascular endothelial growth factor receptor (VEGFR) double fluorescent immunohistochemistry staining were also examined.ResultsPGE1, TTM and PGE1/TTM could significantly diminish the micro-thrombogenesis in the heart tissue, reduce the VE-cadherin protein loss of micro-endothelial cells, and lower the VE-cadherin mRNA expression at 0.5 h after ROSC (P<0.05). PT group showed most dramatic effect. All the three interventions brought down the sharp rise of TM and D-dimer levels right after CPR (P<0.05),and PGE1/TTM seemed to have better effects on these parameters than the single interventions did (P<0.05). ConclusionBoth PGE1 and TTM could alleviate the micro-thrombogenesis through different anti-coagulative pathways and the protective effect of the ischemic/reperfusion injury of the endothelium from ROSC rat after CPR separately, while the PGE1/TTM combined intervention might have synergistic better effect than either single one.
【Key words】CPR; PGE1; TTM; Micro-thrombogenesis
doi:10.3969/j.issn.1674-2257.2016.01.006
*基金项目:成都市高校院所应用成果转化项目资助(No:11DXYB294SF-027)。
通信作者:△聂虎,E-mail:456nh@163.com
【中图分类号】R541.78
【文献标志码】A
