幽门螺杆菌感染慢性胃炎患者血清TNF-α、IL-8和VEGF水平及其与胃炎严重程度的相关性研究
2016-06-21郝婷婷马晓鹏温彦丽戴光荣冯义朝
郝婷婷,马晓鹏,温彦丽,戴光荣,冯义朝,张 莉
1.延安大学附属医院消化内科二病区,陕西 延安 716000; 2.西安交通大学附属第二医院消化科
幽门螺杆菌感染慢性胃炎患者血清TNF-α、IL-8和VEGF水平及其与胃炎严重程度的相关性研究
郝婷婷1,马晓鹏1,温彦丽1,戴光荣1,冯义朝1,张 莉2
1.延安大学附属医院消化内科二病区,陕西 延安 716000; 2.西安交通大学附属第二医院消化科
目的 研究幽门螺杆菌(Helicobacter pylori,H.pylori)感染者血清中TNF-α、IL-8、VEGF水平及其与胃炎病理组织严重程度的关系。方法 选取2012年1月-2014年12月在延安大学附属医院行内窥镜确诊的80例慢性胃炎患者为研究对象,以13C尿素呼气和胃黏膜组织活检进行H.pylori检测。依据胃炎组织病理类型分为:慢性胃炎、中性粒细胞浸润、胃萎缩和肠上皮化生四个类别,检测患者血清中TNF-α、IL-8、VEGF的水平并分析其与慢性胃炎患者严重程度的关系。结果 80例胃炎患者中41.5%伴有H.pylori感染,且H.pylori感染者血清中TNF-α水平(4.34±3.72)pg/ml和VEGF水平(683.18±428.37)pg/ml明显高于未感染者(2.76±1.51)pg/ml和(485.26±306.75)pg/ml,差异有统计学意义(P<0.05);但IL-8水平在感染者与未感染者之间差异无统计学意义(P>0.05)。血清中TNF-α和IL-8水平与慢性胃炎严重程度密切相关,而血清中IL-8水平同时与中性粒细胞浸润程度密切相关,血清中VEGF水平则与萎缩性胃炎和肠上皮化生密切相关。结论 血清中高TNF-α水平与慢性胃炎严重程度相关,高IL-8水平与慢性胃炎和中性粒细胞浸润相关,高VEGF水平则与胃癌癌前病变有关。
细胞因子;幽门螺杆菌;萎缩性胃炎;肠上皮化生
幽门螺杆菌(Helicobacter pylori,H.pylori)是人类胃肠疾病感染最常见的一种致病菌[1]。它是一种微厌氧螺旋状革兰氏阴性杆菌。它与胃癌的发生密切相关。研究[2]表明H.pylori与慢性胃炎、消化性溃疡、胃癌和黏膜相关的淋巴组织均有关系。它的流行与地理位置和社会经济情况密切相关。它寄生在人体的胃内引起胃部炎症反应,促进炎性细胞浸润,从而增加破坏胃黏膜的细胞因子释放。胃的表面积非常大,目前尚不清楚炎症是否局限于胃黏膜或导致全身炎症。研究[3]表明,H.pylori在胃的良恶性疾病发病机制与激活宿主的血管生成中起着关键作用。而在目前已知的促血管生成因子中,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是血管生成的最强有力的刺激因素,它被认为是促进肿瘤生长和肿瘤转移的关键因素之一[4]。虽然以H.pylori感染为基础引起的胃黏膜组织表达VEGF及炎性细胞因子的相关文献已经很多,但关于循环血液中炎性细胞因子和VEGF水平及其与胃炎严重程度的关系却鲜有报道。为此,我们通过检测H.pylori感染的胃炎患者循环血液中TNF-α、IL-8和VEGF水平,探讨其与患者的组织病理学关系。
1 资料与方法
1.1 一般资料 选取延安大学附属医院2012年1月-2014年12月收治的80例胃炎患者为研究对象,行胃镜检查,经组织学检查诊断为慢性胃炎。所有患者均有不同程度的中性粒细胞浸润、胃萎缩和肠上皮化生。男41例,女39例,年龄18~65岁,平均年龄(44.8±9.2)岁。其中H.pylori阳性患者33例,男21例,女12例;H.pylori阴性患者47例,男20例,女27例,两组患者年龄、体质量等一般资料相比,差异无统计学意义(P>0.05),具有可比性(见表1)。纳入研究的所有对象在诊断前4周内均未接受抗生素、铋化合物、拮抗剂、质子泵抑制剂或免疫调节药物治疗。且均无恶性肿瘤、免疫抑制、代谢紊乱、胃肠道出血及胃手术史。所有患者均告知其研究方法与研究目的,同时签署知情同意书。研究获得医院伦理委员会批准。
表1 两组患者一般资料比较[例数(%)]
Tab 1 Comparison of general information between two groups [n(%)]

H.pylori阳性H.pylori阴性P值性别0.103 男21(63.64)20(42.55) 女12(36.36)27(57.45)年龄(岁)0.646 <305(15.15)4(8.51) 30~4510(30.30)13(27.66) 46~6010(30.30)20(42.55) >608(24.24)10(21.28)体质量0.573 正常16(48.48)27(57.45) 偏瘦或偏胖17(51.52)20(42.55)
1.2 胃部病理学检查 所有受检查者在胃镜直视下,在距幽门口5 cm内取黏膜标本2块用于病理学检查。胃炎的严重程度采用胃黏膜组织活检进行评价。活检标本经4%多聚甲醛固定后,嵌入石蜡包埋。苏木精-伊红染色。慢性胃炎、中性粒细胞浸润、胃萎缩和肠上皮化生的严重程度参照文献[5]进行病理染色并判定评分,0~2分为一般,≥3分为严重。
1.3H.pylori感染的检测 采取13C尿素呼气诊断试验鉴定H.pylori的感染。测定服药前后呼气样本中12C/13C比值(δ值),若呼气后δ值减去呼气前δ值之差<4,则为H.pylori阴性,若呼气后δ值减去呼气前δ值之差>4,则为H.pylori阳性[5]。
1.4 血清TNF-α、IL-8、VEGF水平的检测 所有患者在行胃镜检查取材后抽空腹血液,置于血清分离器内室温静置30~45 min,1 000× g离心15 min,立即取上清置于-20 ℃保存备用。血清中TNF-α、IL-8、VEGF的含量采用ELISA试剂盒进行检测(购于北京晶美生物工程有限公司),具体操作按ELISA试剂盒说明书进行。根据各指标的正常平均水平[TNF-α平均水平(3.41±3.27)pg/ml;VEGF平均水平(566.9±351.25)pg/ml;IL-8平均水平(37.23±23.86)pg/ml],将低于平均水平的患者归为低水平组,将高于平均水平的患者归为高水平组。
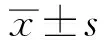
2 结果
2.1H.pylori阳性患者与阴性患者血清TNF-α、IL-8和VEGF水平比较H.pylori阳性患者血清中TNF-α水平(4.34±3.72)pg/ml和VEGF水平(683.18±428.37)pg/ml明显高于H.pylori阴性患者(2.76±1.51)pg/ml和(485.26±306.75)pg/ml,差异有统计学意义(P<0.05)。但血清IL-8水平在H.pylori阳性(38.96±25.92)pg/ml和阴性(36.01±24.69)pg/ml患者之间差异无统计学意义(P>0.05)。
2.2 血清TNF-α、IL-8和VEGF水平与胃炎严重程度的相关性 血清TNF-α的水平与慢性胃炎程度密切相关(OR=2.750,P=0.027);血清IL-8的水平与慢性胃炎程度(OR=2.496,P=0.045)及中性粒细胞浸润(OR=2.926,P=0.037)密切相关;但血清VEGF水平与慢性胃炎程度及中性粒细胞浸润均无相关性(OR=1.224,P=0.653;OR=1.444,P=0.145)(见表2)。
血清VEGF水平与胃萎缩程度及胃黏膜肠上皮化生程度密切相关(OR=4.333,P=0.027;OR=4.678,P=0.037);但血清TNF-α、IL-8水平与胃萎缩程度(OR=1.892,P=0.256;OR=2.017,P=0.211)、胃黏膜肠上皮化生(OR=1.800,P=0.247;OR=2.926,P=0.627)程度均无相关性(见表3)。
表2 血清TNF-α、IL-8和VEGF水平与慢性胃炎程度及中性粒细胞浸润的相关性
Tab 2 Association of serum levels of TNF-α, IL-8 and VEGF with degree of chronic inflammation and neutrophil infiltration

慢性胃炎一般(%)严重(%)OR(95%CI)中性粒细胞浸润一般(%)严重(%)OR(95%CI)TNF-α 高水平14(17.50)28(35.00)2.750(1.11~6.83)29(36.25)13(16.25)1.225(0.47~3.33) 低水平22(27.50)16(20.00)28(35.00)10(12.50)IL-8 高水平14(17.50)27(33.75)2.496(1.01~6.16)25(31.25)16(20.00)2.926(1.04~8.20) 低水平22(27.50)17(21.25)32(40.00)7(8.75)VEGF 高水平17(21.25)23(28.75)1.224(0.51~2.96)27(33.75)13(16.25)1.444(0.55~3.83) 低水平19(23.75)21(26.25)30(37.50)10(12.50)
表3 血清TNF-α、IL-8和VEGF水平与胃萎缩程度和肠上皮化生程度的相关性
Tab 3 Association of serum levels of TNF-α, IL-8 and VEGF with degree of atrophy and intestinal metaplasiay

胃萎缩一般(%)严重(%)OR(95%CI)肠上皮化生一般(%)严重(%)OR(95%CI)TNF-α 高水平31(17.50)11(35.00)1.892(0.62~5.75)33(41.25)9(11.25)1.800(0.55~5.95) 低水平32(40.00)6(7.50)33(41.25)5(6.25)IL-8 高水平30(37.50)11(13.75)2.017(0.66~6.12)33(41.25)8(20.00)2.926(1.04~8.20) 低水平33(41.25)6(7.50)33(41.25)6(7.50)VEGF 高水平27(21.25)13(28.75)4.333(1.27~14.78)29(36.25)11(13.75)4.678(1.19~18.34) 低水平36(45.00)4(5.00)37(46.25)3(3.75)
3 讨论
本研究的目的是评估H.pylori感染者循环血液中促炎细胞因子TNF-α、IL-8及血管生成标志物VEGF与胃炎患者严重程度的相关性。目前的研究在针对H.pylori感染胃炎患者胃黏膜组织中促炎因子的变化及其与胃炎严重程度的关系尚存在一定争议。我们通过检测血液循环中TNF-α、IL-8及VEGF水平,并分析其水平变化与胃炎严重程度的相关性。结果发现,H.pylori阳性患者血清中TNF-α水平明显高于H.pylori阴性患者。这个结果和Berry等[6]、Sgouras等[7]的研究结果一致。表明慢性胃炎时,感染H.pylori能强烈刺激机体产生免疫应答,使机体出现全身性的炎症反应,从而导致血清中TNF-α水平增加。尽管我们的结果显示血清中高水平TNF-α与慢性炎症严重程度相关,但却与中性粒细胞浸润、胃萎缩、胃黏膜肠上皮化生没有关系。
IL-8作为炎症细胞因子及中性粒细胞趋化因子,是介导炎症的一种重要介质。研究[7-8]表明,IL-8是介导H.pylori感染相关胃炎的重要细胞因子,它能够进一步诱导炎症相关的信号转导途径。Flahou等[9]发现,H.pylori感染者胃黏膜IL-8水平表达明显升高,而Cichoz-Lach等[10]则发现H.pylori阳性胆汁性胃炎患者IL-8水平明显高于阴性患者。Kim等[11]研究表明,在H.pylori表达CagA蛋白后感染上皮细胞,能上调上皮细胞IL-8的基因表达和分泌,表明CagA蛋白能直接作用于胃上皮细胞,从而诱导胃上皮细胞表达IL-8[12]。本次研究存在一定的局限性,因为我们并不能确定纳入研究的患者机体中CagA的水平,而我们的结果表明在H.pylori阳性患者和阴性患者之间血清IL-8的水平无显著差异,这可能是因为有患者感染了表达CagA阴性的H.pylori。而在血清高水平IL-8的患者,其中性粒细胞浸润程度明显较低水平患者高,这主要是由于IL-8是中性粒细胞最强烈的趋化因子。
本次研究还发现H.pylori阳性患者血清VEGF水平明显高于阴性患者。研究[4]表明,H.pylori能激活宿主血管再生能力,而VEGF则是血管生成的最强烈标志物。Mangia等[13]和Caputo等[14]的研究表明,H.pylori能促进胃黏膜细胞VEGF的表达,而Tucillo等[15]的体外研究也表明,H.pylori能促进人胃上皮细胞VEGF的表达,这一过程是通过表皮生长因子受体(epidermal growth factor receptor, EGFR)及环氧化酶2(cyclooxygenase 2, COX-2)途径来完成的,而这一过程在慢性胃炎发展为胃癌过程中发挥重要作用。胃萎缩和胃黏膜肠上皮化生被认为是胃癌癌前病变的前兆。研究[16]表明,在胃癌和胃癌癌前病变前,如胃萎缩和胃黏膜肠上皮化生前,慢性萎缩性胃炎和胃黏膜肠上皮化生区域的VEGF表达水平已经升高了。我们的研究结果显示血清VEGF水平与慢性胃炎和中性粒细胞无关,但与胃萎缩和胃黏膜肠上皮化生严重程度相关。
综上所述,H.pylori感染慢性胃炎患者血清TNF-α和VEGF水平显著升高,但血清IL-8水平则无明显变化。血清高TNF-α水平与慢性胃炎严重程度密切相关,高IL-8水平与慢性胃炎严重程度及中性粒细胞浸润程度相关,而血清高VEGF水平则与胃癌癌前病变相关。
[1]McColl KE. Clinical practice. Helicobacter pylori infection [J]. N Engl J Med, 2010, 362(17): 1597-1604.
[2]Gatti LL, Burbano RR, Zambaldi-Tunes M, et al. Interleukin-6 polymorphisms, Helicobacter pylori infection in adult Brazilian patients with chronic gastritis and gastric adenocarcinoma [J]. Arch Med Res, 2007, 38(5): 551-555.
[3]Strowski MZ, Cramer T, Schäfer G, et al. Helicobacter pylori stimulates host vascular endothelial growth factor-A (vegf-A) gene expression via MEK/ERK-dependent activation of Sp1 and Sp3 [J]. FASEB J, 2004, 18(1): 218-220.
[4]Weis SM, Cheresh DA. Pathophysiological consequences of VEGF-induced vascular permeability [J]. Nature, 2005, 437(7058): 497-504.
[5]Rugge M, Pennelli G, Pilozzi E, et al. Gastritis: the histology report [J]. Dig Liver Dis, 2011, 43 Suppl 4: S373-S384.
[6]Berry V, Sagar V. Rapid urease test to diagnose Helicobacter pylori infection [J]. JK Science, 2006, 8(19): 86-98.
[7]Sgouras DN, Trang TT, Yamaoka Y. Pathogenesis of Helicobacter pylori infection [J]. Helicobacter, 2015, 20 Suppl 1: 8-16.
[8]Santos JC, Ribeiro ML. Epigenetic regulation of DNA repair machinery in Helicobacter pylori-induced gastric carcinogenesis [J]. World J Gastroenterol, 2015, 21(30): 9021-9037.
[9]Flahou B, Deun KV, Pasmans F, et al. The local immune response of mice after Helicobacter suis infection: strain differences and distinction with Helicobacter pylori [J]. Vet Res, 2012, 43: 75.
[10]Cichoz-Lach H, Somka M, Celiński K, et al. Level of serum cytokines in biliary gastritis and erosive gastritis with Helicobacter pylori coinfection [J]. Ann Univ Mariae Curie Sklodowska Med, 2001, 56: 271-274.
[11]Kim SY, Lee YC, Kim HK, et al. Helicobacter pylori CagA transfection of gastric epithelial cells induces interleukin-8 [J]. Cell Microbiol, 2006, 8(1): 97-106.
[12]Meine GC, Rota C, Dietz J, et al. Relationship between cagA-positive Helicobacter pylori infection and risk of gastric cancer: a case control study in Porto Alegre, RS, Brazil [J]. Arq Gastroenterol, 2011, 48(1): 41-45.
[13]Mangia A, Chiriatti A, Ranieri G, et al.H.pyloristatus and angiogenesis factors in human gastric carcinoma [J]. World J Gastroenterol, 2006, 12(34): 5465-5472.
[14]Caputo R, Tuccillo C, Manzo BA, et al. Helicobacter pylori VacA toxin up-regulates vascular endothelial growth factor expression in MKN 28 gastric cells through an epidermal growth factor receptor-, cyclooxygenase-2-dependent mechanism [J]. Clin Cancer Res, 2003, 9(6): 2015-2021.
[15]Tuccillo C, Cuomo A, Rocco A, et al. Vascular endothelial growth factor and neo-angiogenesis inH.pylorigastritis in humans [J]. J Pathol, 2005, 207(3): 277-284.
[16]Yakut M, Örmeci N, Erdal H, et al. The association between precancerous gastric lesions and serum pepsinogens, serum gastrin, vascular endothelial growth factor, serum interleukin-1 Beta, serum toll-like receptor-4 levels and Helicobacter pylori Cag A status [J]. Clin Res Hepatol Gastroenterol, 2013, 37(3): 302-311.
(责任编辑:马 军)
Serum TNF-α, IL-8, VEGF levels and their association with degree of gastritis in chronic gastritis patients with Helicobacter pylori infection
HAO Tingting1, MA Xiaopeng1, WEN Yanli1, DAI Guangrong1, FENG Yichao1, ZHANG Li2
1.Department of Gastroenterology, Yan’an University Affilliated Hospital, Yan’an 716000; 2.Department of Gastroenterology, the Second Hospital Affiliated to Xi’an Jiaotong University, China
Objective To investigate the serum levels of TNF-α, IL-8, VEGF and their association with the degrees of gastritis histopathology in chronic gastritis patients with Helicobacter pylori (H.pylori) infection. Methods Eighty gastritis patients in Yan’an University Affilliated Hospital from Jan. 2012 to Dec. 2014 were selected as the objects. The13C urea breath test and gastric tissue biopsy were used for the diagnosis ofH.pyloriinfection. The severity of chronic inflammation, neutrophil infltration, atrophy, and intestinal metaplasia were assessed. Serum samples were obtained to determine circulating TNF-α, IL-8 and VEGF.Results There were 41.5% of 80 patients infected withH.pylori. Serum TNF-α (4.34±3.72) pg/ml and VEGF (683.18±428.37) pg/ml in theH.pyloripositive group were significantly higher than those in theH.pylorinegative group (2.76±1.51) pg/ml and (485.26±306.75) pg/ml (P<0.05); but there was no significant difference in IL-8 betweenH.pyloripositive and negative patients. Serum levels of TNF-α and IL-8 were related with degree of chronic inflammation, and the serum level of IL-8 was related with neutrophil infltration. The serum level of VEGF was related with degree of atrophy and intestinal metaplasia.Conclusion High level of TNF-α is associated with severe degree of chronic inflammation, high level of IL-8 is associated with severe degree of chronic inflammation and neutrophil infltration, and high level of VEGF is associated with severe degree of premalignant gastric lesion.
Cytokine; Helicobacter pylori; Atrophic gastritis; Intestinal metaplasia
郝婷婷,E-mail:haoqinqin1982@126.com
10.3969/j.issn.1006-5709.2016.07.014
R573.3
A
1006-5709(2016)07-0769-04
2015-11-12
