MACC1调节肝星状细胞表达MMP-2、MMP-9对胃癌细胞迁移侵袭能力的影响
2016-06-21朱振红朱正秋
王 曼,朱振红,朱正秋
1.徐州医学院研究生院,江苏 徐州 221000; 2.江苏省连云港市第一人民医院消化内科; 3.徐州医学院附属医院肿瘤内科
MACC1调节肝星状细胞表达MMP-2、MMP-9对胃癌细胞迁移侵袭能力的影响
王 曼1,朱振红2,朱正秋3
1.徐州医学院研究生院,江苏 徐州 221000; 2.江苏省连云港市第一人民医院消化内科; 3.徐州医学院附属医院肿瘤内科
目的 探讨结肠癌相关转移基因(metastasis-associated in colon cancer-1,MACC1)对肝星状细胞(hepatic stellate cell,HSC)表达基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)的调节作用,及对胃癌细胞迁移和侵袭能力的影响。方法 利用携带MACC1基因的重组慢病毒颗粒(LV-MACC1-GFP)、空载体慢病毒颗粒(LV-GFP)感染HSC分别作为实验组、阴性对照组,未转染处理的HSC作为空白对照组,以上三组细胞按照常规培养,应用RT-PCR和Western blotting技术检测细胞中MMP-2、MMP-9 mRNA和蛋白表达。以上三组细胞分别与胃癌细胞MKN45体外共培养,Transwell实验观察三组不同培养条件下对胃癌细胞MKN45迁移侵袭能力的影响。结果 与阴性对照组和空白对照组比较,实验组HSC MMP-2、MMP-9 mRNA和蛋白表达水平均明显上调(P<0.01)。Transwell实验中与实验组共培养的胃癌细胞MKN45迁移和侵袭能力较其他两组明显升高(P<0.01)。结论 MACC1可能通过调节HSC MMP-2、MMP-9的表达,促进胃癌细胞的迁移和侵袭。
MACC1;肝星状细胞;基质金属蛋白酶;胃癌;迁移;侵袭
胃癌是全球第三大导致死亡的恶性肿瘤[1],胃癌转移发生的早晚及程度已成为影响胃癌预后的重要因素之一,最常见的血行转移器官是肝脏。胃癌肝转移灶中存在大量激活的肝星状细胞(hepatic stellate cell,HSC),活化的HSC还可分泌利于肿瘤生长的细胞外基质,并最终形成利于肿瘤定植增生的肿瘤微环境[2]。结肠癌相关转移基因(metastasis-associated in colon cancer-1,MACC1)首先在结肠癌中被发现,本课题组的前期研究[3]表明,活化的HSC中MACC1显著高表达提示MACC1与HSC激活之间可能存在联系,且MACC1在细胞水平可以通过调节上皮间质转化(EMT)过程,促进胃癌的侵袭和转移。本实验通过构建MACC1过表达载体,慢病毒感染HSC,进一步研究MACC1调节HSC分泌利于肿瘤生长的细胞外基质的作用及胃癌细胞的迁移侵袭能力在此过程中的变化。
1 材料与方法
1.1 材料 人胃癌MKN45细胞株由上海复旦大学馈赠,人肝星状细胞系HSC-LX-2由徐州医学院免疫实验室馈赠,高糖DMEM培养基、胎牛血清购于美国ScienCell。含MACC1基因过表达的重组慢病毒颗粒委托上海吉玛制药技术有限公司设计构建。兔抗人MACC1、β-actin、MMP-9、MMP-2一抗购于美国Abcam公司,山羊抗兔IgG荧光二抗购于美国Corning公司,RT-PCR及实时定量PCR试剂盒购于日本TaKaRa公司。Matrigel胶购于美国BD公司。Transwell小室购于美国Corning公司。
1.2 细胞培养与基因转染 胃癌MKN45、HSC培养于含有10%胎牛血清的高糖DMEM培养基中,置于37 ℃、5% CO2的恒温培养箱中培养。取对数生长期的HSC接种于6孔板中,3.5×104个/孔,待细胞融合度达40%~60%时,按慢病毒转染说明书操作,以LV-MACC1-GFP颗粒和LV-GFP颗粒分别感染HSC,作为实验组和阴性对照组,空白对照组不做任何处理,三组常规培养,感染24 h后更换培养基,每12 h观察一次。感染96 h后应用流式细胞仪检测GFP表达阳性率,即慢病毒的感染效率。
1.3 实时定量PCR检测慢病毒感染HSC后MMP-2、MMP-9 mRNA水平的表达 应用TRIzol法提取组织中的总RNA,反转录合成cDNA。β-actin作为PCR反应内参,β-actin上游引物序列5’-CTTAGTTGCGTTACACCCTTTC-3’,下游引物序列5’-GTCACCTTCACCGTTCCAGT-3’;MMP-2上游引物序列5’-TATGGCTTCTGCCCTGAGAC-3’,下游引物序列5’-CACACCACATCTTTCCGTCA-3’;MMP-9上游引物序列5’-AGTCCACCCTTGTGCTCTTC-3’,下游引物序列5’-ACTCTCCACGCATCTCTGC-3’;使用美国ABI公司的7500型荧光定量PCR仪,参照TaKaRa PCR操作手册进行Real-Time PCR。反应条件如下:95 ℃预变性30 s;PCR反应95 ℃ 5 s,55 ℃ 30 s,72 ℃ 34 s,40个循环;Melt Curve:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。实验所获得的数据采用相对定量Ct值法(2-ΔΔCt法)进行相对定量分析。ΔΔCt=ΔCt实验组-ΔCt对照组;ΔCt=Ct靶基因-Ct内参。
1.4 Western blotting检测慢病毒感染HSC后MMP-2、MMP-9蛋白的表达 使用组织裂解液提取各组细胞总蛋白,BCA法测定蛋白浓度,SDS聚丙烯酰胺凝胶电泳,蛋白转至NC膜,5%脱脂牛奶室温封闭2 h,一抗(1∶1 000)孵育4 ℃过夜,荧光二抗(1∶10 000)室温避光孵育2 h,TBST洗涤后拍照。运用Image J图像软件对结果进行分析。蛋白相对表达量=目的蛋白/β-actin蛋白。
1.5 Transwell迁移及侵袭实验 将不含胎牛血清DMEM培养的MKN45分别种植于上室,将10%胎牛血清完全培养液培养的HSC种植于下室(分三组,同1.2节),37 ℃、5% CO2恒温培养24~48 h后,取出小室室温固定,结晶紫染色,用棉签擦去Transwell小室上层细胞,将小室倒置于相差倒置显微镜下观察穿过半透膜附着于小室下层的细胞,随机选取10个视野,计数每高倍视野平均细胞数估计迁移能力。不同于迁移实验,侵袭实验在上下室间除聚碳酸酯膜外,还需使用Matrigel胶。

2 结果
2.1 慢病毒感染HSC及MACC1-HSC和CON-HSC细胞株的构建 以MOI=30,分别用MACC1病毒及CON病毒感染HSC,嘌呤霉素筛选HSC的最佳浓度为0.05 μg/ml,筛选14 d后,镜下可被蓝光激发出绿色荧光的细胞比例明显增加(见图1)。流式细胞仪分别检测报告基因GFP的表达情况,MACC1-HSC组GFP阳性(55.6%)较CON-HSC组(60.5%)低,考虑MACC1可能会影响GFP的表达。Western blotting结果也证实目的蛋白能够在HSC中表达。Western blotting结果显示:与空白对照组相比,实验组中MACC1蛋白表达显著上调,差异有统计学意义(P<0.01);空白对照组和阴性对照组比较,差异无统计学意义(P>0.05)(见图2)。
2.2 Western blotting检测MACC1调节HSC MMP-2、MMP-9蛋白表达水平 Western blotting结果显示,与空白对照组相比,转染LV-MACC1-GFP后(实验组)HSC中MMP-2、MMP-9蛋白表达水平均显著上调,与空白对照组和阴性对照组比较,差异有统计学意义(P<0.01);空白对照组与阴性对照组相比,差异无统计学意义(P>0.05)(见图3)。

图1 感染后的明视野(A~D)和荧光视野(E~H)(400×)
Fig 1 The horizons (A~D) and fluorescence horizons (E~H) of being infection (400×)

注:与空白对照组比较,**P<0.01。
图2 MACC1在HSC中的表达 A:流式细胞仪检测报告基因GFP的表达情况,红色代表HSC,蓝色代表MACC1-HSC或CON-HSC;B:Western blotting检测目的蛋白表达情况;C:HSC转染LV-MACC1-GFP后MACC1蛋白表达水平
Fig 2 MACC1 expression in HSC A: FCM showed the expression of GFP gene, red represented HSC, blue represented MACC1-HSC or CON-HSC; B: the expression of target protein detected by Western blotting; C: the expression of MACC1 protein in HSC after transfected into LV-MACC1-GFP plasmid
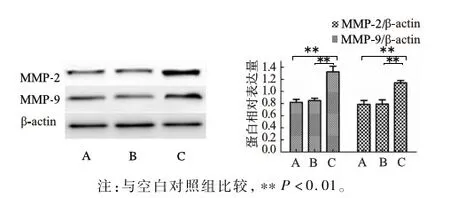
注:与空白对照组比较,**P<0.01。
图3 HSC转染LV-MACC1-GFP后MMP-2、MMP-9蛋白表达水平 A:空白对照组;B:阴性对照组;C:实验组
Fig 3 The expressions of MMP-2 and MMP-9 protein in HSC after transfected into LV-MACC1-GFP plasmid A: blank control group; B: vector group; C: overexpression group
2.3 RT-PCR检测MACC1调节HSC MMP-2、MMP-9 mRNA表达水平 RT-PCR结果显示,与空白对照组相比,转染LV-MACC1-GFP后(实验组)HSC中MMP-2、MMP-9 mRNA表达水平显著上调,与空白对照组和阴性对照组比较,差异有统计学意义(P<0.01);空白对照组与阴性对照组相比,差异无统计学意义(P>0.05,见图4)。

注:与空白对照组比较,**P<0.01。
图4 HSC转染LV-MACC1-GFP后MMP-2、MMP-9 mRNA相对表达水平 A:空白对照组;B:阴性对照组;C:实验组
Fig 4 The expressions of MMP-2 and MMP-9 mRNA in HSC after transfected into LV-MACC1-GFP plasmid A: blank control group; B: vector group; C: overexpression group
2.4 MACC1调节HSC MMP-2、MMP-9表达对胃癌细胞迁移侵袭能力的影响 将两种不同的细胞分别种植于上下室中共同培养,通过培养液互相影响来研究下室HSC(分三组,同1.2节)分泌或代谢产生的物质对上室MKN45的作用,如图5所示:种植相同数目的胃癌细胞MKN45于上室,小室培养24 h后,穿过滤膜的实验组MKN45细胞数较其他两组明显增多。空白对照组、阴性对照组、实验组穿透到Transwell小室下面的MKN45细胞数分别为92.67±3.51、87.00±3.00和131.00±4.58,差异均有统计学意义(P<0.01);铺基质胶后穿透的MKN45细胞数分别为74.00±5.57、74.33±7.77和105.00±5.57,差异均有统计学意义(P<0.01)。以上结果提示:MACC1过表达感染的HSC MMP-2、MMP-9表达水平升高,增强胃癌细胞MKN45迁移侵袭能力。

图5 Transwell实验检测三组HSC与MKN45共培养条件下对胃癌细胞迁移侵袭能力的影响(结晶紫染色200×)
Fig 5 Influence of the capabilities of migration and invasion of gastric carcinoma cells co-cultured with HSC measured by Transwell assay (Crystal violet 200×)
3 讨论
胃癌肝转移是胃癌死亡的主要原因之一。在所有转移性胃癌中,16%~50%转移至肝脏,而胃癌肝转移患者的5年生存率<5%[1]。阐明胃癌及其肝转移的内在机制并寻找阻断该进程的可能方法具有重要的科学及临床价值。
HSC是一种肝脏特异性间质细胞,在肝脏组织损伤、应激等条件下,HSC发生表型转化,即进入激活状态。胃癌肝转移灶中存在大量激活的HSC,活化的HSC还可分泌利于肿瘤生长的细胞外基质,改变基质金属蛋白酶(matrix metalloproteinases, MMPs)及金属蛋白酶抑制物的分泌水平[2]。MMPs是一个大家族,几乎能降解细胞外基质中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键作用[3]。在众多MMPs中,MMP-2和 MMP-9参与血管形成与基底膜的降解直接有关,与肿瘤转移和预后有关[4]。体外实验中将肿瘤细胞与HSC共培养可以明显提高肿瘤细胞的增殖与侵袭能力。与以上数据一致,使用激活的HSC所制备的条件培养基也表现出了与体外实验一致的增强肿瘤细胞增殖、迁移与侵袭的能力[5]。综上所述,激活的HSC可能提供了一个促转移性肿瘤细胞生长的微环境。
MACC1是Stein等[6-7]研究结肠癌时新发现的一个基因,它位于人类的7号染色体的副链上(7p21.1),其编码的蛋白含有四个结构域。MACC1最初在原发性和转移性的结肠癌样本中鉴定,并被证实为转移形成和无转移生存率的独立预后因子。后来研究证实,MACC1与许多其他肿瘤的发生、发展及进展关系密切,其在许多肿瘤中呈现高表达,包括乳腺癌[8]、胃癌[9]、卵巢癌[10]、神经胶质瘤[11]及肺癌[12]等,其高表达与许多肿瘤患者的预后和高转移潜能关系密切[13-14]。前期研究[3]表明,上调MACC1基因表达可以促进HGF/C-MET通路及EMT进程,从而促进胃癌的迁移侵袭。本实验结果显示,MACC1稳定过表达的HSC MMP-2、MMP-9的表达水平明显上调,根据上述结果,我们提出如下假说: MACC1诱导肝脏HSC激活,并通过分泌MMPs预先营造一个适合胃癌细胞生存微环境,最终通过HGF/C-MET信号轴趋化MACC1表达增强的胃癌细胞靶向肝转移。
综上所述,我们通过构建MACC1过表达载体、慢病毒包装并感染HSC的方法,筛选MACC1稳定过表达的肝星状细胞系,通过Transwell小室体外共培养胃癌细胞,发现与MACC1稳定过表达的HSC共培养的胃癌细胞迁移侵袭能力增强。MACC1对HSC分泌MMPs的调控作用研究为预防肿瘤转移提供了可能的治疗靶点,这一工作将有利于我们进一步开展MACC1在胃癌肝转移微环境中参与调控作用的研究。
[1]Fock KM. Review article: the epidemiology and prevention of gastric cancer [J]. Aliment Pharmacol Ther, 2014, 40(3): 250-260.
[2]Kang N, Gores GJ, Shah VH. Hepatic stellate cells: partners in crime for liver metastases? [J]. Hepatology, 2011, 54(2): 707-713.
[3]Dong Z, Bonfil RD, Chinni S, et al. Matrix metalloproteinase activity and osteoclasts in experimental prostate cancer bone metastasis tissue [J]. Am J Pathol, 2005, 166(4): 1173-1186.
[4]Okabe H, Beppu T, Hayashi H, et al. Hepatic stellate cells accelerate the malignant behavior of cholangiocarcinoma cells [J]. Ann Surg Oncol, 2011, 18(4): 1175-1184.
[5]Okabe H, Beppu T, Hayashi H, et al. Hepatic stellate cells may relate to progression of intrahepatic cholangiocarcinoma [J]. Ann Surg Oncol, 2009, 16(9): 2555-2564.
[6]Stein U, Walther W, Arlt F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis [J]. Nat Med, 2009, 15(1): 59-67.
[7]Stein U, Dahlmann M, Walther W. MACC1-more than metastasis? Facts and predictions about a novel gene [J]. J Mol Med (Berl), 2010, 88(1): 11-18.
[8]Huang Y, Zhang H, Cai J, et al. Overexpression of MACC1 and its significance in human breast cancer progression [J]. Cell Biosci, 2013, 3(1): 16.
[9]Ding Y, Wang Y, Chen J, et al. p21 overexpression sensitizes osteosarcoma U2OS cells to cisplatin via evoking caspase-3 and Bax/Bcl-2 cascade [J]. Tumour Biol, 2014, 35(4): 3119-3123.
[10]Zhang R, Shi H, Chen Z, et al. Effects of metastasis-associated in colon cancer 1 inhibition by small hairpin RNA on ovarian carcinoma OVCAR-3 cells [J]. J Exp Clin Cancer Res, 2011, 30: 83.
[11]Yang T, Kong B, Kuang YQ, et al. Overexpression of MACC1 protein and its clinical implications in patients with glioma [J]. Tumour Biol, 2014, 35(1): 815-819.
[12]Shimokawa H, Uramoto H, Onitsuka T, et al. Overexpression of MACC1 mRNA in lung adenocarcinoma is associated with postoperative recurrence [J]. J Thorac Cardiovasc Surg, 2011, 141(4): 895-898.
[13]Zhu M, Xu Y, Mao X, et al. Overexpression of metastasis-associated in colon cancer-1 associated with poor prognosis in patients with esophageal cancer [J]. Pathol Oncol Res, 2013, 19(4): 749-753.
[14]Shirahata A, Fan W, Sakuraba K, et al. MACC1 as a marker for vascular invasive hepatocellular carcinoma [J]. Anticancer Res, 2011, 31(3): 777-780.
(责任编辑:马 军)
Effect of expressions of MMP-2 and MMP-9 regulated hepatic stellate cells by MACC1 on ability of migration and invasion of gastric carcinoma cells
WANG Man1, ZHU Zhenhong2, ZHU Zhengqiu3
1.School of Postgraduate, Xuzhou Medical College, Xuzhou 221000; 2.Department of Gastroenterology, Lianyungang First People’s Hospital; 3.Department of Oncology, the Affiliated Hospital of Xuzhou Medical College, China
Objective To investigate the regulatory effect of hepatic stellate cell (HSC) on expressions of MMP-2 and MMP-9 by MACC1 and effects on ability of migration and invasion of gastric carcinoma cells.Methods The recombinant lentiviral particles of MACC1 (LV-MACC1-GFP) and lentiviral particles of empty vector (LV-GFP) were used to infect HSC, named overexpression group and vector group, non-transfected HSC was as blank control group. Cells in three groups were cultured in accordance with routine, the expressions of MMP-2 and MMP-9 in human HSC were detected by Western blotting and RT-PCR. Cells in three groups were co-cultured with MKN45 gastric carcinoma cells in vitro, the capabilities of migration and invasion were measured by Transwell assay. Results Compared with the vector group and blank control group, the expressions of MMP-2 and MMP-9 mRNA and protein in overexpression group were significantly increased (P<0.01). Transwell test indicated that the capabilities of migration and invasion of MKN45 co-cultured with overexpression group were significantly higher than the other two groups (P<0.01).Conclusion MACC1 may regulate the expressions of MMP-2 and MMP-9 in HSC, and enhance the ability of migration and invasion of gastric carcinoma cells.
MACC1; Hepatic stellate cells; Matrix metalloproteinases; Gastric carcinoma; Migration; Invasion
江苏省卫生厅基金(H201323)
王曼,硕士,研究方向:消化道肿瘤的综合防治。E-mail:865923484@qq.com
朱正秋,教授,研究方向:消化道肿瘤的综合防治。E-mail:js82880999@126.com
10.3969/j.issn.1006-5709.2016.07.013
R735.2
A
1006-5709(2016)07-0765-04
2015-11-09
