DP方案化疗结合胸腺肽α1对Ⅱ、Ⅲ期老年食管癌患者新辅助化疗及手术后免疫功能的影响
2016-06-21耿纪群
耿纪群, 翁 鸢, 蔡 铭
无锡市第四医院胸外科,江苏 无锡 214062
其他论著
DP方案化疗结合胸腺肽α1对Ⅱ、Ⅲ期老年食管癌患者新辅助化疗及手术后免疫功能的影响
耿纪群, 翁 鸢, 蔡 铭
无锡市第四医院胸外科,江苏 无锡 214062
目的 探讨DP(多西他赛+奈达铂)方案化疗结合胸腺肽α1对Ⅱ、Ⅲ期老年食管癌患者新辅助化疗(neoadjuvant chemotherapy,NC)及手术后免疫功能的影响。方法 将2013年3月-2014年9月在无锡市第四医院住院治疗的80例Ⅱ、Ⅲ期老年食管癌患者随机分为治疗组和对照组,每组40例,治疗组采用术前DP方案化疗结合胸腺肽α1治疗,对照组只用DP方案化疗。分别于化疗前1 d、化疗1个周期、2个周期后及手术后7 d抽取患者外周血,运用流式细胞术(flow cyometry,FCM)检测T细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)的百分率及NK细胞含量变化。结果 化疗前,两组CD3+、CD4+、CD8+、CD4+/CD8+水平差异无统计学意义(P>0.05);化疗1个周期、2个周期后及术后7 d,治疗组CD3+、CD4+、CD8+、CD4+/CD8+水平显著高于对照组(P<0.05),且化疗2个周期后和术后7 d,治疗组CD3+、CD4+、CD8+、CD4+/CD8+水平较化疗前增加幅度显著;治疗组NK细胞含量显著高于对照组(P<0.05);同时发现治疗组化疗不良反应显著低于对照组(P<0.05),且在粒细胞减少上,治疗组更著低于对照组(P=0.001);在术后并发症方面,两组总发生率相比,差异无统计学意义(P=0.356),但治疗组肺部感染发生率显著低于对照组(P<0.05)。结论 DP方案化疗结合胸腺肽α1应用于Ⅱ、Ⅲ期老年食管癌患者NC,可有效增强患者免疫功能,提高患者对化疗及手术的耐受性,且不良反应小,有利于改善患者生活质量。
胸腺肽α1;免疫功能;晚期食管癌;新辅助化疗
食管癌在我国是最常见的恶性肿瘤之一,因其发病隐匿、早期诊断困难,50%的患者确诊时已是晚期[1]。Ⅱ、Ⅲ期食管癌患者除接受大范围手术外,常需接受辅助化疗以改善其预后[2]。新辅助化疗(neoadjuvant chemotherapy,NC)是指在恶性肿瘤局部实施手术或放疗前应用的全身性化疗,目的是使肿瘤缩小、降低病理分期和控制远处微小转移病灶,从而使不能直接手术切除或难以切除的病灶转化为可以切除的病灶,提高手术切除率,进而提高生存率[3]。NC联合手术治疗可以提高食管癌患者的生存率,但化疗的不良反应可能对患者造成沉重的身心负担,尤其是老年食管癌患者因高龄、器官功能衰退等各种因素,对化疗的耐受性差,如何提高老年食管癌患者的免疫功能,增强其对化疗及手术的耐受性,成为食管癌治疗的热点。人工合成的胸腺肽α1是一种较为有效的提高机体免疫功能的生物反应调节剂,国内外用于肝炎和恶性肿瘤的治疗已取得满意疗效[4]。本研究通过对80例Ⅱ、Ⅲ期老年食管癌患者的前瞻性研究,旨在探讨DP(多西他赛+奈达铂)方案化疗结合胸腺肽α1对Ⅱ、Ⅲ期老年食管癌患者NC及手术后免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2013年3月-2014年9月在无锡市第四医院住院治疗的老年食管癌患者,纳入标准:① 年龄60~72岁;② 纤维胃镜确诊食管癌,经肝脏B超、胸片等检查,无远处转移,临床分期为有手术切除适应证的T3N0M0、T2N1M0和T3N1M0期;③ 所有患者KPS评分≥80分,患者入院前均未接受过放化疗及其他抗肿瘤治疗,肝肾功能、血常规、心肺功能均能耐受化疗及手术治疗。入选患者80例,随机分为治疗组和对照组,每组40例,其中对照组男25例,女15例,年龄60~71岁,平均年龄(62.8±5.2)岁;病理类型为鳞癌29例,腺癌11例;临床分期为Ⅱ期18例(T3N0M0 10例、T2N1M0 8例),Ⅲ期(T3N1M0) 22例。治疗组男29例,女11例,年龄60~72岁,平均年龄(63.1±4.9)岁;病理类型为鳞癌32例,腺癌8例;临床分期为Ⅱ期15例(T3N0M0 9例、T2N1M0 6例),Ⅲ期(T3N1M0) 25例。两组患者年龄、性别比例、病理类型、病理分期等方面相比,差异无统计学意义(P>0.05),具有可比性(见表1)。
表1 两组患者临床资料比较
Tab 1 Comparison of clinical data between two groups

例数性别(男/女)平均年龄(岁)病理类型(鳞癌/腺癌)临床分期(Ⅱ期/Ⅲ期)治疗组4029/1163.1±4.932/815/25对照组4025/1562.8±5.229/1118/22χ2值0.1800.0210.0180.015P值0.7240.8740.9910.913
1.2 方法 所有患者均采用术前DP方案(多西他赛75 mg/m2,静脉滴注,第1天;奈达铂80 mg/m2,静脉滴注,第2天)化疗,3周为1个周期,共计2个周期,化疗结束后2周进行手术。不同之处:治疗组于化疗前3 d开始,皮下注射胸腺肽α1(1.6 mg/次,1次/d),直至化疗结束后1周。
1.3 细胞免疫功能检测 分别于化疗前1 d、化疗1周期、2周期结束后3 d、手术后7 d于早晨(8∶00~9∶00)空腹采集患者静脉血,应用流式细胞仪检测外周血淋巴细胞及其亚群。分别计数患者CD3+、CD4+、CD8+的阳性百分率,CD4+/CD8+及NK细胞含量变化。用药前、后各取患者2 ml EDTA抗凝的新鲜血液备用。采用鼠抗人CD3+、CD4+、CD8+、CD16+56+直标荧光抗体(Immunotech公司,法国)标记样本,Blying solytion(Immunotech 公司,法国)溶解红细胞后,以Beckman Coulter Epics XL流式细胞仪检测淋巴细胞亚群水平(CD3+、CD4+、CD8+)及NK(CD16+56+)细胞数量。CD3+、CD3+/CD4+、CD3+/CD8+、CD16+/CD56+分别主要代表T细胞、Th细胞、Ts细胞及NK细胞。
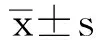
2 结果
2.1 细胞免疫情况 化疗前,两组患者外周血CD3+、CD4+、CD8+、CD4+/CD8+水平差异无统计学意义(P>0.05);化疗1周期、2周期后和术后7 d,治疗组CD3+、CD4+、CD8+、CD4+/CD8+水平显著高于对照组(P<0.05),且化疗2周期后和术后7 d,治疗组CD3+、CD4+、CD8+、CD4+/CD8+水平较化疗前增加幅度显著;治疗组NK细胞含量显著高于对照组(P<0.05,见表2)。


例数CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+NK细胞治疗组40 化疗前72.8±4.748.2±3.724.6±2.61.8±1.48.1±2.1 化疗1周期72.5±5.1*Δ49.7±1.4*Δ25.7±2.4*Δ1.9±2.1*Δ8.5±2.5*Δ 化疗2周期78.3±6.2*Δ50.2±2.1*Δ27.9±2.2*Δ2.3±1.7*Δ10.6±2.3*Δ 术后7d79.6±3.6*Δ51.6±2.3*Δ29.1±2.1*Δ2.5±1.9*Δ11.1±2.9*Δ对照组40 化疗前72.3±4.947.8±3.923.7±2.61.6±1.57.8±2.1 化疗1周期69.7±5.1*47.2±1.4*22.9±2.4*1.7±2.0*7.3±2.5* 化疗2周期58.1±6.2*37.2±2.1*21.4±2.2*1.9±1.3*7.1±2.6* 术后7d54.4±3.6*36.8±2.3*21.1±2.1*1.4±1.2*5.9±2.9*
注:与本组化疗前相比,*P<0.05;与同期对照组相比,ΔP<0.05。
2.2 不良反应发生情况 所有患者完成化疗,全部病例无术中死亡者。临床主要不良反应有恶心、呕吐、粒细胞减少和食管炎等。化疗1周期后,治疗组恶心、呕吐反应、粒细胞减少程度和食管炎与对照组相比,差异无统计学意义(P>0.05);化疗2周期后,治疗组恶心、呕吐反应、粒细胞减少程度和食管炎显著低于对照组(P<0.05,见表3)。
2.3 术后并发症的发生情况 术后并发症主要为吻合口瘘、肺部感染、肺不张、心律失常、呼吸衰竭、切口感染等,治疗组并发症总发生率为20.0%(8/40),对照组总发生率为37.5%(15/40),两组相比,差异无统计学意义(χ2=1.578,P=0.356)。其中,肺部感染发生率差异有统计学意义(P<0.05,见表4)。
表3 化疗期间两组患者不良反应发生情况比较[例数(%)]
Tab 3 Comparison of occurrence of adverse reactions during chemotherapy between two groups [n(%)]

例数恶心呕吐粒细胞减少食管炎化疗1周期 治疗组409(22.5)7(17.5)5(12.5)3(7.5) 对照组4016(40.0)11(27.5)12(30.0)8(20.0)χ2值0.1210.1630.1190.161P值0.6280.7140.5310.752化疗2周期 治疗组403(7.5)4(10.0)2(5.0)1(2.5) 对照组4029(72.5)23(57.5)31(77.5)18(45.0)χ2值3.8963.1583.9174.012P值0.0030.0030.0010.002
表4 两组患者术后并发症发生情况比较[例数(%)]
Tab 4 Comparison of postoperative complication between two groups [n(%)]

例数吻合口瘘肺部感染肺不张心律失常治疗组401(2.5)2(5.0)3(7.5)2(5.0)对照组403(7.5)9(22.5)2(5.0)1(2.5)χ2值0.0171.8170.0120.011P值0.9110.0410.9840.986
3 讨论
食管癌是我国常见的恶性肿瘤,手术是目前治疗的首选方法。早期食管癌的手术切除率高,疗效较好,但大多数患者确诊时已是中晚期,长期生存率较低[5]。部分生活质量评分较高的局部晚期食管癌患者需行综合治疗,手术前行NC的意义在于缩小瘤体从而减少手术的范围及创伤,使部分无法根治的肿瘤降期达到可以手术根治[6]。肿瘤患者免疫功能相对低下,免疫细胞不能有效识别、排斥和杀灭肿瘤细胞是肿瘤发生的根本原因[7]。机体抗肿瘤的主要免疫机制为细胞免疫,其效应是通过体内的免疫活性细胞,主要是NK细胞、T淋巴细胞、巨噬细胞完成的。T淋巴细胞需致敏后才对肿瘤细胞有特异性的杀伤作用。因此,患者外周血T细胞亚群及NK细胞的变化是机体抗肿瘤免疫能力的一个侧面反映[8]。老年食管癌患者大多免疫功能低下,肿瘤细胞的增生和增殖通常伴有免疫应答的减弱[9],因此,采取措施提高肿瘤患者免疫功能对肿瘤治疗具有重要意义。
胸腺肽α1是由28个氨基酸组成的多肽,有研究[10]认为,胸腺肽α1可增强抗肿瘤疗效。其主要是通过促进T淋巴细胞的成熟、分化,调控T淋巴细胞功能,从而增强机体免疫效应;同时,还可使受抑制的免疫功能得到部分恢复,增强机体抗肿瘤能力。机体在患肿瘤状态下,T细胞功能不全和受到抑制,表现为数量减少、功能改变和T细胞亚群比例失调[11]。应用胸腺肽α1治疗后,多项免疫学指标包括T细胞亚群,尤其是NK细胞活性得到明显改善,对晚期的恶性肿瘤患者化疗有明显的辅助治疗作用[12]。
在本研究中,化疗前两组患者外周血CD3+、CD4+、CD8+、CD4+/CD8+水平无明显差异;1周期化疗结束、2周期化疗结束和术后7 d,治疗组T细胞亚群水平均显著高于对照组,且术后7 d治疗组的T细胞亚群比例增加幅度大于2周期化疗结束,更大于1周期化疗结束,说明随着胸腺肽α1作用时间的增加,患者淋巴细胞亚群比例逐渐增加,细胞免疫功能逐渐增强;2周期化疗结束后,治疗组不良反应的发生情况显著低于对照组,且在粒细胞减少上,治疗组与对照组的差异更显著;在术后并发症方面,两组的总发生率未见显著差异,但治疗组肺部感染的发生显著低于对照组,这与胸腺肽α1的作用有着密切关系;治疗组NK细胞含量显著高于对照组,且随着胸腺肽α1作用时间的增加,治疗组NK细胞含量不断增加,这与文献[12]报道结果一致,但术后7 d的增长幅度较前减小,这可能与外科手术对患者的应激影响有关。
综上所述,DP方案化疗结合胸腺肽α1应用于Ⅱ、Ⅲ期老年食管癌患者NC,可有效增强患者免疫功能,提高患者对化疗及手术的耐受性,且不良反应小,有利于改善患者生活质量。
[1]Campbell NP, Villaflor VM. Neoadjuvant treatment of esophageal cancer [J]. World J Gastroenterol, 2010, 16(30): 3793-3803.
[2]金芳玲, 胡祖良, 马海锋, 等. 新辅助放化疗联合手术与单纯手术治疗局部晚期食管癌的疗效比较[J]. 实用肿瘤杂志, 2011, 26(5): 2523-2525. Jin FL, Hu ZL, Ma HF, et al. Treatment effect of neoadjuvant chemoradiotherapy followed by surgery versus surgery alone in local advanced esophageal carcinoma [J]. Journal of Practical Oncology, 2011, 26(5): 2523-2525.
[3]Wolf MC, Stahl M, Krause BJ, et al. Curative treatment of esophageal carcinoma: current options and future developments [J]. Radiat Oncol, 2011, 6: 55.
[4]Garaci E, Pica F, Serafino A, et al. Thymosin α1 and cancer: action on immune effector and tumor target cells [J]. Ann N Y Acad Sci, 2012, 1269: 26-33.
[5]沈冬, 卞秀华. 放疗同步FOLFOX方案治疗Ⅲ期食管癌的临床观察[J]. 中华肿瘤防治杂志, 2010, 17(22): 1849-1851. Shen D, Bian XH. Three-dimensional conformal radiotherapy combined with FOLFOX regimen for patients with stage Ⅲ esophageal cancer [J]. Chinese Journal of Cancer Prevention and Treatment, 2010, 17(22): 1849-1851.
[6]周俊, 陈宏俊, 夏洪. 新辅助化疗对老年食管癌患者生活质量和手术根治率的影响[J]. 江苏大学学报(医学版), 2010, 20(6): 546-547, 550. Zhou J, Chen HJ, Xia H. The effect of neoadjuvant chemotherapy on the quality of life and the rate of radical operation in elderly patients with esophageal cancer [J]. Journal of Jiangsu University (Medicine Edition), 2010, 20(6): 546-547, 550.
[7]乔锐, 姜凤久, 张岩. 胸腺肽α1对高龄肿瘤患者淋巴细胞免疫功能的影响[J]. 临床军医杂志, 2015, 43(7): 707-709. Qiao R, Jiang FJ, Zhang Y. Clinical observation of Thymosin α1 on the influence of immune function of lymphocyte in elderly tumor patients [J]. Clin J Med Offic, 2015, 43(7): 707-709.
[8]王纯, 米利群, 费晓东, 等. 胸腺肽α1治疗老年晚期恶性肿瘤的效果分析[J]. 中国当代医学, 2014, 21(23): 101-102, 105. Wang C, Mi LQ, Fei XD, et al. Effect analysis of thymosin α1 in the treatment of elderly patients with advanced malignant tumor [J]. China Modern Medicine, 2014, 21(23): 101-102, 105.
[9]高飞, 贾霖, 杜小波, 等. 胸腺肽α1对Ⅱ、Ⅲ期老年食管癌患者新辅助化疗及手术后免疫功能的影响[J]. 现代肿瘤学, 2015, 23(7): 954-957. Gao F, Jia L, Du XB, et al. Effects of thymosin α1 on immune function in elderly patients with stage of Ⅱ, Ⅲ esophageal cancer after neoadjuvant chemotherapy and surgery [J]. Modern Oncology, 2015, 23(7): 954-957.
[10]Wu XX, Sun Y, Guo WJ, et al. Rebuilding the balance of STAT1 and STAT3 signalings by fusaruside, a cerebroside compound, for the treatment of T-cell-mediated fulminant hepatitis in mice [J]. Biochem Pharmacol, 2012, 84(9): 1164-1173.
[11]李青, 冯奉仪, 张湘茹, 等. 全身化疗加或不加胸腺肽α1治疗晚期非小细胞肺癌[J]. 中国肿瘤临床, 2001, 28(3): 201-203. Li Q, Feng FY, Zhang XR, et al. Study of chemotherapy with or without thymosin-alpha in treatment of advanced non-small cell lung cancer [J]. Chinese Journal of Clinical Oncology, 2001, 28(3): 201-203.
[12]熊亮发, 贾玲, 刘春生, 等. 化疗联合胸腺肽α1治疗乳腺癌的基础与临床观察[J]. 中国医药, 2010, 5(4): 357-358. Xiong LF, Jia L, Liu CS, et al. Combination of thymosin alpha 1 and chemotherapy for treating breast cancer [J]. China Medicine, 2010, 5(4): 357-358.
(责任编辑:李 健)
Effects of DP combined with thymosin α1 on immune function after neoadjuvant chemotherapy and surgery in elderly patients with stage of Ⅱ, Ⅲ esophageal cancer
GENG Jiqun, WENG Yuan, CAI Ming
Department of Thoracic Surgery, Wuxi City Fourth Hospital, Wuxi 214062, China
Objective To study the effects of Docetaxel and Nedaplatin (DP) combined with thymosin α1 on immune function after neoadjuvant chemotherapy (NC) and surgery in elderly patients with stage of Ⅱ, Ⅲ esophageal cancer. Methods Eighty elderly patients in Wuxi City Fourth Hospital from Mar. 2013 to Sep. 2014 with stage of Ⅱ, Ⅲ esophageal cancer were randomly divided into treatment group and control group, each group had 40 patients. The treatment group
chemotherapy with DP plus thymosin α1 before surgery, while the control group received chemotherapy (DP) only. Blood samples were drawn on 1 day prior to the chemotherapy, chemotherapy after one cycle and two cycles as well as 7 days after surgery. Flow cytometry was used to detect the levels of CD3+, CD4+, CD8+, CD4+/CD8+and NK cell. Results There were no differences in the levels of CD3+, CD4+, CD8+, CD4+/CD8+between the treatment group and control group before chemotherapy (P>0.05). The levels of CD3+, CD4+, CD8+, CD4+/CD8+in the treatment group were significantly higher than those in the control group at one cycle and two cycles after chemotherapy and 7 days after surgery (P<0.05), and after 2 cycles of chemotherapy and 7 days after surgery, CD3+, CD4+, CD8+, CD4+/CD8+levels increased more significantly than before chemotherapy in treatment group; NK cell was significantly higher than that in the control group (P<0.05); the toxicity of chemotherapy was less in the treatment group (P<0.05); and the granulocytopenia in treatment group was more significantly lower than that in the control group (P=0.001); there was no significant difference in the total incidence of complications between two groups (P=0.356), but the incidence of pulmonary infection in treatment group was significantly lower than that in control group (P<0.05). Conclusion DP combined with thymosin α1 in elderly patients with stage of Ⅱ, Ⅲ esophageal cancer after NC can enhance the patients’ immune function, improve the tolerance to chemotherapy operation, reduce the toxicity of chemotherapy and improve the quality of life.
Thymosin α1; Immune function; Advanced esophageal cancer; Neoadjuvant chemotherapy
10.3969/j.issn.1006-5709.2016.07.017
耿纪群,硕士,主治医师,研究方向:食管癌、肺癌。E-mail:gengjiqun44@163.com
R735.1
A
1006-5709(2016)07-0787-04
2015-11-07
