辣椒素对水浸-束缚应激大鼠胃动力的作用及机制研究
2016-06-21李泽培
李泽培,邱 野,彭 燕
宜宾市第二人民医院 1.消化内科;2.肿瘤科,四川 宜宾 644000;3.西南医科大学附属医院消化内科
辣椒素对水浸-束缚应激大鼠胃动力的作用及机制研究
李泽培1,邱 野2,彭 燕3
宜宾市第二人民医院 1.消化内科;2.肿瘤科,四川 宜宾 644000;3.西南医科大学附属医院消化内科
目的 探讨辣椒素(capsaicin,CAP)对水浸-束缚应激(water immersion restraint stress,WIRS)大鼠胃动力的作用及机制。方法 雄性SD大鼠30只,随机分为3组:正常对照组、WIRS模型组、CAP干预组。其中正常对照组自由摄食进水;WIRS模型组每日WIRS 1 h后自由摄食进水;CAP干预组每日WIRS 1 h后喂食CAP饲料。4周后所有大鼠给予酚红溶液灌胃后麻醉处死,测定胃酚红排空率;采用ELISA法检测血浆胃动素(motilin,MTL)水平;采用免疫组化方法检测胃窦辣椒素受体(transient receptor potential vanilloid1, TRPV1)、P物质(substance P,SP)的表达;用RT-PCR方法检测c-kit mRNA、SCF mRNA的转录水平。结果 大鼠胃酚红排空率:WIRS模型组胃酚红排空率显著低于其余两组(P<0.05);正常对照组胃酚红排空率与CAP干预组相比,差异无统计学意义(P>0.05)。血浆MTL水平:WIRS模型组血浆MTL水平显著低于其余两组(P<0.05);正常对照组血浆MTL水平显著低于CAP干预组(P<0.05)。免疫组化结果: 大鼠胃窦组织TRPV1表达积分:CAP干预组TRPV1表达水平显著高于其余两组(P<0.05);正常对照组TRPV1表达水平与WIRS模型组相比,差异无统计学意义(P>0.05)。大鼠胃窦组织SP表达积分:WIRS模型组SP表达水平显著低于其余两组(P<0.05);正常对照组SP表达水平显著低于CAP干预组(P<0.05)。RT-PCR方法检测结果:大鼠胃窦组织c-kit mRNA表达结果:WIRS模型组c-kit mRNA转录水平显著低于正常对照组(P<0.05);正常对照组、WIRS模型组c-kit mRNA转录水平与CAP干预组相比,差异无统计学意义(P>0.05)。大鼠胃窦组织SCF mRNA表达结果:WIRS模型组SCF mRNA转录水平显著低于其余两组(P<0.05);正常对照组SCF mRNA转录水平显著低于CAP干预组(P<0.05)。结论 CAP可能对WIRS大鼠胃动力具有改善作用,其机制可能与CAP调节TRPV1、SP的表达及MTL的释放有关,是否与Cajal间质细胞相关尚不明确。
辣椒素;水浸-束缚应激;胃动力;c-kit;SCF;TRPV1;SP
胃肠动力障碍性疾病(disorders of gastrointestinal motility,DGIM)是最常见的一类消化系统疾病,包括胃食管反流病(gastroesophageal reflux disease,GERD)、功能性消化不良(functional dyspepsia,FD)、肠易激综合征(irritable bowel syndrome,IBS)、糖尿病胃轻瘫(diabetic gastroparesis,DGP)等,这类疾病严重影响患者的生活质量,同时又造成大量医疗资源支出,已成为当今社会一重大医疗卫生问题[1]。辣椒素(capsaicin,CAP)是从辣椒中提取的主要活性成分,现有关于CAP的研究资料主要集中在其与疼痛的关系及镇痛方面,CAP已被用作研究疼痛的工具药[2]。近年来的研究[3]发现CAP可能对胃肠动力产生一定作用。本实验通过观察CAP对水浸-束缚应激(water immersion restraint stress,WIRS)大鼠胃排空率的影响,初步探讨CAP对大鼠胃动力的作用及可能机制。
1 材料与方法
1.1 材料 雄性SD大鼠30只,体质量180~250 g,购自西南医科大学实验动物中心。95%的CAP(河南倍特生物技术有限公司)、兔抗大鼠TRPV1多克隆抗体(Bioworld Technology公司)、兔抗大鼠SP多克隆抗体(Bioworld Technology公司)、二步法免疫组化检测试剂(PV-6001)(北京中杉金桥生物技术有限公司)、总RNA提取试剂盒(Trizol试剂盒)(北京TIANGEN)、RT-PCR试剂盒(成都博瑞克生物技术有限公司)、DNA Maker(北京TIANGE)、紫外分光光度仪(SHIMADZU公司)、水平电泳仪(美国Bio-Rad公司)、PCR扩增仪(杭州博日公司)、凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 CAP饲料的配制方法:称取95%的CAP 105.3 mg(CAP含量为100 mg),溶解于30 ml的食用油中,加入面粉100 g,充分混匀,即为CAP含量1 mg/g的大鼠饲料。
1.2.2 造模方法:将大鼠四肢束缚固定于木板上,然后将鼠板垂直浸入(19±1)℃水中,水面平胸骨剑突,持续1 h。
1.2.3 动物及分组:SD大鼠用代谢笼饲养,温度(24±1)℃,随机分为3组,每组10只。即:正常对照组,自由进食,连续4周;WIRS模型组,每日WIRS 1 h,WIRS结束后自由进食,连续4周;CAP干预组,每日WIRS 1 h,WIRS结束后喂食CAP饲料5 g/kg,待CAP饲料食用完后再给予自由进食,连续4周。
1.2.4 取材:4周后所有实验大鼠禁食24 h,于第二日早晨给予浓度为50 mg/dl的酚红溶液灌胃,2 ml/鼠。灌入酚红溶液30 min后处死大鼠,腹主动脉取血2 ml于采血管中(EDTA),取出鼠胃。
1.2.5 胃酚红排空率测定:用蒸馏水将胃内容物冲洗到器皿中,定容为20 ml,加入20 ml浓度为0.5 mol/L的NaOH搅拌混匀,静置1 h,取5 ml上清液,加入0.5 ml浓度为20%的三氯乙酸去蛋白,以3 500 r/min离心10 min,取上清液,用分光光度计测定560 nm波长下待测液的吸光度值,为实测酚红吸光度。另取2 ml酚红溶液,先后加入18 ml蒸馏水、20 ml浓度为0.5 mol/L的NaOH、4 ml浓度为20%的三氯乙酸搅拌混匀,用分光光度计测定560 nm波长下标准液的吸光度值,为标准酚红吸光度。大鼠的胃酚红排空率(%)=(1-实测酚红吸光度/标准酚红吸光度)×100%。
1.2.6 ELISA法测定血浆MTL含量:血液标本离心后取上层血浆标本,共设置6个标准孔,每个标准孔加入0.1 ml样品稀释液,于第一孔加入0.1 ml标准品,混匀后用加样器吸出0.1 ml移至第二孔,混匀后用加样器吸出0.1 ml加入第三孔,反复作倍比稀释直至第五孔,最后使第五孔剩余0.1 ml,将第六孔设为空白对照孔;加入0.1 ml待测血清于对应的反应板孔中并混匀,于37 ℃温育60 min;滤纸上拍干,每孔加350 μl洗涤液,静置30 s后弃去;反复洗涤5次;每孔加入0.1 ml生物素(Biotin),混匀,封住板孔,37 ℃温育60 min;每孔加入0.1 ml辣根过氧化物酶,混匀,封板膜封住板孔,37 ℃温育30 min;加入底物工作液A、B各50 μl,振荡混匀10 s,避光显色10 min;每孔加入100 μl 终止液,轻轻混匀30 s,终止反应;30 min内,以空白孔调零,用酶标仪在450 nm波长处测量各孔的OD值;据标品浓度及OD值算出标准曲线的回归方程;根据样品的OD值在公式上计算出样品浓度。
1.2.7 二步免疫组化法(PV法)检测胃窦组织TRPV1、SP表达情况:取大鼠胃窦组织,固定、脱水、石蜡包埋,制作成4 μm切片,切片在60 ℃恒温烤箱中烤片过夜。二甲苯脱蜡浓度由高到低梯度酒精水化,PBS液浸泡清洗,抗原修复液修复抗原,PBS液浸泡清洗,3%过氧化氢室温孵育去除内源性酶,PBS液浸泡冲洗,滴加一抗稀释液(1∶100),4 ℃过夜,第二天室温下复温30 min,PBS液清洗后加通用型二抗,PBS液清洗后DAB显色,自来水冲洗后苏木精显色,自来水冲洗,1%盐酸酒精分化,饱和碳酸锂反蓝,浓度由低到高梯度酒精脱水,二甲苯透明;晾干封片后读片。结果判定:棕黄色反应为阳性,参照文献[4]进行结果分析:选取同批次免疫组化切片于光镜下观察,随机观察5个视野,根据阳性反应的广度与深度分别计分:4分“++++”特别密集,3分“+++”密集,2分“++”中等,1分“+”稀疏,0分“-”阴性。
1.2.8 RT-PCR方法检测大鼠胃窦组织酪氨酸激酶受体(c-kit)mRNA及干细胞生长因子(stem cell factor,SCF)mRNA的转录:引物合成由生工生物工程(上海)股份有限公司完成(见表1)。
表1 引物
Tab 1 Primer

基因方向和序列长度(bp)c-kit上游:5'-TTGGCAAAGAAGA-CAACGAC-3'276下游:5'-GCACAGACACCACTGGGA-TA-3'SCF上游:5'-AACCCTCAACTATGTCGC-3'179下游:5'-CCACGAGGTCATCCACTA-3'GAPDH上游:5'-ACCACAGTCCATGCCAT-CAC-3'450下游:5'-TCCACCACCCTGTTGCTG-TA-3'
取大鼠胃窦组织,加1 ml裂解液R后研磨至细胞悬液,室温静置5 min,13 400×g离心5 min,转上清于离心管中,加入200 μl氯仿,剧烈振荡15 s,静置3 min,13 400×g离心10 min,将水相移至离心管中,与0.5倍体积无水乙醇混匀后转入吸附柱CR3中,13 400×g离心30 s,弃废液,加入去蛋白液RD 500 μl,13 400×g低温离心30 s,弃废液,加入漂洗液RW 600 μl,室温静置2 min,13 400×g低温离心30 s,弃废液,将吸附柱移入收集管中,13 400×g低温离心2 min,取出吸附柱,室温放置片刻,将吸附柱转入一个新的离心管中,加40 μl RNase-free ddH2O,室温放置2 min,13 400×g低温离心2 min。RNA的检测:每个标本取1 μl的RNA在紫外分光光度仪下检测其浓度与纯度。逆转录合成cDNA,逆转录前每个标本的RNA用RNase-free ddH2O配成相同浓度,按RT试剂盒(20 μl体系)说明在PCR管中配反应液,将混合液的PCR管放入PCR仪中,设置参数:30 ℃×10 min,4 ℃×20 min,99 ℃×5 min,4 ℃×5 min。PCR得到目的基因,配置PCR反应体系,将PCR管放入PCR仪中,进行PCR反应,设置反应条件:第一步:94 ℃×5 min,第二步:94 ℃×30 s,退火温度(GAPDH、c-kit、SCF退火温度分别为57.3 ℃、56.2 ℃、53.0 ℃)×30 s,72 ℃×1 min,循环30次,第三步:72 ℃×1 min。PCR产物琼脂糖电泳检测,电泳后紫外凝胶成像的结果用Quantity One软件分析各组相对表达量差异是否具有统计学意义。
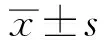
2 结果
2.1 大鼠胃酚红排空率 正常对照组胃酚红排空率为(62.91±1.10)%,WIRS模型组为(55.33±1.79)%,CAP干预组为(61.88±2.07)%。结果显示WIRS模型组大鼠胃酚红排空率显著低于其余两组(P<0.05);正常对照组胃酚红排空率与CAP干预组比较,差异无统计学意义(P>0.05)。
2.2 血浆MTL水平 正常对照组大鼠血浆MTL水平为(190.30±1.68)pg/ml,WIRS模型组为(179.75±1.72)pg/ml,CAP干预组为(200.06±2.06)pg/ml。结果显示WIRS模型组血浆MTL水平显著低于其余两组(P<0.05);正常对照组血浆MTL水平显著低于CAP干预组(P<0.05)。
2.3 胃窦组织TRPV1、SP的表达情况
2.3.1 TRPV1在胃窦组织的表达积分:正常对照组TRPV1表达水平为(2.30±0.48)分,WIRS模型组为(2.20±0.42)分,CAP干预组为(3.30±0.48)分。CAP干预组TRPV1表达水平显著高于其余两组(P<0.05);正常对照组TRPV1表达水平与WIRS模型组相比,差异无统计学意义(P>0.05,见图1)。
2.3.2 SP在胃窦组织的表达积分:正常对照组SP表达水平为(2.00±0.47)分,WIRS模型组为(1.20±0.42)分,CAP干预组为(3.20±0.63)分。WIRS模型组SP表达水平显著低于其余两组(P<0.05);正常对照组SP表达水平显著低于CAP干预组(P<0.05,见图2)。
2.4 胃窦组织c-kit mRNA、SCF mRNA的表达
2.4.1 胃窦组织c-kit mRNA的表达:正常对照组为0.624±0.016,WIRS模型组为0.606±0.011,CAP干预组为0.622±0.011。其中WIRS模型组c-kit mRNA转录水平显著低于正常对照组(P<0.05);正常对照组c-kit mRNA转录水平与CAP干预组相比,差异无统计学意义(P>0.05);WIRS模型组c-kit mRNA转录水平与CAP干预组相比,差异无统计学意义(P>0.05,见图3)。

图1 各组大鼠胃窦组织TRPV1的表达 A-1、A-2:正常对照组;B-1、B-2:WIRS模型组;C-1、C-2:CAP干预组
Fig 1 The expression of TRPV1 in the gastric antrum tissue of rats A-1, A-2: normal control group; B-1, B-2: WIRS model group; C-1, C-2: CAP group

图2 各组大鼠胃窦组织SP的表达 A-1、A-2:正常对照组;B-1、B-2:WIRS模型组;C-1、C-2:CAP干预组
Fig 2 The expression of SP in the gastric antrum tissue of rats A-1, A-2: normal control group; B-1, B-2: WIRS model group; C-1, C-2: CAP group

图3 RT-PCR检测各组c-kit mRNA的表达 A:正常对照组;B:WIRS模型组;C:CAP干预组
Fig 3 Expression of c-kit mRNA in each group detected by RT-PCR A: normal control group; B: WIRS model group; C: CAP group
2.4.2 胃窦组织SCF mRNA的表达:正常对照组为0.894±0.011,WIRS模型组为0.853±0.009,CAP干预组为0.932±0.009。WIRS模型SCF mRNA转录水平显著低于其余两组(P<0.05);正常对照组SCF mRNA转录水平显著低于CAP干预组(P<0.05,见图4)。

图4 RT-PCR检测各组SCF mRNA的表达 A:正常对照组;B:WIRS模型组;C:CAP干预组
Fig 4 Expression of SCF mRNA in each group detected by RT-PCR A: normal control group; B: WIRS model group; C: CAP group
3 讨论
CAP具有多种药理作用,已有研究[5-9]发现CAP具有止痛、降血压、改善呼吸功能、抗癌、减肥等作用。近年研究[3]发现CAP对消化功能有一定作用,其中对胃肠动力的作用已引起学者重视,故本实验通过观察CAP对实验大鼠胃排空作用,初步探讨CAP对胃动力的作用及机制。
3.1 CAP对胃肠动力的作用 有关CAP对胃肠动力作用的研究报道不一,多数研究认为小剂量CAP可促进胃动力,而大剂量则对胃动力产生抑制作用。Holzer-Petsche等[10]报道0.0015 mg/kg的CAP可引起大鼠胃平滑肌的收缩。而Takeuchi等[11]报道30 mg/kg的CAP灌胃能抑制大鼠的胃运动,在给药30 min后胃电波的收缩幅度抑制70%。Matsumoto等[12]报道CAP可引起大鼠结肠的双相收缩,即瞬时收缩和持久收缩。Barth等[13]报道CAP可引起豚鼠回肠平滑肌收缩,其机理与神经末梢释放生物活性物质刺激平滑肌细胞和肌间神经元有关。本实验结果提示:CAP干预后大鼠胃酚红排空率显著高于模型组,提示5 mg/kg的CAP饲料可能对WIRS大鼠胃动力具有促进作用。
3.2 CAP作用于胃肠动力的机制 胃肠动力受到神经因素和体液因素调节。神经因素中肠神经系统、Cajal间质细胞(interstitial cells of Cajal,ICC)、平滑肌细胞组成的网络对胃肠运动起重要作用[14]。在胃肠激素中以内分泌形式为主要作用方式的激素有:胃泌素、胃动素、胆囊收缩素、神经降压素等;而SP、血管活性肠肽(vasoactive intestinal peptide, VIP)、降钙素基因相关肽(calcitonin gene-related peptide, GRP)、生长抑素(somatostatin, SS)、脑啡肽等以胃肠肽的形式为主要作用方式。
3.3 CAP与TRPV1 TRPV1是一种通透钙离子的非选择性阳离子通道,CAP激活TRPV1后,导致细胞钙离子内流,激活CAP敏感传入神经元释放多种神经递质,进而产生多种生物学作用。Zhong等[15]报道CAP敏感的传入神经元(capsaicin sensitive afferent neurons,CSAN)广泛分布于胃肠道,而TRPV1分布在CSAN的胞体膜和感觉神经末梢上。Holzer等[16]报道CAP刺激胃肠道的TRPV1通道,激活CSAN释放多种神经递质,如SP、VIP、CGRP、胆囊收缩素、神经激肽A和兴奋性氨基酸等,从而与胃肠动力的调节有关。本实验结果显示CAP干预组大鼠胃窦组织TRPV1较正常对照组及WIRS模型组升高。推测CAP对实验大鼠胃动力的改善作用可能与CAP增加胃窦组织TRPV1的表达量相关。
3.4 CAP与胃肠肽 MTL主要由肠道M细胞、嗜铬样细胞分泌。Bardhan等[17]研究认为MTL可刺激其消化道中的MTL受体,引起消化间期移行性复合运动的周期变化,从而促进胃排空。周吕等[18]报道狗胃体和胃窦的肌间神经丛、黏膜下神经丛有大量MTL受体表达,并与肠神经系统(enteric nervous system, ENS)、ICC联系在一起,肠神经元通过释放神经递质作用于ICC,从而参与胃肠运动的调节。此外还有研究[19]认为MTL通过作用于ICC引起大鼠胃平滑肌的收缩。
SP在整个胃肠道和肠神经系统都有广泛分布[20]。研究[21-22]表明SP是调节胃肠运动的兴奋性神经递质,SP对胃肠道纵行肌和环行肌可表现为两相的收缩效应,即瞬时收缩和持久收缩。Schmidt等[23]研究认为SP对胃平滑肌的兴奋作用强于对幽门括约肌的收缩作用,因此总体表现为促进胃排空。Mulè等[24]研究发现ICC细胞膜上存在NK1-R,SP可能在NK1-R的介导下参与移行性复合运动的起搏。本实验结果显示CAP干预组血浆MTL水平、胃窦组织SP表达较WIRS组高。据此我们推测CAP可能对MTL的释放及SP表达具有调节作用,但尚需进一步实验予以证实。
3.5 胃肠运动的起搏细胞-ICC 1893年,西班牙解剖学家Ramny Cajal在家兔小肠肠神经元与小肠平滑肌细胞之间发现一种间质细胞,当时他认为这种间质细胞是交感神经元的末梢细胞[25]。随后人们把这种间质细胞命名为Cajal间质细胞(ICC),研究[26]发现ICC参与维持胃肠平滑肌的节律运动,同时具有产生、传导慢波电位,调节神经递质等功能。c-kit是ICC表面的特异性蛋白,几乎所有ICC表面均表达c-kit受体[27]。SCF是c-kit的自然配体,二者结合后启动的信号途径对维持ICC的生长、发育及表型起着重要作用[28]。
本实验RT-PCR结果显示WIRS模型组SCF mRNA转录水平显著低于CAP干预组,但c-kit mRNA转录水平与CAP干预组差异无统计学意义,故CAP是否与ICC有相关性尚不明确。CAP可能对胃动力具有改善作用,可能成为调节胃肠动力的新药,但其具体作用机制目前仍未阐明,尚需进一步研究加以探索。
[1]Halder SL, Locke GR 3rd, Schleck CD, et al. Natural history of functional gastrointestinal disorders: a 12-year longitudinal population-based study [J]. Gastroenterology, 2007, 133(3): 799-807.
[2]林绮雯, 杨得坡, 黄世亮, 等. 辣椒素的药理与临床研究概况[J]. 广东药学, 2000, 10(5): 5-8. Lin QW, Yang DP, Huang SL, et al. Recent progress of pharmacological and clinical research of capsaicin [J]. Guangdong Pharmaceutical Journal, 2000, 10(5): 5-8.
[3]Rofes L, Arreola V, Martin A, et al. Natural capsaicinoids improve swallow response in older patients with oropharyngeal dysphagia [J]. Gut, 2013, 62(9): 1280-1287.
[4]Vanderwinden JM, De Laet MH, Schiffmann SN, et al. Nitric oxide synthase distribution in the enteric nervous system of Hirschsprung’s disease [J]. Gastroenterology, 1993, 105(4): 969-973.
[5]Vaishnava P, Wang DH. Capsaicin sensitive-sensory nerves and blood pressure regulation [J]. Curr Med Chem Cardiovasc Hematol Agents, 2003, 1(2): 177-188.
[6]Ebihara T, Takahashi H, Ebihara S, et al. Capsaicin troche for swallowing dysfunction in older people [J]. J Am Geriatr Soc, 2005, 53(5): 824-828.
[7]Rapoport AM, Bigal ME, Tepper SJ, et al. Intranasal medications for the treatment of migraine and cluster headache [J]. CNS Drugs, 2004, 18(10): 671-685.
[8]Sánchez AM, Sánchez MG, Malagarie-Cazenave S, et al. Induction of apoptosis in prostate tumor PC-3 cells and inhibition of xenograft prostate tumor growth by the vanilloid capsaicin [J]. Apoptosis, 2006, 11(1): 89-99.
[9]Bartness TJ, Kay Song C, Shi H, et al. Brain-adipose tissue cross talk [J]. Proc Nutr Soc, 2005, 64(1): 53-64.
[10]Holzer-Petsche U, Seitz H, Lembeck F. Effect of capsaicin on gastric corpus smooth muscle of the rat in vitro [J]. Eur J Pharmacol, 1989, 162(1): 29-36.
[11]Takeuchi K, Niida H, Matsumoto J, et al. Gastric motility changes in capsaicin-induced cytoprotection in the rat stomach [J]. Jpn J Pharmacol, 1991, 55(1): 147-155.
[12]Matsumoto K, Kurosawa E, Terui H, et al. Localization of TRPV1 and contractile effect of capsaicin in mouse large intestine: high abundance and sensitivity in rectum and distal colon [J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(2): G348-G360.
[13]Barthó L, Benkó R, Patacchini R, et al. Effects of capsaicin on visceral smooth muscle: a valuable tool for sensory neurotransmitter identification [J]. Eur J Pharmacol, 2004, 500(1-3): 143-157.
[14]李毅, 齐清会. 胃肠道神经-Cajal间质细胞-平滑肌网络研究进展[J]. 国际消化病杂志, 2007, 27(3): 225-227. Li Y, Qi QH. Study progress of the gastrointestinal nerve-ICC-smooth muscle network [J]. Int J Dig Dis, 2007, 27(3): 225-227.
[15]Zhong F, Christianson JA, Davis BM, et al. Dichotomizing axons in spinal and vagal afferents of the mouse stomach [J]. Dig Dis Sci, 2008, 53(1): 194-203.
[16]Holzer P, Painsipp E, Schuligoi R. Differential effects of intragastric acid and capsaicin on gastric emptying and afferent input to the rat spinal cord and brainstem [J]. BMC Neurosci, 2005, 6: 60.
[17]Bardhan KD, Bodemar G, Geldof H, et al. A double-blind, randomized, placebo-controlled dose-ranging study to evaluate the efficacy of alosetron in the treatment of irritable bowel syndrome [J]. Aliment Pharmacol Ther, 2000, 14(1): 23-34.
[18]周吕, 袁勃, 田瑞, 等. Cajal间质细胞介导胃动素兴奋胃起搏区运动的作用[J]. 基础医学与临床, 2001, 21(z1): 84-85. Zhou L, Yuan B, Tian R, et al. The motilin excited gastric pacing motion function area mediated by interstitial cells of Cajal [J]. Basic Medical Sciences and Clinics, 2001, 21(z1): 84-85.
[19]周吕, 王礼建, 袁勃, 等. 胃动素对Cajal间质细胞引起的大鼠胃平滑肌收缩的作用[J]. 中华医学杂志, 2003, 83(16): 1422-1427. Zhou L, Wang LJ, Yuan B, et al. Effect of motlin on gastric smooth contraction induced by interstitial cells of Cajal [J]. Natl Med J China, 2003, 83(16): 1422-1427.
[20]Maake C, Kloas W, Szendefi M, et al. Neurohormonal peptides, serotonin, and nitric oxide synthase in the enteric nervous system and endocrine cells of the gastrointestinal tract of neotenic and thyroid hormone-treated axolotls (Ambystoma mexicanum) [J]. Cell Tissue Res, 1999, 297(1): 91-101.
[21]Lördal M, Theodorsson E, Hellström PM. Tachykinins influence interdigestive rhythm and contractile strength of human small intestine [J]. Dig Dis Sci, 1997, 42(9): 1940-1949.
[22]Wheatley JM, Hutson JM, Chow CW, et al. Slow-transit constipation in childhood [J]. J Pediatr Surg, 1999, 34(5): 829-832; discussion 832-833.
[23]Schmidt PT, Holst JJ. Tachykinins in regulation of gastric motility and secretion [J]. Cell Mol Life Sci, 2000, 57(4): 579-588.
[24]Mulè F, D’Angelo S, Tabacchi G, et al. Involvement of tachykinin NK2 receptors in the modulation of spontaneous motility in rat proximal colon [J]. Neurogastroenterol Motil, 2000, 12(5): 459-466.
[25]Haycock JW, Bro S. Corpus striatum (Translation of S.Ramón y Cajal). translated from Corps Strié, chapter 23, in “Histologie du systéme nerveux de l'homme et des vertébrés” 1911 [J]. Behav Biol, 1975, 14(3): 387-402.
[26]Huizinga JD, Chen JH, Mikkelsen HB, et al. Interstitial cells of Cajal, from structure to function [J]. Front Neurosci, 2013, 7: 43.
[27]Vannucchi MG. Receptors in interstitial cells of Cajal: identification and possible physiological roles [J]. Microsc Res Tech, 1999, 47(5): 325-335.
[28]Huizinga JD, Thuneberg L, Klüppel M, et al. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity [J]. Nature, 1995, 373(6512): 347-349.
(责任编辑:马 军)
Effect and mechanism of capsaicin on gastric motility in water immersion restraint stress rats
LI Zepei1, QIU Ye2, PENG Yan3
1.Department of Gastroenterology; 2.Department of Oncology, the Second People’s Hospital of Yibin City, Yibin 644000; 3. Department of Gastroenterology, the Affiliated Hospital of Southwest Medical University, China
Objective To investigate the effect and mechanism of capsaicin (CAP) on gastric motility in water immersion restraint stress (WIRS) rats.Methods Thirty male SD rats were randomly divided into 3 groups: normal control group, WIRS model group and CAP group. Rats in normal control group were freely accessed to food and water. Rats in WIRS model group were freely accessed to food and water after the stress. Rats in CAP group were fed the CAP after the stress. After 4 weeks, all the rats were lavaged with phenol red solution, then the rats were killed. The gastric emptying rate of phenol red was tested, the plasma MTL level was detected by ELISA method, the expressions of TRPV1, SP were detected by immunohistochemical method, and the transcriptional levels of c-kit mRNA, and SCF mRNA were detected by RT-PCR method.Results The gastric emptying rate of phenol red: the gastric emptying rate in WIRS model group was significantly lower than that in other two groups (P<0.05); the gastric emptying rate between normal control group and CAP group had no significant difference (P>0.05). The plasma MTL results: the level of plasma MTL in WIRS model group was significantly lower than that in other two group (P<0.05); the level of plasma MTL in normal control group was significantly lower than that in the CAP group (P<0.05). Immunohistochemistry detection results: the expression of TRPV1 in the CAP group was significantly higher than that in other two groups (P<0.05); but there was no significant difference between normal control group and WIRS model group (P>0.05). The expression of SP in WIRS model group was significantly lower than that in other two groups (P<0.05); the expression of SP in normal control group was significantly lower than that in the CAP group (P<0.05). Results of RT-PCR method: the expression of c-kit mRNA in WIRS model group was significantly lower than that in normal control group (P<0.05); but there were no significant differences between normal control group and CAP group or WIRS model group and CAP group (P>0.05). The expression of SCF mRNA in WIRS model group was significantly lower than that in other two groups (P<0.05); the expression of SCF mRNA in normal control group was significantly lower than that in the CAP group (P<0.05).Conclusion CAP may improve the gastric emptying rate of WIRS rats, the mechanism of CAP on gastric motility may be related with regulating the expressions of TRPV1 and SP, the release of MTL, but has no obvious relationship with interstitial cells of Cajal.
Capsaicin; Water immersion restraint stress; Gastric motility; c-kit; SCF; TRPV1; SP
李泽培,硕士,住院医师,研究方向:胃肠动力。E-mail:752169489@qq.com
彭燕,教授,主任医师,研究方向:胃肠黏膜屏障与酒精相关性疾病。E-mail:1806857826@qq.com
10.3969/j.issn.1006-5709.2016.07.012
论著·胃相关疾病
R573
A
1006-5709(2016)07-0759-06
2015-10-26
