早期卵清蛋白诱导的兔类风湿性关节炎模型的建立与评估①
2016-06-15陈树强缪蔚冰陈君敏
郑 擎 陈树强 缪蔚冰 郑 玲 陈 静 陈君敏
(福建医科大学附属第一医院,福州350003)
早期卵清蛋白诱导的兔类风湿性关节炎模型的建立与评估①
郑擎陈树强缪蔚冰郑玲陈静陈君敏
(福建医科大学附属第一医院,福州350003)
[摘要]目的:探索鸡卵蛋白诱导性兔类风湿性关节炎模型在早期关节中的应用,并评估超声引导下AIA模型关节腔穿刺活检,在活体中连续动态地获取病理标本的可行性、安全性。方法:将25只新西兰大白兔卵蛋白诱导的类风湿性关节炎组(AIA组)20只,对照组5只。在造模后高频超声分别观察超声影像特点。以ELISA法检测VEGF和TNF-α水平。在4、8、12、15周,超声引导下活检,获取滑膜病理,制作病理切片,镜下观察病理改变。结果:(1)模型各时间观测点测量的AIA组滑膜厚度、VEGF、TNF-α均高于对照组基线水平,具有显著性差异(P<0.05)。(2)关节炎模型4周至8周期间,以病理学评分作为金标准,滑膜厚度、VEGF、TNF-α结果与病理学评分具有相关性。(3)超声引导下滑膜活检成功率为95%,术后无感染、出血、关节骨质损伤的情况。结论:(1)卵清蛋白诱导的兔类风湿关节炎模型可作为观察早期(8周前)关节炎病理生理改变的研究模型。(2)超声引导下的滑膜活检,可有效安全地获取病理标本。
[关键词]类风湿关节炎;动物模型; 超声; VEGF;TNF-α
类风湿性关节炎(Rheumatoid arthritis,RA)是一种中小关节炎性损害为主要表现的慢性自身免疫性疾病,关节损害常以近端指间关节、腕关节为多见。病情迁延可导致关节毁损以及相关脏器的累及[1]。因此目前临床上多建议早期诊断与达标治疗[2]。RA早期相关的临床研究不断深入,但由于临床研究的局限性,如RA患者的就诊时间一般在症状出现之后、患者血清与影像学采集的依从性等因素,通常在诊疗过程中难以观察到关节炎发生发展的早期情况以及关节病变从无到有的过程。故建立可靠的极早期关节炎动物模型变得较为迫切。之前已有动物研究以卵清蛋白诱导并建立的兔类风湿性关节炎模型(AIA模型),但该模型常于建模后8周经行相关数据采集,而此时关节病变已相对晚期。尚未有相关研究探讨该模型关节炎的早期情况。故本研究建立兔AIA模型,并以高频超声、血清VEGF、TNF-α、病理活检等手段评估该模型的早期关节炎情况。同时该研究尝试以超声引导下滑膜活检的方式,连续的获取滑膜病理标本,并研究该方法对于动物模型的可靠性与安全性。
1资料与方法
1.1研究对象
1.1.1试验动物及试剂6月龄雄性新西兰大白兔25只,称量体重大约在2.5~3.0 kg,常规饲养。实验按照随机对照表分为模型组(20只)和对照组(5只)。
试验试剂主要有:鸡卵清蛋白(OVA,美国Sigma 公司),弗氏完全佐剂(美国Sigma 公司),兔TNF-α和VEGF ELISA试剂盒(USCNLIFE公司)。25%氨基甲酸乙酸、生理盐水、10%甲醛溶液、石蜡、苏木素-伊红染色剂、乙醇溶液、石碳酸二甲苯、二甲苯溶液、盐酸乙醇、石碳酸二甲苯(福建医科大学附属第一医院)、戊巴比妥钠(上海源叶生物科技有限公司)。
1.1.2仪器Philips-iU22彩色多普勒超声诊断仪、酶标仪 (Thermo,MuLTiSKAN MK3)、多管架自动平衡离心机( 福建省科学器材公司)、数显恒温水浴锅 (上海江星仪器有限公司 )、超低温冰箱 ( 青岛海尔特种电器有限公司)、18G活检针(美国BARD medical公司,规格18G)光学显微镜(Olympus,CX13)
1.2方法
1.2.1模型制作方法参考Atkinson[3]与Qiu[4]等人所使用的方法AIA建立关节炎模型。主要步骤包括:(1)基础致敏: 20 mg/ml的OVA生理盐水1 ml,兔肩胛间区的5个部位进行皮内注射,每周 1 次,连续 3周[5-7]。(2)局部注射:在胫骨结节最高点与髌骨下缘连线之中点的髌韧带两侧,双膝各注射 1 ml鸡卵清蛋白乳剂(10 mg/ml)。(3)对照组分别于相应部位注射生理盐水。
1.2.2多普勒超声检测各组分别于在末次膝关节注射后的24、72 h以及第1至8周,以Philips-iU22(探头频率7~12 MHz),对双侧膝关节分别检查病变情况,每周1次,并观察如下情况:测量髌上囊滑膜厚度、关节内滑膜彩色血流信号并分级[8,9]。
1.2.3TNF-α与VEGF的检测各组分别于末次膝关节注射后,经耳中央动脉采血2 ml,采血时间与超声检查时间同步,采用ELISA测定VEGF、TNF-α水平,具体操作步骤参照试剂盒说明要求。
1.2.4超声引导下病理活检在4、8、12、15周以1%戊巴比妥(6 mg/kg)腹腔麻醉后,固定动物手术台上,对双膝关节处备皮,取30~45屈膝位,常规消毒,活检针超声引导下由膑韧带附着点处上方约0.5 cm处进针;当超声影像提示活检针进入关节腔内病变滑膜处后,迅速采集滑膜病理标本,退出活检针,按压止血。
1.2.5病理制片与病理分级用甲醛固定90 min。常规脱水、浸蜡、包埋、HE染色。根据Krenn等[10]学者提出的滑膜病理评分标准,分别评分。总分值0~3分为1级,3~6分为2级,6~9分为3级,详见表1。

2结果
2.1对照组与AIA组动物模型的一般情况对照组动物生长平稳,饮食、饮水、关节情况正常。AIA组在末次膝关节注射后24 h后,皮肤温度增加,关节肿胀、活动受限。
2.2对照组与AIA组超声影像学改变在对照组中,超声提示兔双膝关节面光滑,滑膜无增厚,无明显血流信号。在模型组中,超声可观察到的滑膜增厚现象,出现在关节腔注射后的24 h;多普勒超声所提示的血流信号大约出现在模型建造后的第三天;上述滑膜增厚与血流信号改变所提示的滑膜炎随时间推移逐步加重,见图1~3。AIA组滑膜厚度与对照组相应指标相比,具有显著差异(一般线性模型,Greenhouse-Geisser 0.362,P<0.05),见图4、5。
表1滑膜病理评分
Tab.1Synovial pathology of score

PathologypresentationScoreAHyperplasiaofsynoviallinincelllayerAbsent0Slightenlargemnet(twotothreecelllayers),giantcellsareveryrare1Moderateenlargement(fourtofivecelllayers),somegiantcellsorlymphocytes2Strongenlargement(morethansixcelllayers),giantcellsarefrequent3BInflammatoryinfiltrationAbsent0Slightinflammatoryinfiltration1Moderateinflammatoryinfiltration2Stronginflammatoryinfiltration3CActivationofsynovialstromaAbsent0Slightsynovialstromaactivation1Moderatesynovialstromaactivation2Severesynovialstromaactivation3Totalscore9Totalscore0-3forGrade1,score3-6forGrade2,score6-9forGrade3
2.3模型组与对照组血清学改变在对照组中,血清VEGF与TNF-α水平在试验全程中与起始基线值相比无明显差异。在AIA组中动物血清中VEGF与TNF-α水平在4周前平缓升高,上升趋势在4至8周之间逐步显著;AIA组与对照组相比,VEGF与TNF-α水平显著高于对照组(P<0.05),见图5。
2.4病理学结果在进行超声引导下穿刺后,将滑膜病理制片后,镜下观察滑膜增生、周围组织炎性细胞浸润等情况[11],根据Krenn等[10]学者提出的滑膜病理评分标准,分别评分。在4周时,镜下以增生肿大的滑膜被覆细胞为主,以1级病变居多(图6);8周时,镜下可见被覆细胞,伴炎性细胞轻中度浸润,以2级为主;12周至15周的病理分级均达3级滑膜,镜下可见大量炎性细胞浸润并伴有血管翳增生(图7)。结果详见表2。
2.5超声引导下滑膜活检结果第4、8、12、15周,对AIA组20只模型动物,分别进行了超声引导下的滑膜活检,在总共160次的滑膜活检中,成功率95%(152/160),失败原因为麻醉深度不足。术后经大体观察与超声检查,无一出现关节腔内感染、出血、关节骨质损伤的情况,详见表3。

图1 造模第4周,滑膜增生Fig.1 Week 4, hyperplasia of membranesNote: The grade 2 synovial membrane in Philips-iU22,7-12 Hz liner probe in week 4:synovial membrane covered the top of bone surface,but did not exceed the trunk.

图2 造模第8周,滑膜增生Fig.2 Week 8, hyperplasia of membranes.Note: The grade 3 synovial membrane in Philips-iU22,7-12 Hz liner probe in week 8:synovial membrane covered the top of bone surface and exceed the trunk.
2.624 h至8周时,AIA组滑膜厚度与VEGF、TNF-α的相关性AIA组中,超声滑膜厚度与VEGF、TNF-α具有显著相关性(Pearson检验,R= 0.869,P<0.05)见图8、9。
2.7病理与滑膜厚度、血清VEGF、TNF-α的相关性在关节炎模型第4周、第8周,滑膜厚度、血清学、病理学检测的相关性检验提示:血清VEGF与TNF-α水平,滑膜厚度与病理评分具有相关性,P<0.05,见表4。

图3 造模第4周,增生的滑膜内见条状丰富的彩色血流信号Fig.3 Week 4, hyperplasia of membranes with blood flowNote: The grade 3 blood flow in Philips-iU22, 7-12 Hz liner probe in week 4:liner blood flow in synovial membrane, exceeded the half area and covered by colour signal.
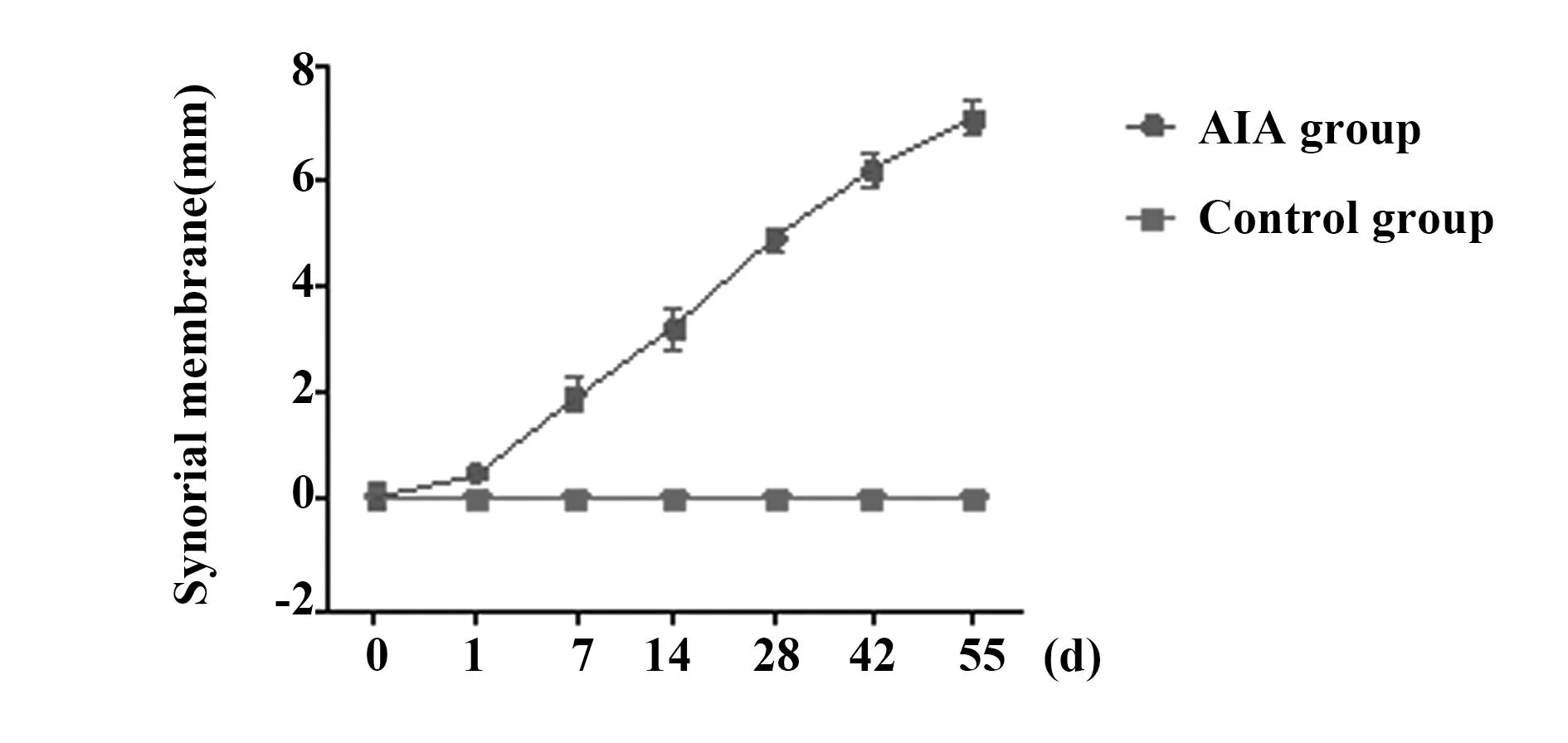
图4 AIA组与空白组滑膜厚度的对比Fig.4 AIA group compared with control group,synovial membranesNote: Synovial membrane AIA vs. Control with significant difference (GLM, Grenhous-Geisser 0.362, P<0.05).
表2模型组在各个时间点的病理分级
Tab.2Pathology grading in each biopsy

DaysGradeofpathology(n)Grade1Grade2Grade32818205601468400201050020

图5 AIA组、空白组TNF-α、VEGF水平与空白组相应指标相比较Fig.5 AIA group compared with control group for TNF-α, VEGFNote: There is significance difference for TNF-α, VEGF between AIA group and control group. VEGF (GLM,Greenhouse-Geisser 0.286,P<0.05),TNF-α(Greenhouse-Geisser 0.289,P<0.05).

图6 第4周,滑膜病理改变Fig.6 Week 4,pathology changing for synovial membranesNote: Lining cells hyperplasia, slight inflammatory infiltration(40×10).

图7 第12周,滑膜病理改变Fig.7 Week 12,pathology changing for synovial membranesNote: Severe inflammatory infiltration with pannus formation (40×10).
表3超声引导下滑膜活检情况分析
Tab.3Analysis of ultrasound guided biopsy

WeeksSuccessFailurePostprocedurehaemorrhage,infectionandjointdamageWeek44000Week83640Week123730Week153910Total15280

图8 滑膜厚度与VEGF相关性检验Fig.8 Significant correlation between synovial membrane and VEGFNote: Pearson,R=0.869,P<0.05.

图9 滑膜厚度与TNF-α水平的相关性检验Fig.9 Significant correlation between membrane and TNF-αNote: Pearson,R=0.814,P<0.05.
表4病理评分与滑膜厚度、VEGF、TNF-α的Spearman相关性检验
Tab.4Spearman test of pathology score, membrane thickness, VEGF and TNF-α

PathologyscoreRPVEGF0.783<0.05TNF-α0.773<0.05Membranesthickness0.871<0.05
3讨论
类风湿关节炎早期的临床研究,由于患者就诊时间常在关节炎症状出现之后,故难以在人类关节上观察到关节炎发生发展的早期情况以及关节损伤从无到有的全过程。故有必要建立可靠的极早期关节炎动物模型。
选择适当的动物模型是类风湿关节炎研究的基础。因 Ⅱ 型胶原可诱导体内产生关节炎性质的自身免疫反应,故以 Ⅱ 型胶原免疫相应动物,可成功建立了胶原性关节炎的模型。Qiu等[3]的研究提示,当8 mg的OVA注入兔子关节时,造模成功率达100%。同时该模型较为廉价,适合较大规模的饲养与造模。它的血清学、病理学改变均接近人类类风湿性关节炎。基于以上考虑,同时为了满足类风湿关节炎超声影像学研究对于关节空间分辨度的要求,我们选择用兔子AIA模型作为该研究的基础。
在以往的研究中,通常该模型在造模后8周,方开始进行影像学、血清学的研究,但此刻该模型的关节炎改变已逐步进入慢性化改变,不能反映该模型关节炎的早期病理生理改变。故该模型的早期病理、生理改变并没有被充分研究。我们在此次研究中专注于观察AIA模型建模后早期(前8周)关节炎的各种指标。
在建造模型后8周内,我们比较了对照组与AIA组中滑膜厚度、VEGF、TNF-α水平的改变,发现AIA组各的相应指标均明显高于对照组,而且滑膜厚度与血清学改变具有显著相关性。在该组模型的第4周与第8周的病理切片也提示明显的炎症改变。我们以病理读片作为金标准,进行了滑膜与血清学、病理学相关性分析。结果提示,病理评分与滑膜厚度、血清VEGF、TNF-α与病理标本的相关性显著。说明该AIA模型可以反映早期的关节炎的病理生理变化。
在以往同类动物研究中,为获取病理标本,往往采用处死模型动物,解剖关节的方法;该方法可获取完整的病理组织,但动物死亡导致,无法在早期连续监测模型动物的病变情况。在近期Kelly等[12]的研究提示,超声引导下的滑膜活检作为微创的介入操作,可有效、安全的获取滑膜病理组织,同时创伤较小、费用低廉、操作人员较为容易培训,很适合用于动物试验。因此该研究中我们采用超声引导下滑膜活检的方法,获取滑膜病理标本,验证了超声引导下活检的安全性、有效性。我们在总共160次的滑膜活检中,仅因为麻醉深度问题失败8次,在全部的活检后以目视与超声的随访中,无一出现感染、术后出血、关节骨质损伤的情况。故该结果提示,超声引导下的滑膜活检是AIA模型获取病理组织安全、有效的手段。
该实验初期曾尝试以CRP、ESR来反映关节炎性程度,但上述指标易受外界因素影响,如关节活检、麻醉、采血等,出现较大波动,故最终排除出此次实验。
4结论
总之,通过超声监测的滑膜厚度、VEGF、TNF-α,病理标本随访,卵清蛋白诱导的兔类风湿关节炎模型可作为早期(8周前)关节炎病理生理改变的稳定模型。超声引导下的滑膜活检可安全有效地获取病理标本,提高了病情随访的可靠性、持续性。
参考文献:
[1]Firestein GS,Budd RC,Gabriel SE,etal.Kelley′s Textbook of Rheumatology [M].9th Edition.Singapore:Elsevier Pte Ltd,2012:360-362.
[2]Descalzo MA,Carbonell J,Gonzalez-Alvaro I,etal.Effectiveness of a clinical practice intervention in early rheumatoid arthritis [J].Arthritis Care Res,2012,64(3):321-330.
[3]Atkinson EG,Dinning WJ,Kasp E,etal.Precipitation of experimental autoallergic uveoretinitis by cyclosporin A withdrawal:an experimental model of uveitis relapse [J].Clin Exp Immunol,1989,78(1):108-114.
[4]Qiu L,Jiang Y,Luo Y,etal.Antigen-induced arthritis in rabbits:a comparative study between high-resolution ultrasound and contrast-enhanced ultrasound and pathologic findings [J].Rheumatol Inter,2012,32(6):1569-1580.
[5]刘贺,陈伟,王轶楠,等.卵清蛋白诱导的兔类风湿关节炎模型的建立及评估[J].中国老年学杂志,2013,33(12):2799-2802.
[6]高宜军,董启榕.兔类风湿性关节炎模型的诱导机制及组织病理学的研究[J].苏州大学学报(医学版),2005,25(5):803-806.
[7]Hembry RM,Murphy G,Henderson B,etal.Rabbit models of arthritis:immunolocalization of matrix metalloproteinases and tissue inhibitor of metalloproteinase in synovium and cartilage [J].Ame J Pathol,1993,143(2):628-642.
[8]Dougados M,Devauchelle-Pensec V,Ferlet JF,etal.The ability of synovitis to predict structural damage in rheumatoid arthritis:a comparative study between clinical exa mination and ultrasound[J].Ann Rheumatic Dis,2013,72(5):665-671.
[9]游岚岚,郑元义,王志刚.类风湿关节炎的超声评分研究进展 [J].临床超声学杂志,2014,16(4):256-258.
[10]Krenn V,Morawietz L,Haupl T,etal.Grading of chronic synovitis--a histopathological grading system for molecular and diagnostic pathology[J].Pathol Res Pract,2002,198(5):317-325.
[11]鞠大宏,张春英,吴皓,等.鹿瓜多肽注射液对CⅡ诱导的免疫性关节炎大鼠关节滑膜组织MMP3和TIMP-1 mRNA表达的影响 [J].中国中医基础医学杂志,2005,11(1):27-28.
[12]Kelly S,Humby F,Filer A,etal.Ultrasound-guided synovial biopsy:a safe,well-tolerated and reliable technique for obtaining high-quality synovial tissue from both large and small joints in early arthritis patients [J].Ann Rheumatic Dis,2013,10(9):10-13.
[收稿2015-08-27修回2015-09-16]
(编辑张晓舟)
Early stage antigen-induced arthritis in rabbits:establishing and evaluation
ZHENGQing,CHENShu-Qiang,MIAOWei-Bing,ZHENGLing,CHENJing,CHENJun-Min.
FirstAffiliatedHospitalofFujianMedicalCollege,Fuzhou350003,China
[Abstract]Objective:To evaluate early stages of arthritis in AIA model in vivo,by using high frequent PDUS,serum VEGF,TNF-α and pathology evaluation.We also estimate the feasibility and safety of US guided biopsy on AIA model,instead of animal sacrifice.Methods: 25 New Zealand white rabbits were randomized into 2 groups,20 in experimental group and 5 in contrast group. High-resolution ultrasound was used to evaluate arthritis.Serum VEGF and TNF-α were determined by ELISA.Ultrasound guided biopsy was applied and the pathological sections were observed by microscope and accessed.Results: (1)The thickness of membranes,VEGF,TNF-α in animal model group were significantly higher than those of control group(P<0.05).(2)In the early stage(4 weeks to 8 weeks)of AIA model,the thickness of membranes, serum VEGF and TNF-α were with correlation with patholology score(P<0.05).(3)The success rate of US-guided biopsy was 95% and no infection,heamorrhage and bony destruction were observed after these procedures.Conclusion: (1)AIA model can be used as a stable model for the early stage of antigen induced arthritis.(2)US-guided biopsy is safety and effective method to obtain synovial membranes.
[Key words]Rheumatoid arthritis;Animal model;Ultrasound;VEGF;TNF-α
doi:10.3969/j.issn.1000-484X.2016.05.016
作者简介:郑擎(1981年-),男,硕士,主治医师,主要从事风湿免疫学研究。
中图分类号R593.22
文献标志码A
文章编号1000-484X(2016)05-0673-05
·免疫学技术与方法·
①本文为国家自然科学基金(No.81272628)、福建省自然科学基金(No.2015J01459)和福建医科大学第一临床学院青年骨干教师基金(No.JGG201307)资助项目。
通讯作者及指导教师:陈君敏(1963年-),男,博士,主任医师,主要从事风湿免疫学、血液病学研究。
