缝隙连接蛋白Cx43介导高糖诱导的气道上皮结构受损①
2016-06-15余红梅周向东
余红梅 杨 娟 周向东 肖 谦 吕 洋 夏 丽
(重庆医科大学附属第一医院老年病科,重庆400016)
缝隙连接蛋白Cx43介导高糖诱导的气道上皮结构受损①
余红梅杨娟②周向东③肖谦吕洋夏丽
(重庆医科大学附属第一医院老年病科,重庆400016)
[摘要]目的:探讨缝隙连接蛋白(Connexin43,Cx43)在高糖(High glucose,HG)诱导气道上皮结构受损的相关调节机制。方法:构建突变的Cx43磷酸化载体pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1-Cx43368-MU,转染正常人支气管上皮细胞16HBE,给予高糖刺激,Western blot 法、Real-time PCR 法测定Cx43的蛋白及mRNA 水平,Western blot法测定紧密连接蛋白(Zonula occludens-1, ZO-1)及黏附连接蛋白(E-cadherin)的表达,激光共聚焦检测ZO-1的表达及定位。结果:与对照组相比,HG刺激后Cx43 mRNA 表达及蛋白含量均降低,ZO-1及E-cadherin的表达亦明显降低,均低于对照组(P<0.05)。转染Cx43磷酸化突变载体pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1 -Cx43368-MU 的细胞经HG刺激后,Cx43表达明显增强,显著高于单纯HG组(P<0.05),同时伴随ZO-1及E-cadherin的表达的增强(P<0.05)。结论:缝隙连接蛋白Cx43参与了HG诱导的气道上皮结构受损,是气道上皮机械防御屏障的重要调控分子。
[关键词]缝隙连接蛋白43;高糖;气道上皮;受损
肺部感染是糖尿病患者的常见并发症,且为常见致死病因。糖尿病患者易致结核菌感染以及各类病毒、细菌等所致的肺部炎症,而慢性阻塞性肺部疾病患者并发糖尿病时其急性加重的发生率与机体长期高血糖状态有着密切相关性[1,2]。气道上皮细胞层结构的完整性是气道防御屏障的关键,因上皮细胞是维持黏膜表面微环境稳定的核心,一旦上皮完整性破坏,气道黏膜表面有序的微环境也不复存在,气道机械防御屏障结构性和功能性破坏,从而导致气道炎症或感染的发生。Cx43是Cx家族最主要的成员,在气道上皮细胞、肺泡Ⅰ型及Ⅱ型细胞、肺内皮细胞及平滑肌细胞等均有大量表达[3]。高血糖可能引起Cx43的高磷酸化及表达量的变化,致晶状体上皮细胞、主动脉平滑肌细胞及微血管内皮细胞等细胞间有序组织及结构的完整性受损或消失及各靶器官功能障碍[4]。故此推测,Cx43是否与气道上皮结构完整性有关? 是否参与高糖致其受损的过程? 本研究以高糖(High glucose,HG)作为刺激因素,探讨Cx43在高糖致气道上皮结构受损中的作用,以期明确高糖致气道炎性反应的潜在机制。
1材料与方法
1.1材料人气道上皮16HBE 细胞株(上海复祥生物科技有限公司);pEGFP-N1 空载体(Clontech 公司);DEME/Ham′s F12 培养基、HEPES、Trizol 和小牛血清(Sigma 公司);兔抗ZO-1、兔抗Cx43、兔抗E-cadherin(美国Abcam公司);转染试剂FuGENE 6(瑞士Roche公司);HRP-羊抗兔抗体(Santa Cruz 公司);其余产品为国产试剂。
1.2方法
1.2.1重组质粒的双酶切鉴定构建人Cx43重组质粒pEGFP-N1-Cx43,以该重组质粒为模板,设计突变型PCR扩增引物,构建磷酸化位点突变基因表达载体,获得突变的Cx43载体pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1-Cx43368-MU(分别作用于Cx43的S279、S365及S368等丝氨酸位点,突变载体模拟被遏制磷酸化的Cx43)。提取纯化各组质粒,分别以限制性内切酶EcoRⅠ及BamHⅠ加入反应体系进行酶切。用T4 DNA连接酶将回收片段连接过夜,后转化入感受态细胞,转化过程设置阴性及阳性对照组,将转化平板置于37℃过夜孵育,挑选阳性克隆,加入液体培养基及卡那霉素摇菌。12 h后提取质粒酶切鉴定分析。
1.2.2转染常规培养16HBE细胞,待细胞汇合至90%左右进行转染,操作步骤按FuGENE 6说明书进行。转染设空白对照组、空质粒组及重组质粒组。转染后24~48 h在荧光显微镜下观察荧光,以此鉴定转染是否成功及转染效率。
1.2.3细胞分组于6孔板中培养16HBE细胞,常规培养换液,待细胞汇合至70%~80%时传代,将细胞分为6组,每组3个复孔:①对照组:在无胎牛血清无双抗的DEME/Ham′s F12 培养基中继续培养细胞;②HG刺激组:无血清培养液中加入终浓度为30 mmol/L的HG;③HG+pEGFP-N1-Cx43279-MU组:进行pEGFP-N1-Cx43279-MU转染,同时给予终浓度30 mmol/L的HG刺激;④HG+pEGFP-N1-Cx43365-MU组:进行pEGFP-N1-Cx43365-MU转染,同时给予终浓度30 mmol/L的HG刺激;⑤HG+ pEGFP-N1-Cx43368-MU组:进行pEGFP-N1-Cx43368-MU转染,同时给予终浓度30 mmol/L的HG刺激;⑥pEGFP-N1转染组:进行pEGFP-N1转染,但不给予刺激。继续培养后分别收集上清和细胞进行相关指标检测,每组实验重复4次。
1.2.4四甲基偶氮唑盐(MTT)法检测各组细胞的活力96 孔板中每孔按浓度1 ×104个/ml加入200 μl细胞悬液,每组各6 个复孔,37℃、5% CO2湿度培养箱孵育,分别取10、20、30 和60 min 时间点行MTT 测定。自动酶标读数仪以570 nm 波长测定各孔吸光度(A)值。
1.2.5实时荧光定量PCR(real-time)法检测Cx43 mRNA水平Trizol 法分别提取各组细胞内总RNA,经鉴定,样品A260/A280比值均介于1.8 ~2.0,初步定量后保存于-20℃备用。两步法行RT-PCR。cDNA 反转录反应按PrimeScript 反转录试剂盒说明进行。Cx43上游引物:5′-TTCAAGGGCGTTAAGGAT-3′,下游引物:5′-CCAGGAGGAGACAT-AGGC-3′。GAPDH 上游引物:5′-TCCCATCACCATCTTCCAG-3′,下游引物:5′-GAGTCCTTCCACGATACCAA-3′。反应参数:94℃ 预变性3 min,后紧随35 个循环,循环参数:94℃ 45 s,58℃ 30 s,70℃ 60 s,后72℃延伸5 min采用2-△△CT方法分析目的基因mRNA 相对表达量。CT 是荧光达到荧光阈值的循环数,△△Ct=(CT目的基因-CT 管家基因)实验组-(CT目的基因-CT管家基因)对照组。
1.2.6Western blot法检测细胞内各气道上皮结构蛋白的相对含量弃培养液后加入细胞裂解液,冰浴20 min,4℃ 12 000 r/ min离心15 min,测定蛋白浓度。取各组细胞蛋白10 g经含15%的SDS-PAGE电泳分离,转移至硝酸纤维素膜上,5%脱脂牛乳封闭1 h,加入兔抗ZO-1、兔抗Cx43、兔抗E-cadherin(1∶1 000)孵育2 h,再用HRP标记的羊抗兔IgG(1∶10 000)孵育2 h。洗膜后经ECL显色,暗室曝光2 min。结果以与内参照β-actin产物条带的密度面积积分比值作为Cx43、ZO-1及E-cadherin蛋白的相对含量。
1.2.7激光共聚焦扫描显微镜观察ZO-1蛋白的胞内表达吸弃培养液,4%多聚甲醛固定30 min,0.3%的Triton-100透化处理20 min,加入羊血清室温下封闭30 min,去血清,加兔抗ZO-1单克隆抗体1∶200,置湿盒内4℃过夜,再加二抗(FITC标记的羊抗兔IgG 1∶50),置湿盒内室温下2 h,50%的甘油封片,显微镜下观察,成像并行图像分析。

2结果
2.1各Cx43磷酸化位点突变基因表达载体的酶切鉴定及转染各重组质粒pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1-Cx43368-MU经EcoR Ⅰ和BamH Ⅰ双酶切鉴定构建成功(图1),符合预期目标。重组质粒转染16HBE细胞36 h后在荧光倒置显微镜下观察,质粒发出较强绿色荧光,证实转染成功(图2)。
2.2各组中细胞增殖的变化各处理因素对细胞的增殖活力无明显影响(表1)。

图1 Cx43磷酸化突变体酶切电泳图Fig.1 Restriction enzyme identification of recombin-ant constructsNote: 1.pEGFP-N1;2.pEGFP-N1-Cx43279-MU;3.pEGFP-N1-Cx43365-MU;4.pEGFP-N1-Cx43368-MU.
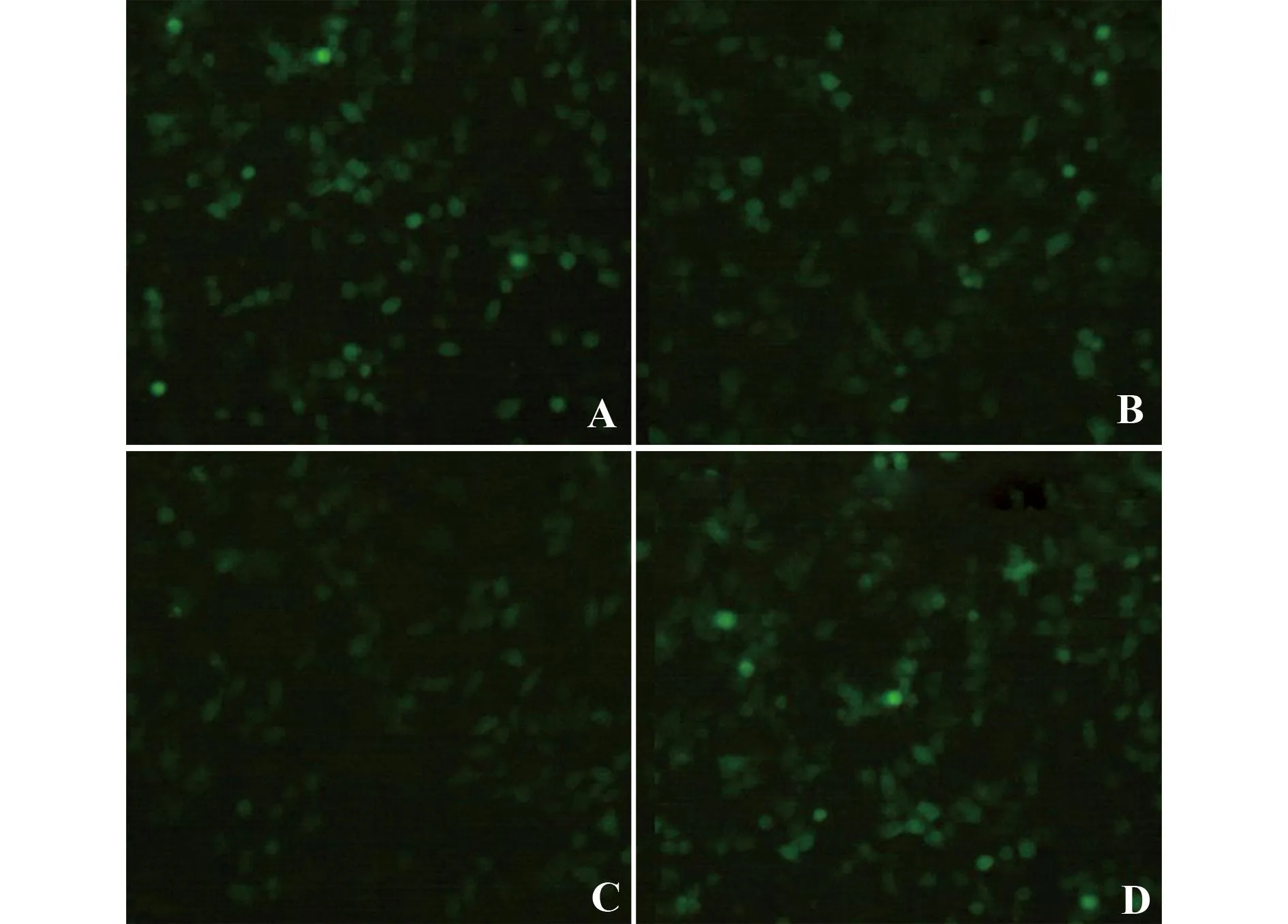
图2 Cx43磷酸化突变体转染图(×200)Fig.2 Transfection of recombinant constructs(× 200)Note: A.pEGFP-N1;B.pEGFP-N1-Cx43279-MU;C.pEGFP-N1-Cx43365-MU;D.pEGFP-N1-Cx43368-MU.
2.3不同磷酸化突变载体对高糖刺激的气道上皮Cx43表达水平的影响HG刺激可明显降低气道上皮Cx43的mRNA及蛋白的表达(P<0.05),而转染pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1-Cx43368-MU后再予以HG刺激,Cx43的mRNA及蛋白的表达水平较前明显增加(P<0.05,图3、5)。而转染空质粒pEGFP-N1对Cx43基因及蛋白水平无明显影响(P>0.05)。

图3 HG及转染Cx43突变载体对Cx43 mRNA表达水平的影响Fig.3 Effects of HG and recombinant constructs on Cx43 mRNA expressionNote: *.P<0.05,compared with control group;#.P<0.05,compared with HG group;1.pEGFP-N1-Cx43279-MU;2.pEGFP-N1-Cx43365-MU;3.pEGFP-N1-Cx43368-MU;4.pEGFP-N1.

图4 免疫荧光检测各组ZO-1蛋白的表达(× 800)Fig.4 Expression of ZO-1 protein detected by immunofluorescence(× 800)Note: A.Control;B.HG;C.HG+pEGFP-N1-Cx43279-MU;D.HG+pEGFP-N1-Cx43365-MU;E.pEGFP-N1-Cx43368-MU.

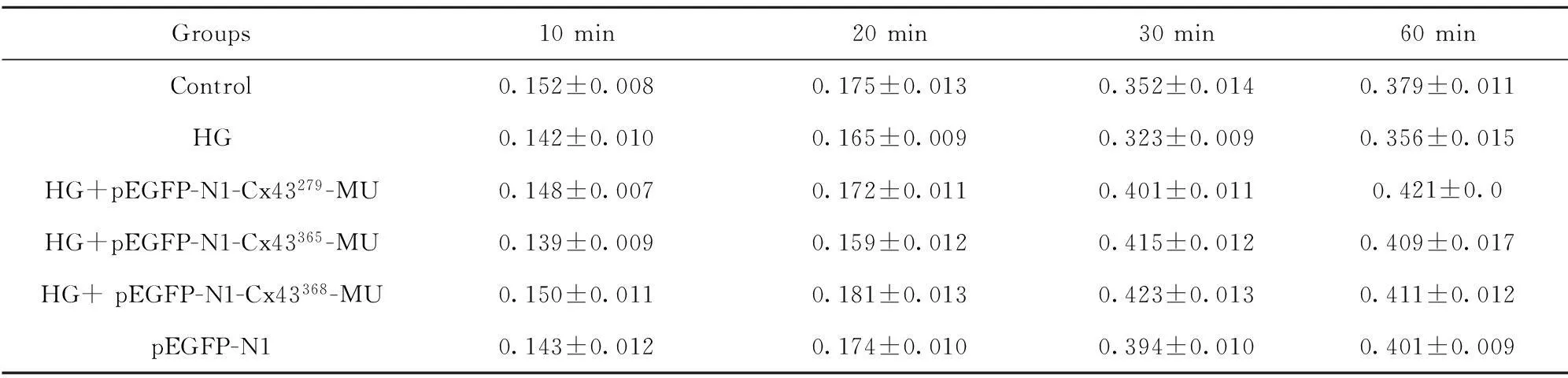
Groups10min20min30min60minControl0.152±0.0080.175±0.0130.352±0.0140.379±0.011HG0.142±0.0100.165±0.0090.323±0.0090.356±0.015HG+pEGFP-N1-Cx43279-MU0.148±0.0070.172±0.0110.401±0.0110.421±0.0HG+pEGFP-N1-Cx43365-MU0.139±0.0090.159±0.0120.415±0.0120.409±0.017HG+pEGFP-N1-Cx43368-MU0.150±0.0110.181±0.0130.423±0.0130.411±0.012pEGFP-N10.143±0.0120.174±0.0100.394±0.0100.401±0.009

图5 HG及转染Cx43突变载体对气道上皮各结构蛋白表达水平的影响Fig.5 Effects of HG and recombinant constructs on protein expressions of Cx43,ZO-1 and E-cadherinNote: *.P<0.05,compared with control group;#.P<0.05,compared with HG group;1.pEGFP-N1-Cx43279-MU;2.pEGFP-N1-Cx43365-MU;3.pEGFP-N1-Cx43368-MU;4.pEGFP-N1.
2.4不同磷酸化突变载体对高糖刺激ZO-1、E-cadherin蛋白表达的影响HG刺激后 ZO-1及E-cadherin的表达较对照组明显降低(P<0.05),而转染Cx43磷酸化突变体后pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1-Cx43368-MU可抑制高糖对上述蛋白表达的作用(P<0.05,图4、5)。
3讨论
气道上皮细胞之间的连接方式有三种:紧密连接、粘附连接和缝隙连接。紧密连接位于上皮细胞顶端,主要由Zonula occludens-1(ZO-1)等蛋白构成。粘附连接位于紧密连接基面,与肌动蛋白及粗肌丝共同支撑并调控细胞形态,包括E-cadherin及(α,β)-catenin 。缝隙连接(Gapjunction, GJ)是直接连接相邻细胞细胞质的细胞间通道,介导缝隙连接细胞间通讯(Gapjunction intercellular communication,GJIC),由连接蛋白(Connexins,Cxs)构成,连接蛋白根据其分子量命名,如Cx43[5]。在气道上皮细胞层结构完整的基础上,气道运行其有效的粘液纤毛清除功能,即能有效维护气道机械防御机能以抵御各种外界刺激特别是病原菌的侵入。正常气道分泌物中葡萄糖浓度约为血浆中浓度的1/10,而在高血糖状态下气道分泌物中的葡萄糖浓度急剧上升,气道分泌物的正常稳态被打破。因此,高血糖状态可致气道局部葡萄糖浓度的改变,引起气道一系列病理生理变化致正常气道防御屏障受损,由此易引起外界刺激物特别是病原菌的侵入。本研究结果显示,高糖刺激可降低气道上皮细胞各连接蛋白Cx43、ZO-1及E-cadherin的表达水平,使正常气道上皮结构受损,故而使气道易于受到病原菌入侵。那么高血糖如何破坏气道上皮结构?参与其中的靶点分子是什么?
Cx43是Cx家族最主要的成员,在气道上皮细胞、肺泡Ⅰ型及Ⅱ型细胞、肺内皮细胞及平滑肌细胞等均有大量表达。近些年在对高血糖致全身各系统靶器官损害的大量研究中发现,缝隙连接蛋白Cx43起着重要的介导作用[4,6]。从Cx43基因敲除小鼠的研究中发现,其晶状体上皮细胞间的特征性连接及有序排列消失,致细胞间有序组织及结构的完整性受损或消失。在对糖尿病视网膜病变及血管病变的研究中发现,高血糖可致Cx43的高磷酸化及降解,血管内皮细胞结构的紊乱致血-视网膜屏障的破坏,主动脉平滑肌细胞及微血管内皮细胞结构紊乱致血管损害,破坏心血管系统的稳态致功能障碍。Cx43的主要功能调节位点为位于其C端的S279、S365及S368等丝氨酸磷酸化位点[7]。本研究显示,高糖刺激可降低Cx43的表达水平,而转染突变的Cx43磷酸化载体pEGFP-N1-Cx43279-MU、pEGFP-N1-Cx43365-MU和pEGFP-N1-Cx43368-MU到正常人支气管上皮细胞16HBE后,再给予高糖刺激,细胞中Cx43的表达明显增加。表明在高糖致气道上皮结构受损过程中,Cx43的磷酸化可影响Cx43在细胞内的表达,具有关键的调节作用。
在对气道上皮缝隙连接蛋白的大量研究中发现,连接蛋白可与紧密连接、黏附连接及细胞骨架蛋白等结构发生作用以维护气道上皮结构的完整性。研究发现,连接蛋白Cx43可参与维护气道上皮结构的完整性[8]。Cx43的C端可与ZO-1的PDZ2位点结合定位于气道上皮细胞胞膜,Cx43的突变体及高磷酸化则使其与ZO-1结合减少,致缝隙连接通道正常结构的改变及气道上皮细胞膜ZO-1的减少[9]。免疫电镜分析显示连接蛋白Cxs、E-cadherin及catenin共沉淀于缝隙连接形成过程中细胞间的相互作用点上[10]。本研究结果显示,高糖刺激可降低ZO-1及E-cadherin的表达水平,而转染突变的Cx43磷酸化载体pEGFP-N1-Cx43279-MU、pEGFP-N1-
Cx43365-MU和pEGFP-N1-Cx43368-MU到正常人支气管上皮细胞16HBE后使ZO-1及E-cadherin表达明显增加。说明在高糖刺激气道上皮细胞以后,Cx43的磷酸化可引起紧密连接及粘附连接蛋白表达量的降低,致气道上皮结构受损。
本研究初步确认了缝隙连接蛋白Cx43在高血糖致气道上皮结构受损中的关键靶点作用,为临床治疗糖尿病患者肺部感染提供了新的思路。
参考文献:
[1]Seshasai SR,Kaptoge S,Thompson A,etal.Diabetes mellitus,fasting glucose,and risk of cause-specific death[J].N Engl J Med,2011,364(9):829-841.
[2]Baker EH,Wood DM,Brennan AL,etal.Hyperglycaemia and pulmonary infection[J].Proc Nutr Soc,2006,65(3):227-235.
[3]Chanson M,Crespin S.Connexins as therapeutic targets in lung disease[J].Expert Opin Ther Targets,2011,15(8):989-1002.
[4]Fernandes R,Giro H,Pereira P.High glucose down-regulates intercellular communication in retinal endothelial cells by enhancing degradation of connexin 43 by a proteasome-dependent mechanism[J].J Biol Chem,2004,279(26):27219-27224.
[5]Prochnow N,Dermietzel R.Connexons and cell adhesion:a romantic phase[J].Histochem Cell Biol,2008,130(1):71-77.
[6]Tien T,Barrette KF,Chronopoulos A,etal.High glucose alters Cx43 expression and gapjunction intercellular communication in retinal Müller cells:promotes Müller cell and pericyte apoptosis[J].Invest Ophthalmol Vis Sci,2014,55(7):4327-4337.
[7]Solan JL,Lampe PD.Connexin43 phosphorylation:structural changes and biological effects[J].Biochem J,2009,419(2):261-272.
[8]Johnson LN,Koval M.Cross-talk between pulmonary injury,oxidant stress,and gapjunctional communication[J].Antioxid Redox Signal,2009,11(2):355-367.
[9]Tien T,Barrette KF,Chronopoulos A,etal.Effects of high glucose-induced Cx43 downregulation on occludin and ZO-1 expression and tight junction barrier function in retinal endothelial cells[J].Invest Ophthalmol Vis Sci,2013,54(10):6518-6525.
[10]Avondet C,Falk MM,Segretain D,etal.Molecular reorganization of Cx43,Zo-1 and Src complexes during the endocytosis of gapjunction plaques in response to a non-genomic carcinogen[J].J Cell Sci,2008,121(Pt 24):4069-4078.
[收稿2016-02-19修回2016-04-07]
(编辑许四平)
High glucose impaired airway epithelium regulated by connexin43
YUHong-Mei,YANGJuan,ZHOUXiang-Dong,XIAOQian,LÜYang,XIALi.
DepartmentofGeriatrics,FirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China
[Abstract]Objective:To explore the mechanism of connexin43(Cx43)in regulating impaired airway epithelium induced by high glucose.Methods: pEGFP-N1-Cx43279-MU,pEGFP-N1-Cx43365-MU and pEGFP-N1-Cx43368-MU were constructed and transfected into 16HBE cells.Cells were stimulated by high glucose(HG).The levels of Cx43 protein and mRNA were detected by Western blot and real-time PCR respectively.The protein levels of ZO-1 and E-cadherin were detected by Western blot and immunofluorescence.Results: Compared with the control group,there was an obvious decrease of Cx43,ZO-1 and E-cadherin in cells exposed to HG.Compared with the single HG group,the levels of Cx43,ZO-1 and E-cadherin were increased in the cells transfected with pEGFP-N1-Cx43279-MU,pEGFP-N1-Cx43365-MU and pEGFP-N1-Cx43368-MU.Conclusion: Cx43 regultes airway epithelum impared by HG,and it is a critical factor regulating airway epithelial integrity.
[Key words]Connexin43;High glucose;Airway epithelium;Impaired
doi:10.3969/j.issn.1000-484X.2016.05.003
作者简介:余红梅(1982年-),女,博士,主治医师,讲师,主要从事气道炎症性疾病的防控研究,E-mail:yhm920@126.com。
中图分类号R563
文献标志码A
文章编号1000-484X(2016)05-0620-05
①本文为国家自然科学基金资助项目(81200005)、重庆市科技惠民计划项目(cstc2015jcsf10001-01-04)、国家临床重点专科老年病学建设项目(国卫办医函〔2013〕544号)。
②重庆医科大学附属第二医院呼吸内科,重庆400010。
③海南医学院附属医院呼吸内科,海口570102。
