实验性自身免疫性脑脊髓炎大鼠脑组织PGE2表达的研究
2016-06-13黄蕾李作孝彭仕军罗章坤
黄蕾 李作孝 彭仕军 罗章坤
实验性自身免疫性脑脊髓炎大鼠脑组织PGE2表达的研究
黄蕾 李作孝 彭仕军 罗章坤
目的 检测实验性自身免疫性脑脊髓炎(EAE)大鼠脑组织PGE2表达情况,探讨其在EAE发病过程中的作用。方法 将30只Wistar雌性大鼠随机分为正常对照组、佐剂对照组及EAE模型组,各10只,使用新鲜豚鼠脊髓匀浆(GPSCH)与含卡介苗(BCG)的弗氏完全佐剂(CFA)建立EAE模型。对各组大鼠发病潜伏期、进展期及发病高峰期神经功能障碍评分进行记录,采用免疫组织化学方法检测大鼠脑组织前列腺素E2(PGE2)的表达,并用ImagePro Plus软件对PGE2含量进行平均光密度值测定。结果 正常对照组及佐剂对照组大鼠未发病,EAE模型组大鼠均发病。正常对照组及佐剂对照组大鼠脑组织中未见PGE2表达,EAE模型组大鼠脑组织中则可见PGE2表达,且PGE2含量与EAE大鼠发病潜伏期呈负相关,与发病进展期及发病高峰期神经功能障碍评分呈正相关。结论 PGE2可能参与了EAE疾病的发生发展过程。
实验性自身免疫性脑脊髓炎;前列腺素E2;多发性硬化;Th 1细胞;Th 17细胞
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)因其临床表现与病理特征和MS高度相似故成为研究MS的理想动物模型。MS及EAE的具体发病机制迄今不明。本实验通过测定EAE大鼠脑组织PGE2表达含量,分析其与EAE大鼠临床症状之间的相关性,目的在于探讨PGE2在EAE发病中的作用。
1 资料与方法
1.1 实验动物 Wistar雌性大鼠30只,6周龄体质量210~230 g;健康成年豚鼠3只,体质量350~400 g。所有动物均购自四川大学华西实验动物中心,为一级合格动物。
1.2 实验主要试剂 弗氏完全佐剂(美国Chondrex公司);卡介苗冻干粉:60 mg/支(上海生物制品研究所);Rabbit Anti-PGE2(美国Bioworld公司)。
1.3 免疫抗原制作 将脊髓从麻醉后已行心脏灌流的豚鼠体中取出,加入无菌生理盐水,于冰浴中制成50%全脊髓匀浆,将含6 mg/mL卡介苗的弗氏完全佐剂与全脊髓匀浆等体积混合并于冰浴中制成油包水型免疫抗原。
1.4 实验动物分组及模型制作 将30只Wistar雌性6周龄大鼠随机分为正常对照组、佐剂对照组及EAE模型组,每组10只。正常对照组大鼠常规饲养。佐剂对照组及EAE模型组则于大鼠双足侧足垫分别注入弗氏完全佐剂与免疫抗原(2 mL/ kg),其余处理同正常对照组。
1.5 临床症状的观察及数据的记录 自造模当日起每日上、下午定时由同一人员通过观察大鼠行为学变化并采用Correa评分标准[1]进行神经功能障碍评分,记录各组大鼠发病情况。其中大鼠神经功能障碍评分≥1分视为临床发病。
1.6 实验终止 于EAE大鼠发病高峰期(大鼠神经功能障碍评分连续3 d无增加或大鼠处于濒死状态、对外界刺激无反应或死亡)终止实验。已予抗原处理而未发病大鼠及正常对照组大鼠分别均于观察1个月后处死。
1.7 大鼠脑组织中PGE2含量测定 石蜡切片常规脱蜡并水化。经消除内源性过氧化物酶活性及加热修复抗原、滴加5%正常山羊血清封闭处理后,分别滴加一抗(以1︰500稀释)、生物素标记的二抗(山羊抗兔IgG)及辣根酶标记的链霉卵白素,采用二氨基联苯胺显色,苏木素复染,乙醇脱水,二甲苯透明,中性树脂封片。高倍光学显微镜(10×40)下观察大鼠脑组织PGE2阳性表达情况,胞浆呈棕黄色为阳性细胞。免疫组化图片中PGE2的平均光密度值,采用Image Pro Plus软件分析,对PGE2表达进行半定量测定。
1.8 统计学方法 SPSS 17.0统计软件包完成统计分析。计量资料用“x±s”表示,采用完全随机设计资料的方差分析,P<0.05为差异有统计学意义。Pearson直线相关用于变量间相互关系的分析。
2 结果
2.1 临床表现 正常对照组及佐剂对照组大鼠均未发病。EAE模型组大鼠均急性发病,发病潜伏期为(8.55±0.84)d,发病进展期为(10.02±0.59)d,发病高峰期神经功能障碍评分为(3.84±0.41)分。发病大鼠开始时多表现为活动及进食量减少、反应迟钝,此后又渐出现抬尾无力、肢体瘫痪,严重者表现为尾巴及四肢瘫痪拖地,后肢双足跖面向上,抬头无力甚至呈濒死状态并最终死亡大鼠1只。
2.2 各实验组大鼠脑组织PGE 2的表达 光镜下观察,PGE 2在EAE模型组大鼠脑组织中均可见不同程度表达,表达细胞以星形胶质细胞为主,胞质内可见棕黄色颗粒(见图1)。佐剂对照组及正常对照组则未见PGE 2阳性细胞(见图2)。
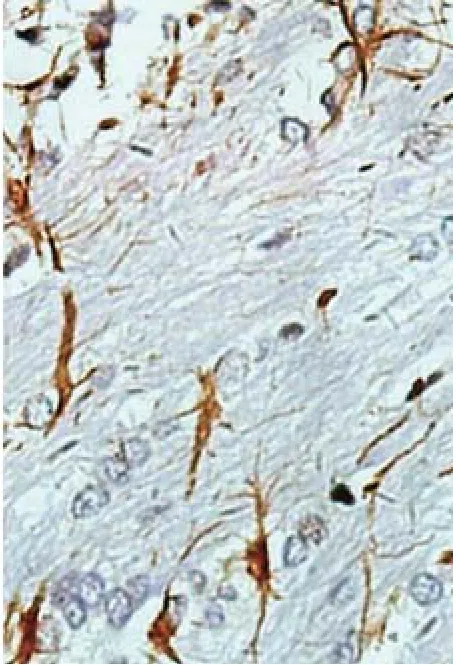
图1 EAE 对照组大鼠脑组织内PGE 2表达呈强阳性(HE×400)

图2 正常对照组大鼠脑组织内未见PGE 2表达(HE×400)
正常对照组及佐剂对照组大鼠脑组织中PGE2平均光密度值均为0,EAE模型组大鼠脑组织中PGE2平均光密度值为(0.55±0.06)。
2.3 EAE模型组大鼠脑组织中PGE2含量与临床表现的相关性分析 EAE模型组大鼠脑组织中PGE2含量与发病潜伏期呈负相关(r=-0.960,P<0.01),与发病进展期及发病高峰期神经功能障碍评分呈正相关(分别为r=0.908,P<0.01;r=0.888,P<0.01)。
3 讨论
有研究表明,Th 1及Th 17细胞具有促进MS及EAE疾病进展的作用。Th 1细胞可通过分泌TNF-α上调血脑屏障(blood-brain barrier,BBB)中内皮细胞间黏附分子-1的表达,促进T淋巴细胞的活化[2],破坏BBB的稳定性,使CNS内T淋巴及巨噬细胞增多,介导病变发生[3]。Th 17细胞则在EAE病程中大量增殖并分泌INF-γ、TNF-α、IL-17[4]等细胞因子进一步促进炎症级联反应,加重病情。有研究表明,阻断IL-17所介导的信号通路可缓解EAE病情[5]。因此,在EAE疾病的发生发展中,T细胞,尤其是Th 1、Th 17细胞在病情的衍变过程中发挥着重大作用。
PGE2是花生四稀酸经花生四稀酸环氧酶及PGE2合酶催化作用的产物,调节机体的炎症反应及细胞的生长、分化、凋亡等众多生理病理过程。Pollak等[6]的研究表明,EAE动物发病除与脑组织中炎性细胞的浸润及炎性因子的表达相关,还与PGE2的生成增多相关。通过作用于抗原提呈细胞表面的EP2及EP4受体,PGE2不仅可使IL-23和IL-6分泌增加进而促进Th 17细胞的分化与表达,还可促使CD 4+T细胞向Th 1细胞分化[7]。与此同时,PGE2作为炎性反应促进因子还可导致IL-12、IL-6及TNF等生成增多[8],促进EAE病情的发展。PGE2的EP 4受体特异性拮抗剂则可抑制Th 1细胞及Th 17细胞增殖从而抑制EAE的病理过程[9]。在关于人工合成的类维生素A治疗EAE疾病的研究中,抑制PGE2的合成便是其作用机制之一[10]。因此,PGE2在EAE疾病的发生发展中所起的作用不容忽视。
本实验通过对大鼠脑组织中PGE2表达情况的检测,结果显示,正常对照组及佐剂对照组无表达,EAE模型组大鼠发病高峰期脑组织中PGE2表达明显增加,提示PGE2在EAE疾病的衍变过程中可能发挥了作用,与国外相关研究报道相符。相关性分析提示,PGE2含量与发病潜伏期呈负相关(P<0.01),与发病进展期及发病高峰期大鼠神经功能障碍评分呈正相关(P<0.01),再次提示PGE2与EAE疾病的发生发展可能相关。
[1] CorreaJO,Aarestrup BJ,Aarestrup FM.Effect of thalidomide and pentoxifylline on experimental autoimmune encephalomyelitis(EAE)[J].Exp Neurol,2010,226(1):15-23.
[2] Scott CS,Kean RB,Fahis MJ,et al.ICAM-l up regulation in the spinal cords of PlSJI.mice with experimental allergic encephalo- myelitis dependent upon TNF-alpha production triggered by the loss of blood brain barrier integrity[J].J Neumimmunol,2004,155(1-2):32-42.
[3] Millán J,Hewlett L,Glyn M,et al.Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola-andF-actin-richdomains[J].Nat Cell Biol,2006,8(2):113-123.
[4] Batten M,Li J,Yi S,et al.Interleukin 27 limits autoimmune encephalomyelitis by suppressing the development of interleukin 17-producing T cells[J].Nat Immunol,2006,7:929-936.
[5] Yan Y,Ding X,Li K,et al.CNS-specific therapy for ongoing EAE by silencing IL-17 pathway in astrocytes[J].Mol Ther,2012,20(7):1338-1348.
[6] Pollak Y,OvadiaH,Orion E,et a 1.The EAE-associated behavioral syndrome:I.Temporal correlation with inflammatory mediators[J].J Neuroim munol,2003,137(1-2):94-99.
[7] KiharaY,MatsushitaT,KitaY,et al.Targeted lipidomics reveals mPGES-1-PGE 2 as a therapeutic target for multiple sclerosis[J].Proc Natl Acad Sci USA,2009,106(51):21807-21812.
[8] Chizzolini C,Chicheportiche R,Alvarez M,et al.Prostaglandin E 2 synergistically with interleukin-23 favors human Th 17 expansion[J]. Blood,2008,112(9):3696-3703.
[9] Esaki Y,Li Y,SakataD,et al.Dual roles of PGE 2-EP 4 signaling in mouse experimental autoimmune encephalomyelitis[J].Proc Natl Acad Sci USA,2010,107(27):12233-12238.
[10] MiyagawaN,HommaT,KagechikaH,et al.Effect of synthetic retinoid,TAC-101,on experimental autoimmune disease[J].Pharmacology,2003,67(1):21-31.
Objective To detect the expression of prostaglandin E2(PGE2) in the brain tissue of experimental autoimmune encephalomyelitis (EAE) and investigate the effect of PGE2on EAE. Methods Thirty female Wistar rats were randomly divided into three groups according to the randomly digital table: normal control group,EAE control group and adjuvant group. The complexes of the guinea pig spinal cord homogenate (GPSCH) and the complete FrReud’s adjuvant (CFA) were used in the induction of the Wistar rat model of EAE. The latency,progression and scores of symptoms were recorded. The expressions of PGE2in the brain tissue were detected by the immunohistochemistry technique and the staining intensities of PGE2were semiquantitatively analysised with the ImagePro Plus. Results No rats in the normal control and adjuvant group were ill while rats in the EAE control group were just opposite. Compared with the normal control and adjuvant group,there were significantly obvious expressions of PGE2in EAE control. The expressions of PGE2were negatively correlated with the latencies of this disease while positively correlated with the progressions and the scores of symptoms in the peak time of this disease. Conclusion PGE2might play arole in the development of EAE.
Experimental autoimmune encephalomyelitis;Prostaglandin E2;Multiple sclerosis;Th 1;Th 17
10.3969/j.issn.1009-4393.2016.8.002
四川 644000 宜宾市第一人民医院神经内科 (黄蕾 彭仕军 罗章坤) 泸州医学院附属医院神经内科 (李作孝)
李作孝 E-mail:lzx 3235@sina.com
