南方鲇尾部神经分泌系统的形态、结构及繁殖前后的变化
2016-06-05谭娟蒲德永张耀光
谭娟,蒲德永,张耀光
(1.西南大学生命科学学院/淡水鱼类资源与生殖发育教育部重点实验室/水产科学重庆市市级重点实验室,重庆400715;2.怀化学院生物与食品工程学院,湖南怀化418008)
南方鲇尾部神经分泌系统的形态、结构及繁殖前后的变化
谭娟1,2,蒲德永1,张耀光1
(1.西南大学生命科学学院/淡水鱼类资源与生殖发育教育部重点实验室/水产科学重庆市市级重点实验室,重庆400715;2.怀化学院生物与食品工程学院,湖南怀化418008)
以重要经济大型鱼类南方鲇为实验材料,采用解剖学、组织学方法和透射电镜技术对其尾部神经分泌系统(caudal neurosecretory system,CNSS)的形态结构和繁殖前后的结构变化作了比较研究.结果显示:南方鲇CNSS主要由尾垂体、轴突和Dahlgren细胞3部分组成;尾垂体体积较大,属于单个连续型,有倒三角锥形和近似蝌蚪形两种形态;轴突主要是无髓神经纤维;Dahlgren细胞主要分布在尾部最后3段脊髓中,可分为Ⅰ型和Ⅱ型细胞,两种细胞大小形态存在显著差异,在繁殖前后形态结构也存在显著变化.繁殖前,Dahlgren细胞突起及末梢内充满电子密度高和低两种类型的分泌颗粒,细胞器丰富;繁殖后,细胞内分泌颗粒及核糖体急剧减少,线粒体空泡化,RER管腔膨大.
南方鲇;尾部神经分泌系统;形态;结构;繁殖
尾部神经分泌系统(Caudal Neurosecretory System,CNSS)是类似于脊椎动物下丘脑-神经垂体的一种结构,是鱼类所特有的一个神经分泌系统,位于脊髓末端,包括神经分泌细胞、轴突和神经分泌区(尾垂体)3部分[1,2].已有大量研究表明,CNSS可分泌一种称为尾紧张素(Urotensin)的多肽,通过血液循环在鱼类的生殖生理调控及渗透压调节、心血管调节等多方面发挥重要作用[3-6].此外,陈恒[7-9]等报道CNSS与鱼类繁殖也有密切关系,CNSS中Dahlgren细胞的大小及其分泌颗粒的多少以及蛋白质含量的变化均随季节更替而发生改变,且结构和内含物变化过程与鱼类卵巢发育过程有着明显的平行关系.朱洪文[10]等发现鲫鱼CNSS随着性腺的周期性变化其分泌物也有周期性的变化,从恢复、累积到充满和释放;Sharma[11]、徐根兴[12]、Chen[13]和Bentley[14]等在丽塔鲇(Rita rita)、团头鲂(Megalobrama amblycephala)、印度鲇(Silurus wynaadensis)和双斑绚鲇(Ompokbi maculatus)的尾垂体中亦发现类似状况;另外,梁子卿[15]、Berlind[16]等研究均发现鱼类CNSS的粗提液或尾紧张素通过协同诱导蟾蜍体外跌卵或致使输精导管收缩等对生殖系统起作用.尽管CNSS功能和作用机制研究已有大量相关报道,但仍存在很大争议,暂未形成统一定论.
南方鲇(Silurus meridionalis Chen)属鲇形目,鲇科,鲇属,是我国特有大型经济鱼类,个体大,生长快,肉鲜昧美,深受广大民众喜爱,具有很高的市场价值.张耀光[17]、王德寿[18]、谢碧文[19]等对该鱼的生物学特性、形态发育等各方面都作了大量研究,有关该鱼CNSS的形态结构等研究国内外尚未见报道.作者通过比较成鱼不同时期CNSS的形态、结构初步探讨CNSS与繁殖的相关性,为丰富鲇形目鱼类CNSS的形态结构、生殖生理等研究奠定基础,也为进一步开发鲇鱼养殖提供参考资料.
1 材料与方法
1.1 实验材料
南方鲇系采自嘉陵江合川-北碚江段的野生个体,以及铜梁等地网箱养殖个体,体长65~103 cm,共计50尾.繁殖前材料(性腺发育至Ⅴ期)为性成熟个体,经人工催产,轻压腹部能排卵或排精,繁殖后材料(性腺发育为Ⅵ期)于排出卵粒或精液24 h至7 d之间取材.
1.2 实验方法
1.2.1 CNSS形态学材料处理
本实验采用健康活泼南方鲇个体,测量常规生物学数据,脊椎骨鉴定年龄.从倒数10-12个脊椎骨处断尾,依次向后剥离一侧椎弓,暴露脊髓,Nikon C-BD230体式镜下观察外部形态,照相,测量.
1.2.2 组织学的显微结构观察
不同个体脊髓段分别用Bouin’s液固定,石蜡包埋,连续切片,5-7μm,分别做H.E染色、Mallory以及Heidenhain AZAN三色法染色.以上所有结果均在Nikon Eclipse 80i显微观察,Nikon ACT-2U系统下照相.
1.2.3 CNSS超微结构材料的处理
选取性腺分别处于Ⅲ期、Ⅴ期和Ⅵ期的个体,断尾,取出最后一段尾部脊髓及其相连的尾垂体,置于预冷的2.5%戊二醛固定,将材料块修整成1mm*1mm*1mm大小,4℃过夜.1%锇酸(4℃)后固定3-4 h,丙酮脱水,环氧丙烷透明,Epon812包埋,40-60 nm超薄切片,柠檬酸铅和醋酸铀双重染色,H-300型透射电镜观察,照相. Image-proPlus 5.1图象处理软件下随机挑选20个细胞及其内部细胞器进行测量、统计.
2 结果
2.1 南方鲇CNSS的解剖结构
南方鲇尾部脊髓逐渐变细,在最后一个脊椎骨所对应脊髓的腹面有明显膨大,即尾垂体,与脊髓过渡连续,共用外层脊膜,相应脊椎骨的椎体背面也具特有的凹陷结构,尾垂体背部往后延伸为终丝.南方鲇尾垂体的形态主要有3个特点:(1)属单个尾垂体,与脊髓过渡无明显分界,但可分为两种形态(图版Ⅰ:1,2),一种近似倒三角锥形,侧面观前端圆胀,往后逐渐缩小;另一种近似蝌蚪形,分为连续的两部分,前部分突起明显,近圆形,体积较大,往后陡然下陷与脊髓平行,形成一段背腹扁平突起,尾部仿如锤头柄部,柄部中间纵轴方向可见明显浅沟.(2)不同生活环境来源的南方鲇的脊髓外包的脊膜上均有黑色素细胞分布,但养殖个体呈明显黑色,而野生个体表面呈淡灰色.推测可能与光照时间和光照强度有关,江河野生个体长期生活在深水底层,阳光照射到深水区时光线已经很弱导致其产生较少黑色素细胞,而人工养殖个体大多生活在浅塘,受光照影响较大故产生较多黑色素细胞.(3)比较同一年龄段尾垂体大小,发现野生个体的尾垂体比养殖个体的稍大,如同属4+龄,体长体重相近的两尾南方鲇,野生个体的尾垂体大小为3 053 μ m×1 282 μ m×1 446 μ m,而人工养殖的大小为3 049 μ m×1 162 μ m×1 333 μ m,动物的形态与功能是统一的,推测可能是由于江河个体周围环境较人工养殖环境变化大,用进废退,故尾垂体较大.
2.2 南方鲇CNSS的显微结构及繁殖前后变化
南方鲇CNSS主要由Dahlgren细胞、轴突和尾垂体3部分组成(图Ⅰ:3).
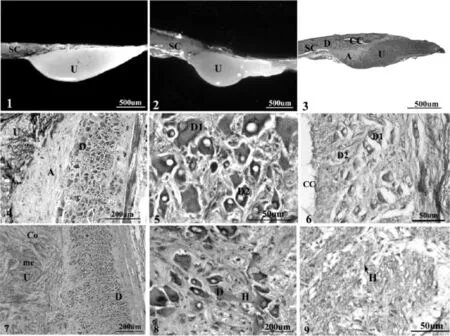
图版Ⅰ 南方鲇CNSS的形态和显微结构
2.2.1 尾部神经分泌细胞
南方鲇Dahlgren细胞集中于最后3个脊椎骨所对应脊髓的背面灰质内,紧邻中央管,特征明显,胞体较大,大多有3-4个突起,具有圆形、梭形、三角形等各种形状,还有方形和多边形(图Ⅰ:4).胞质染色不均匀,H. E染色为红紫色,可能成碱性.核较大,形状不规则,近圆形或椭圆,单核或多核.核内核仁明显,H.E染成蓝黑色,强嗜碱性.Dahlgren细胞根据胞体大小、形态、着色性及分布位置等可分为两类(图Ⅰ:5,6):一类细胞胞体较大,横切面形态不规则,多为多边形,一般具2胞核,偶尔可见3胞核,H.E染色胞质较淡,称为大型尾部神经分泌细胞即DahlgrenⅠ型细胞,其分布范围较广,遍及3段脊髓,但每一段脊髓内DahlgrenⅠ型细胞分布数量有所不同,从前往后先是靠近中央管,往尾部方向细胞数量逐渐增多且远离中央管,靠近尾部末端时DahlgrenⅠ型细胞数量又逐渐减少.经测量统计,3+龄个体春季时DahlgrenⅠ型细胞横切面平均面积为867.03±474.44 μ m2(n=20).另一类称为DahlgrenⅡ型细胞,胞体横切面积明显小于Ⅰ型细胞,通常呈梭形或圆形,一般是1个核,H.E染色胞质较Ⅰ型细胞深,分布区域相对狭窄,主要集中在中央管腹面的脊髓灰质内,从中央向四周成索状排列,春季时3+龄个体Ⅱ型细胞横切面面积平均为228.47±92.61 μ m2(n=20).
Dahlgren细胞轴突从脊髓腹面向后下方延伸入尾垂体,主要是无髓神经纤维,平行整齐排列,进入尾垂体前集合成束.
2.2.2 尾垂体
连续切片表明尾垂体主要由脊髓灰质内的Dahlgren细胞发出的轴突及毛细血管组成,但在尾垂体与脊髓之间,有不连续的结缔组织将其分隔,并在尾垂体内将其分成若干个大小不等的类似腔室的区间,由此将尾垂体分为“皮质”和“髓质”.皮质除结缔组织纤维外还有Dahlgren细胞轴突以及少量毛细血管组成,从外层包裹住尾垂体并向内逐渐分支,像网格一样穿插其中,分隔出大小不等的腔室就是髓质,染色较深,主要由轴突末梢和毛细血管组成,还有部分神经胶质细胞(图Ⅰ:7).
2.2.3 CNSS繁殖前后主要显微结构变化
南方鲇CNSS繁殖前后显微结构差异主要表现在以下3个方面:(1)细胞胞体的变化:Dahlgren细胞从繁殖前胞体较大变成较小,从充满内含物、染色较深变成胞质内空泡化,推测可能是繁殖时期胞体内含物排出,导致胞体体积减小(图Ⅰ:5,6).(2)繁殖前,在最后一段脊髓神经分泌细胞间可见染色均匀、充满分泌物泡状结构,即Herring小体,而繁殖后在胞体周围大多是空泡状(图Ⅰ:8,9).(3)不同类型的神经分泌细胞形态大小测量结果在繁殖前后显示出明显差异,详见表1.DahlgrenⅠ型细胞繁殖前后胞体面积分别为604.10±355.30 μ m2和262.57±115.23 μ m2(n=40),DahlgrenⅡ型细胞在繁殖前后胞体面积分别为136.77±42.21 μ m2和87.00± 34.69 μ m2(n=40),均有显著差异,其胞体周长和胞核的面积、周长等各项指标在繁殖前、后也均有极显著差异(P<0.001).
表1 繁殖前、后不同类型Dahlgren细胞胞体的形态大小比较(n=20,±SD)
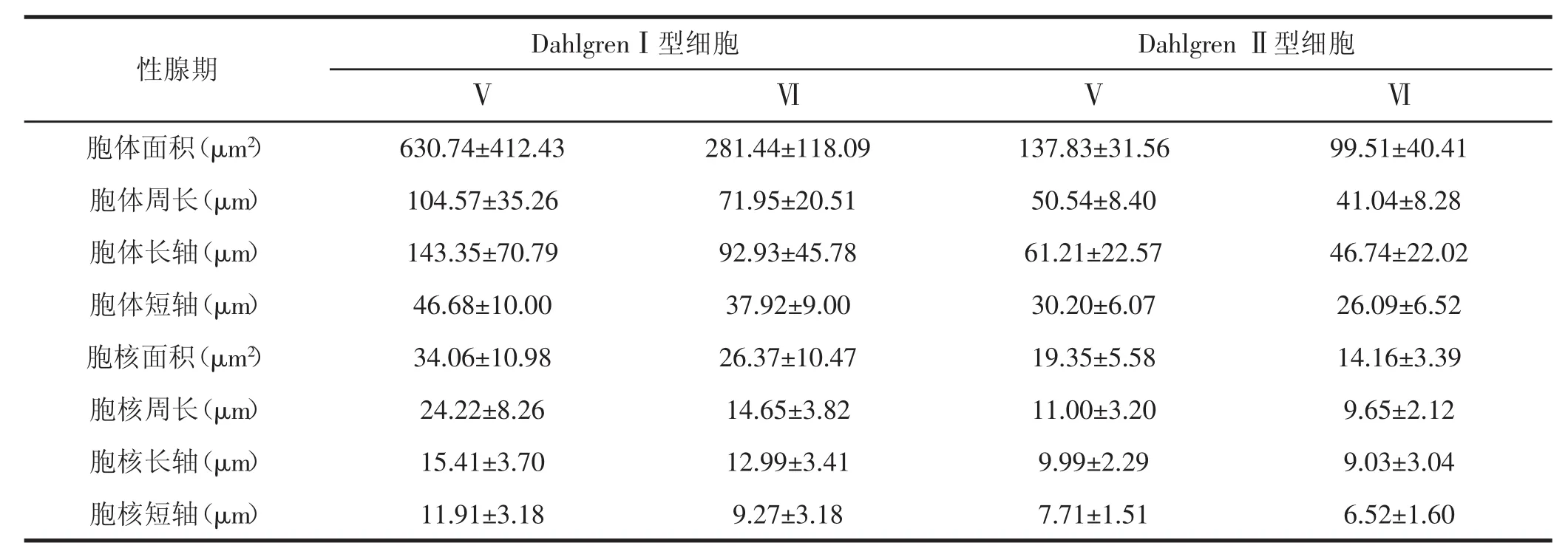
表1 繁殖前、后不同类型Dahlgren细胞胞体的形态大小比较(n=20,±SD)
性腺期D a h l g r e nⅠ型细胞ⅤD a h l g r e nⅡ型细胞ⅥⅥ胞体面积(μ m2)6 3 0 . 7 4 ± 4 1 2 . 4 3 9 9 . 5 1 ± 4 0 . 4 1胞体周长(μ m)1 0 4 . 5 7 ± 3 5 . 2 6 4 1 . 0 4 ± 8 . 2 8胞体长轴(μ m)1 4 3 . 3 5 ± 7 0 . 7 9 4 6 . 7 4 ± 2 2 . 0 2胞体短轴(μ m)4 6 . 6 8 ± 1 0 . 0 0 2 6 . 0 9 ± 6 . 5 2胞核面积(μ m2)3 4 . 0 6 ± 1 0 . 9 8 1 4 . 1 6 ± 3 . 3 9胞核周长(μ m)2 4 . 2 2 ± 8 . 2 6 9 . 6 5 ± 2 . 1 2胞核长轴(μ m)1 5 . 4 1 ± 3 . 7 0 9 . 0 3 ± 3 . 0 4胞核短轴(μ m)1 1 . 9 1 ± 3 . 1 8 6 . 5 2 ± 1 . 6 0 2 8 1 . 4 4 ± 1 1 8 . 0 9 7 1 . 9 5 ± 2 0 . 5 1 9 2 . 9 3 ± 4 5 . 7 8 3 7 . 9 2 ± 9 . 0 0 2 6 . 3 7 ± 1 0 . 4 7 1 4 . 6 5 ± 3 . 8 2 1 2 . 9 9 ± 3 . 4 1 9 . 2 7 ± 3 . 1 8Ⅴ1 3 7 . 8 3 ± 3 1 . 5 65 0 . 5 4 ± 8 . 4 06 1 . 2 1 ± 2 2 . 5 73 0 . 2 0 ± 6 . 0 71 9 . 3 5 ± 5 . 5 81 1 . 0 0 ± 3 . 2 09 . 9 9 ± 2 . 2 97 . 7 1 ± 1 . 5 1
2.3 CNSS的超微结构
2.3.1 Dahlgren细胞胞体的超微结构
超微结构显示Dahlgren细胞两种类型结构差异显著(图版Ⅱ:1,2),Ⅰ型Dahlgren细胞染色较Ⅱ型细胞深,胞质内各种细胞器包括RER、线粒体、核糖体、溶酶体等非常丰富,且Ⅰ型Dahlgren细胞胞体内RER排列整齐,而Ⅱ型细胞RER明显减少且排列杂乱;Ⅰ型Dahlgren细胞核糖体分布密集且大多以多聚核糖体的形式存在,而Ⅱ型细胞多聚核糖体明显减少;Ⅰ型Dahlgren细胞细胞核形状不规则,富含异染色质且分布不均匀;而Ⅱ型细胞细胞核表面相对平滑,染色质分布相对均匀.两种类型的Dahlgren细胞也有相同之处,两者均有不同密度的电子致密颗粒(图版Ⅱ:3).电子致密颗粒多近似圆形,无规律的散布在胞体和突起之中,染色的深浅表明电子密度的大小,因此,根据电子密度大小将分泌颗粒分为Ⅰ型和Ⅱ型颗粒,两者形态大小无显著性差异,直径约165.33±34.58 nm(n=148).
2.3.2 Dahlgren细胞轴突的超微结构
超微结构表明Dahlgren细胞轴突内主要包含神经原纤维、线粒体等结构,还有少量神经分泌颗粒及一些电子透明小泡(图版Ⅱ:4).其分泌颗粒与胞体内的电子密度相似.电镜下还可见部分有髓神经纤维,髓鞘厚度因其髓鞘板层数不同而不同,约0.06-4.37 μ m,平均0.32±0.74 μ m(n=34).有髓神经纤维轴突内包含物与无髓神经纤维类似(图版Ⅱ:5).南方鲇Dahlgren细胞轴突末端根据内含物的不同可分为3种类型,一种末端内含物主要由电子透明小泡组成,透明小泡直径为21.13-77.67 nm(n=42);另一种末端除包含部分类似电子透明小泡外,还有电子致密颗粒,颗粒大小为29.13-157.47 nm(n=40);第3种末端是只含有几个大空泡,大小为70.42-147.05 nm(n=30)(图版Ⅱ:6).
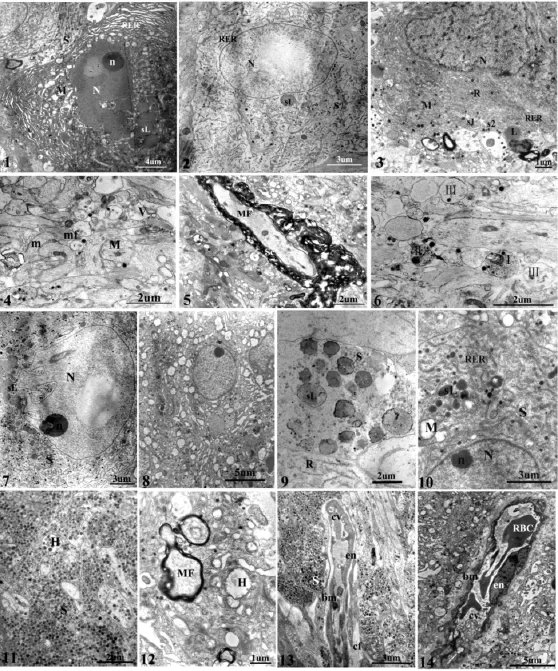
图版Ⅱ 南方鲇CNSS的超微结构
电镜下,Dahlgren细胞轴突末梢形成的比较常见的突触是“轴-体”突触,也可见“轴-树”突触和“轴-轴”突触.突触后膜与突触前膜之间形成对称性突触.
2.3.3 尾垂体的超微结构
尾垂体内富含突触和毛细血管.突触内含物与胞体轴突末端类似,主要是分泌颗粒和不同大小的透明小泡,轴突之间以及轴突与血管之间经常可见细胞间连接——桥粒.毛细血管管道壁很薄,内皮细胞核呈扁平状或方形,胞质较少.毛细血管管腔内偶尔可见一些电子密度偏低的类似溶酶体的小泡,小泡内可见透明颗粒样内含物.
2.3.4 CNSS繁殖前后超微结构变化
南方鲇CNSS繁殖前后超微结构异同主要表现在以下6个方面:(1)Dahlgren细胞胞质内细胞器在繁殖前非常丰富且排列紧密,而繁殖后出现大量空泡,线粒体内嵴减少,几乎呈空泡状,RER管腔膨大,核糖体数量也明显减少(图版Ⅱ:7,8).(2)胞质内溶酶体的变化:繁殖前后Dahlgren细胞胞体内初级溶酶体和次级溶酶体数量及体积均明显减少,尤其是初级溶酶体显著减少,但染色加深,繁殖前有时可见溶酶体内吞分泌颗粒的现象(图版Ⅱ:9,10).(3)细胞核的变化:一般情况下,细胞核表面平滑,但繁殖前,部分Dahlgren细胞胞核形成复杂内陷,深度可占胞核短径三分之一,内陷处可见RER、核糖体、分泌颗粒等胞器,在内陷最深处还可见大量染色很深的次级溶酶体聚集(图版Ⅱ:7,8).(4)分泌颗粒的变化:繁殖前后Dahlgren细胞突起及末梢内分泌颗粒急剧减少,繁殖后突起内主要包含神经原纤维和空泡状的线粒体及电子密度极低的球形小泡.(5)繁殖前,Herring小体体积较大且充满分泌颗粒;繁殖后,体积明显缩小并空泡化(图版Ⅱ:11,12).(6)毛细血管在繁殖前后结构变化也比较明显,开始管腔较大,平滑,而后呈萎缩状,可能主要是由于内皮细胞向管腔内形成较多皱褶(图版Ⅱ:13,14).
4 讨论
4.1 CNSS的形态结构
尾部神经分泌细胞在脊髓中的分布位置随着鱼种的不同而有明显差异.Fridberg[20]等报道北梭鱼(Albula vulpes)的Dahlgren细胞主要分布在最后6个脊椎骨对应的脊髓中,而真鳐(Raja batis)Dahlgren细胞几乎在55个脊椎骨范围内均有分布;Richard[21]、Carla[22]等分别观察到川鲽(Poecilia sphenops)、巴林口孵非鲫(Oreochromis niloticus)CNSS的Dahlgren细胞分布在最后8个和5个脊椎骨对应的脊髓部位.系统比较发现,软骨鱼类Dahlgren细胞分布比较分散[23],而硬骨鱼类Dahlgren细胞分布比较集中[2],但暂时还没有直接证据表明Dahlgren细胞的多少以及分布位置与功能或分类地位相关.与其它硬骨鱼相比,南方鲇的Dahlgren细胞分布区域更加集中,且胞体较大,可能与CNSS的功能水平有关.
尾垂体是CNSS的重要组成部分和功能发挥区域.根据尾垂体与脊髓间的形态差异可分为3类,分别是与脊髓过渡连续、在过渡带有明显收缩以及与脊髓完全分开[2].据已有报道,发现软骨鱼类脊髓末端无明显膨大,即神经血管区(此处不能称尾垂体)与脊髓无明显区分;部分原始硬骨鱼类如海鲢(Pachycormus)、白斑狗鱼(Esox lucius)、鳗鲡(Anguilla japonica)等尾部脊髓末端有膨大,但是与脊髓过渡连续,缺乏明显差异[20,24];部分硬骨鱼如北梭鱼既有明显的尾垂体膨大,与脊髓间有明显收缩,同时也有离散的神经血管集中区,介于分散与集中的过渡类型[20];但多数硬骨鱼类如鲫鱼、川鲽等都是具有明显的尾垂体结构[11,20].南方鲇与多数硬骨鱼一样,尾垂体形成明显膨大,与脊髓间有明显的收缩.已有推测,CNSS中尾垂体的形态特征表现出系统进化的一致性[23],但至今未形成定论.除此之外,目前已描述的尾垂体在不同物种间具有不同的形态,比如鲈(Perca fluviatilis)的尾垂体呈圆球形,青鱼及草鱼尾垂体分为左右两叶[25].但已有报道表明一个物种仅有一种类型的尾垂体,而南方鲇尾垂体明显具有两种形态,一种腹面观近似倒三角锥形;另一种近似蝌蚪形.这种情况目前国内外均未见报道,具体功能有待于深入研究.
4.2 CNSS结构变化与繁殖的关系
鱼类尾部神经分泌系统及其分泌物参与机体多种生理功能调节,其中包括参与繁殖调控.比如朱洪文[10]等观察鲫鱼的CNSS时发现其与性腺的发育周期变化密切相关,其分泌物具有积累、释放、恢复再积累的周期性变化.Sharma[26]等在丽塔鲇中也发现类似情况,同时观察到繁殖期间Herring小体内分泌物消失,只剩下空腔,而毛细血管管腔扩张,推测可能是Herring小体的内含物排入毛细血管,然后通过血液循环运送到全身行使其生理功能.本文通过比较南方鲇繁殖前后CNSS的变化,与已报道结果类似,但更精确的将性腺发育时期与CNSS紧密对应,并从超微结构证实了CNSS结构及其分泌物与繁殖间的关系.繁殖前、后Dahlgren细胞的细胞核、胞体和轴突内的内质网、核糖体等胞器以及分泌颗粒都有显著变化.超微结构表明,繁殖前,南方鲇Dahlgren细胞胞体和轴突以及轴突末梢内都有大量不同电子密度的致密颗粒;而繁殖后,原来充满分泌颗粒的部位多已排空,代替充满的是电子透明小泡,偶尔有残留的致密颗粒与电子空泡并存.故推测南方鲇尾部神经分泌颗粒可能由高尔基体分泌或轴突内管状系统泡状化后在原地形成,经过轴突到达轴突末梢,然后分泌出内含物形成残余物电子空泡,内含物通过内皮细胞作用后转运至毛细血管腔中行使与繁殖相关生理功能.
[1]吕为群,刘爽,钟英斌.鱼类尾部神经分泌系统研究进展[J].上海海洋大学学报,2012,21(5):743-749.
[2]陈恒,刘书朋,谷平.鱼类尾部神经分泌系统研究进展[J].上海大学学报(自然科学版),2000,6(3):248-254.
[3]陈阿琴,张影,陈松林,等.不同光周期条件下日本牙鲆尾部神经分泌系统转录组分析[J].水产学报,2016,40(6):833-843.
[4]吕为群,程若冰,兰兆辉.电生理技术在鱼类尾部神经分泌系统研究中的应用[J].水生生物学报,2014,38(4):780-785.
[5]Winter MJ,Ashworth A,Bond H,et al.The caudal neurosecretory system:control and function of a novel neuroendocrine system in fish[J].Biochemistryand Cell Biology,2000,78(3):193-203.
[6]Catherine R M,Weiqun L,Matthew J.Fish caudal neurosecretory system:A model for the study of neuroendocrine secretion[J]. General and Comparative Endocrinology,2007,153,243-250.
[7]陈恒,姜建明.鲫鱼尾部神经分泌系统Dahlgren cell季节性变化的细胞计量学研究[J].上海大学学报(自然科学版),1998,4(4):398-405.
[8]傅更锋,姜建民,徐根兴,等.鲫鱼(Carassius auratus)尾部神经分泌系统形态计量学的季节性变化[J].南京大学学报(自然科学版),1998,34(2):132-138.
[9]陈恒,姜建明,从默.鲫鱼尾部神经分泌系统Dahlgren细胞的糖类、脂类、蛋白质计量的季节性变化研究[J].生物学杂志,2000,17(2):11-12.
[10]朱洪文,徐根兴.鲫鱼尾部神经分泌系统显微和亚显微结构的季节性变化[J].动物学报,1987,33(1):67-72.
[11]Sharma S,Sharma A.Anote on the caudal neurosecretorysystem and seasonal changes observed in the Urophysis of Rita rita(Bleeker)Can[J].J Zool,1975,53:357-369.
[12]徐根兴,朱洪文.团头鲂的尾部神经分泌系统[J].水产学报,1986,10(2):205-210.
[13]Chen H,Mu R.Seasonal morphological and biochemical changes of Dahlgren cells implies a potential role of the caudal neurosecretory system(CNSS)in the reproduction cycle of teleostean fish[J].Fish Physiology and Biochemistry,2008,34(1):37-42.
[14]P.J.Bentley著.方永强,汪敏,周家澄译.脊椎动物比较内分泌学[M].北京:科学出版社,1984.
[15]Berlind,A.Teleost caudal neurosecretory system:Sperm duct contraction induced by urophysial material[J].J.Endocrinol. 1972,52:567-574.
[16]梁子卿,朱洪文.鲤鱼尾部神经分泌系统的精提液对蟾蜍体外跌卵作用以及对泥鳅催产作用的初步研究[C].中国第一届神经内分泌学术会议摘要汇编,生理通讯,1988,3:8-83.
[17]张耀光,杨桂枝,金丽.南方鲇卵巢滤泡细胞和卵膜生成的超微结构研究[J].西南师范大学学报(自然科学版),2004,29(6):1009-1015.
[18]王德寿,林浩然.鲇类生殖内分泌研究[J].水产学报,1996,20(2):151-158.
[19]谢碧文,岳兴建,张耀光,等.南方鲇脑垂体发育的研究[J].水生生物学报,2004,28(6):599-606.
[20]FridbergG,BernHA.TheUrophysisandthecaudal neurosecretorysystemoffishes[J].Biol.Rev,1968,43:175-199.
[21]Richard M K.The caudal Neurosecretory System of Poecilia sphenops(Poecillidae)[J].Journal of Morphology.1980,165:157-165.
[22]Carla C,Nadia F,Alessandra Greco,et.al.Development of the Caudal Neurosecretory System of the Nile Tilapia Oreochromis niloticus:An Immunohistochemical and Electron Microscopic Study[J].Journal ofMorphology.2000,243:209-218.
[23]Asish,C.Nag.Functional Morphology of the caudal region of certain clupeiform and perciform fishes with reference to the taxonomy[J].Journal ofMorphology,1967,123(4):529-558.
[24]ImaiK.Developmentofthecaudalandhypothalamic neurosecretorysystemoftheeel,Anguillajaponica[J]. Embryologia,1965,9:66-77.
[25]孟庆闻,苏锦祥,李婉端.鱼类比较解剖[M].科学出版社,1987,280-310.
[26]SharmaS.Studiesontheurophysisandthecaudal neurosecretorysystemin a teleost fish[J].(Ompokbim aculatus)Acta Anat,1973,86:83-95.
Changes on the Morphology and Structure and Pre-reproduction and Postreproduction of Caudal Neurosecretory System of Silurus meridionalis Chen
TAN Juan1,2,PU Deng-yong1,ZHANG Yao-guang1
(1.Key Laboratory of Aquatic Organism Reproduction and Development,Ministry of Education;The Key Laboratory of Aquatic Science of Chongqing;School of Life Science,Southwest University;Chongqing,400715;2.The College of Biology and Food Engineering,Huaihua University,Huaihua,Hunan 418008)
The changes on the morphology and structure and pre-reproduction and post-reproduction of caudal neurosecretory system(CNSS)from Silurus meridionalis were comparative studied by using the technology of anatomy,histology and transmission electron microscope(TEM).The results showed:The CNSS of Silurus meridionalis is mainly composed by urophysis,axon and Dahlgren cell.The urophysis is large,single style and continuousness,and it has two forms,semi-heart-shaped and hammer-shaped.The axon is usually amyelinated nerve fibers.The Dahlgren cell mainly distributes in the last three caudal spinal cord,and have two type,typeⅠand typeⅡ.There are significant different in size and morphology and the changes of pre-reproduction and post-reproduction between the two type cell.In prereproduction,the processes and endings of Dahlgren cell are full of two types of secretory granules which are electron dense-density and low-density.It contained abundant organelles in soma.In post-reproduction,secretory granules and ribosome declined sharply,mitochondrial vacuolization and RER lumen enlarge.
Silurus meridionalisChen;caudal neurosecretory system(CNSS);morphology;structure;reproduction
Q954
A
1671-9743(2016)11-0064-06
2016-09-16
水产科学重庆市重点实验室开放课题基金项目(KLAS-2015-01).
谭娟,1982年生,女,湖南株洲人,讲师,研究方向:动物的生长和发育.
*通讯作者:张耀光,1955年生,男,四川蓬溪人,教授,博士生导师,研究方向:鱼类繁殖生物学、发育生物学等.
