IL对NK细胞杀伤人骨髓瘤RPMI 8226细胞活性的影响及其机制
2016-05-12韩露高全立宋永平周健郑州大学附属肿瘤医院河南省肿瘤医院郑州450008
韩露,高全立,宋永平,周健(郑州大学附属肿瘤医院 河南省肿瘤医院,郑州450008)
·论著·
IL对NK细胞杀伤人骨髓瘤RPMI 8226细胞活性的影响及其机制
韩露,高全立,宋永平,周健(郑州大学附属肿瘤医院 河南省肿瘤医院,郑州450008)
摘要:目的探讨IL对NK细胞杀伤人骨髓瘤RPMI 8226细胞活性的影响,并探讨其机制。方法取正常人外周血单个核细胞,随机分为6 组,对照组以单纯培养基培养,IL-2组加入1 000 U/mL IL-2,IL-7组加入40 ng/mL IL-7,IL-21组加入20 ng/mL IL-21,IL-2+IL-7组分别加入1 000 U/mL IL-2和40 ng/mL IL-7,IL-2+IL-7+IL-21组分别加入1 000 U/mL IL-2、40 ng/mL IL-7和20 ng/mL IL-21,均培养5天。采用流式细胞术检测各组NK细胞比例及其表面激活性受体NKG2D、NKp46、NNKp30阳性表达细胞比例,RT-PCR法检测各组NK细胞NKG2D mRNA、NKP46 mRNA和NKP30 mRNA,CFSE/PI双染法检测各组NK细胞对RPMI 8226细胞的细胞毒效应(杀伤率)。结果除IL-7组外,其余各组NK细胞比例和细胞表面NKG2D阳性表达细胞比例均较对照组升高(P均<0.05)。各组NK细胞NKG2D mRNA、NKP46 mRNA和NKP30 mRNA表达量比较差异均无统计学意义(P均>0.05)。对照组NK细胞对RPMI 8226细胞的杀伤率为2.13%±0.42%、IL-2组为58.73%±1.80%、IL-7组为1.90%±0.60%、IL-21组为14.43%±1.22%、IL-2+IL-7组为34.27%±2.35%、IL-2+IL-7+IL-21组为37.47%±0.60%,各组与对照组比较P均<0.05。结论单因子IL-2、IL-21,双因子IL-2+IL-7和多因子IL-2+IL-7+IL-21均能提高NK细胞对人骨髓瘤RPMI 8226细胞的杀伤活性,以单因子IL-2作用效果最好;其作用机制可能为IL增加NK细胞数量和其表面活化性受体NKG2D的表达量。
关键词:多发性骨髓瘤;自然杀伤细胞;白细胞介素;天然细胞毒受体;NKG2D
多发性骨髓瘤(MM)是一种浆细胞恶性增殖性疾病,发病率占血液系统肿瘤的10%[1]。多药联合化疗对MM的完全缓解率低于5%。造血干细胞移植联合高剂量化疗方案能够延长MM患者生存期,但移植相关疾病病死率高、缺乏人类白细胞抗原(HLA)相合供者使造血干细胞移植难以实施。近年来,细胞免疫治疗成为化疗和造血干细胞移植后清除残留肿瘤细胞的重要手段[2]。NK细胞是一类具有直接杀伤靶细胞效应的淋巴细胞。IL-2可增强外周血NK细胞的体外杀伤活性,目前已经广泛应用于恶性肿瘤的治疗,有效率为15%~20%[3]。但IL-2对MM及其他IL对MM的影响及其作用机制研究较少。2010年1月~2011年3月,本研究观察了IL-2、IL-7、IL-21对NK细胞杀伤人骨髓瘤RPMI 8226细胞活性的影响,现分析结果并探讨其机制。
1材料与方法
1.1材料①主要试剂:RPMI 1640培养液(Hyclone公司),GT-T551培养液(TaKaRa公司),胎牛血清(FBS,Gibco公司),重组人IL-2(山东泉港药业有限公司)、IL-7(Peprotech公司)、IL-21(Peprotech公司),NKG2D-APC、NKP46-APC、NKP30-APC、CD3-FITC/CD16+CD56+-PE流式细胞荧光标记抗体(Biolegend公司),碘化丙啶(PI,Sigma公司)。逆转录试剂盒、Reagent试剂盒、PCR Marker(Invitrogen公司),RT-PCR反应试剂盒(大连宝生物工程公司)。活细胞荧光染料羧基(CFSE,Invitrogen公司)。②细胞株:人骨髓瘤细胞株RPMI 8226由郑州大学中心实验室提供。③人外周血样品:取自郑州大学身体健康的大学生志愿捐献者。
1.2人骨髓瘤RPMI 8226细胞培养人骨髓瘤RPMI 8226细胞置于含100 mL/L FBS的RPMI 1640培养基,37 ℃、5% CO2、充分湿度的培养箱中培养。取对数生长期细胞用于实验。
1.3NK细胞收集、分离与培养采用Ficoll密度梯度离心法分离人外周血单个核细胞(PBMC)(献血2 h内完成),PBS洗涤两次,细胞计数后以5×106/mL分别接种于6个25 cm2培养瓶置于含100 μg/mL链霉素、100 U/mL青霉素、5%自体血浆的10 mL GT-T551培养基培养。随机分为6 组,对照组以单纯培养基培养,IL-2组加入1 000 U/mL IL-2,IL-7组加入40 ng/mL IL-7,IL-21组加入20 ng/mL IL-21,IL-2+IL-7组分别加入1 000 U/mL IL-2和40 ng/mL IL-7,IL-2+IL-7+IL-21组分别加入1 000 U/mL IL-2、40 ng/mL IL-7和20 ng/mL IL-21,作用3天后离心换液并全量补充以上细胞因子,5天后收获细胞。
1.4相关指标观察
1.4.1NK细胞比例及其表面激活性受体NKG2D、NKP46、NKP30表达采用直接免疫荧光标记法标记各组细胞NK细胞比例,即CD3-/CD16+CD56+细胞百分比;FACS Calibur流式细胞仪(B-D公司)检测NK细胞表面激活性受体NKG2D、NKP46、NKP30阳性表达细胞百分比。
1.4.2NK细胞NKG2D mRNA、NKP46 mRNA和NKP30 mRNA表达采用RT-PCR法。采用TRIzol一步法提取各组细胞总RNA,按逆转录试剂盒说明书步骤进行逆转录合成cDNA。NKG2D、NKP46和NKP30引物序列均由上海生工生物工程技术服务有限公司合成(见表1)。按照说明书步骤采用ABI7300实时定量PCR仪上样扩增,ABI7300系统分析荧光值,采用2-ΔΔCt法对结果进行相对定量分析。

表1 NKG2D、NKP46、NKP30、β-actin引物序列及产物
1.4.3NK细胞对人骨髓瘤RPMI 8226细胞的杀伤率收集靶细胞RPMI 8226,细胞计数后用预温好的CFSE-PBS液重悬,37 ℃放置5 min,加入含10% FBS的RPMI 1640培养基终止反应,离心弃上清,用GTT-551培养基调整细胞终浓度为5×105/mL;分别将各组NK细胞密度调整为5×106/mL;将上述两种细胞按20∶1(660 mL∶330 mL)比例混合,培养箱中放置4 h;每管加终浓度为1.5 mg/mL的PI,上机检测,CellQuest软件分析结果,计算靶细胞杀伤率[3]。
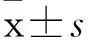
2结果
2.1各组NK细胞比例及其表面激活性受体NKG2D、NKP46、NKP30阳性表达细胞百分比比较除IL-7组,各组NK细胞比例及其表面NKG2D阳性表达细胞百分比均较对照组升高(P均<0.05)。见表2。
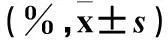
表2 各组CD3-/CD16+CD56+细胞及其表面受体NKG2D、
注:与对照组比较,*P<0.05。
2.2各组NK细胞NKG2D mRNA、NKP46 mRNA和NKP30 mRNA相对表达量比较各组NK细胞NKG2D mRNA、NKP46 mRNA和NKP30 mRNA相对表达量比较差异均无统计学意义(P均>0.05)。见表3。

表3 各组NK细胞NKG2D mRNA、NKP46 mRNA
2.3各组NK细胞对RPMI 8226细胞的杀伤率对照组NK细胞对RPMI 8226细胞的杀伤率为2.13%±0.42%、IL-2组为58.73%±1.80%、IL-7组为1.90%±0.60%、IL-21组为14.43%±1.22%、IL-2+IL-7组为34.27%±2.35%、IL-2+IL-7+IL-21组为37.47%±0.60%,IL-7组较对照组降低,其余组均较对照组升高,组间比较P均<0.05。
3讨论
NK细胞是一类具有直接杀伤靶细胞效应的淋巴细胞,在机体的免疫系统中发挥关键作用。研究发现,NK细胞表面有活化性受体和抑制性受体,这些受体与靶细胞表面相应的配体结合,形成两种不同的信号传递系统,对NK细胞的杀伤功能起激活或抑制作用[3]。NK细胞表面的活化性受体包括NKG2D、天然细胞毒受体(NCRs)、KIR2DS及其辅助刺激活化性受体CD244、NTB2A、CD59等[4]。NKG2D为NK细胞表面重要的活化性受体[5],NKG2D与其配体结合后,能直接或辅助激活一系列的免疫细胞,在机体抗肿瘤免疫中发挥重要作用。NCRs家族包含三种免疫球蛋白样分子,即NKP46、NKP44和NKP30[6,7]。NCRs在细胞表面的表达程度与NK细胞功能的发挥密切相关,但NCRs的配体至今尚未明确[8]。NK细胞抑制性受体包括免疫球蛋白超家族、C型凝集素家族。抑制性受体和其相应配体结合,传导抑制信号,从而阻止NK细胞对靶细胞的细胞毒作用。因此,如要提高NK细胞对靶细胞的杀伤活性,除降低抑制性信号外,激发NK细胞的活化性信号更为重要[9,10]。
本研究结果显示,除了IL-7组NK细胞比例(CD3-/CD16+CD56+)较对照组降低外,其余各组NK细胞比例均较对照组升高,表明单因子IL-2或IL-21、双因子IL-2+IL-7和三因子IL-2+IL-7+IL-21培养均能促进NK细胞扩增;NK细胞被IL-2或IL-21单独刺激后杀伤活性较未被刺激时明显增强,NK细胞比例较未被刺激时明显增多,NKG2D阳性表达细胞百分比明显上调;表明IL-2或IL-21对NK细胞的细胞毒活性影响可能一方面是增加NK细胞数量,另一方面通过上调NKG2D增强NK细胞的杀伤能力。但RT-PCR结果显示,IL-2或IL-21活化的NK细胞NKG2D mRNA相对表达量与对照组比较并无明显差异。推测IL-2或IL-21虽然可以上调细胞表面NKG2D表达,但并不能影响其基因水平,IL-2或IL-21对于NKG2D的调节作用可能主要是通过影响其mRNA的翻译水平实现的,这与以往的研究相吻合[11,12]。IL-7组诱导培养NK细胞比例及活化性受体的相对表达量与对照组比较差异均无统计学意义,可能是本研究中IL-7的工作浓度过低,也可能是单一的IL-7并不能诱导NK细胞的产生。IL-2+IL-7组和IL-2+IL-7+IL-21组NK细胞比例及激活性受体的相对表达量并未较单独的IL-2作用增强,表明IL-2、IL-7和IL-21联合并无协同作用,其机制有待进一步探讨。
研究发现,IL-2可上调NK细胞表面受体NKG2D、KIR2DL1、KIR2DL2表达[13]。Lu等[14]研究表明,IL-2、OKT-3和IFN-γ刺激培养的CIK,可使其细胞表面高表达NKG2D受体,且可阻断MM细胞的NKG2D配体,CIK对MM细胞的细胞毒效应明显降低,NKG2D和其配体相互作用是介导CIK杀伤MM细胞的重要机制。Denman等[15]研究发现,膜型IL-21可促进NK细胞活化并增强NK细胞的杀伤活性,膜型IL-21刺激NK细胞表面高表达NCRs、CD16和NKG2D,并可分泌大量细胞因子。本研究结果显示,单因子IL-2或IL-21、双因子IL-2+IL-7和多因子IL-2+IL-7+IL-21均能提高NK细胞对人骨髓瘤RPMI 8226细胞的杀伤活性,其中以单因子IL-2作用效果最好;其机制可能与细胞因子诱导NK细胞数量及其细胞表面活化性受体NKG2D表达增加有关,但其确切机制还需进一步探讨。
参考文献:
[1] Costello RT, Boehrer A, Sanchez C, et al. Differential expression of natural killer cell activat marrow in patients with monoclonal gammopathy[J]. Immunology, 2013,139(3):338-341.
[2] Ryosei N, Jeanette B, Andreas B, et al. In vivo trafficking and survival of cytokine-induced killer cells resulting in minimal GVHD with retention of antitumor activity[J]. Blood, 2008,112 (8):2563-2574.
[3] De Saint Basile G, Menasche G, Fischer A. Molecular mechanisms of biogenesis and exocytosis of cytotoxic granules[J]. Nat Rev Immunol, 2010(10):568-579.
[4] 刘丹.NK细胞表面活化性受体的研究进展[J].国际免疫学杂志,2006,29(5):302-305.
[5] Zafirova B, Wensveen FM, Gulin M, et al. Regulation of immune cell function and differentiation by the NKG2D receptor[J]. Cell Mol Life Sci, 2011(68):3519-3529.
[6] Roland KS. A symmetric ligand recognition by theactivating natural killer cell receptor NKG2D, asymmetric homodimer [J]. Molecular Jmmunology, 2001,38(14):1029-1037.
[7] Li Y, Wang Q, Mariuzza RA. Structure of the human activating natural cytotoxicity receptor NKp30 bound to its tumor cell ligand B7-H6[J]. J Exp Med, 2011,208(4):703-714.
[8] Pende D, Cantoni C, Rivera P, et al. Role of NKG2D in tumor cell lysis mediated by human NK cells: cooperation with natural cytotoxicity receptors and capability of recognizing tumors of nonepithelial origin[J]. Eur J Immunol, 2001,31(4):1076-1086.
[9] Coudert JD, Zimmer J, Tomasello E, et al. Altered NKG2D function in NK cells induced by chronic exposure to NKG2D ligand-expressing tumor cells[J]. Blood, 2005,106(15):1711-1717.
[10] Vankayalapati R, Garg A, Porgador A, et al. Role of NK cell-activating receptors and their ligands in the lysis of mononuclear phagocytes infected with an intracellular bacterium[J]. J Immunol, 2005,175 (7):4611-4617.
[11] Dhanji S, Teh HS. IL-2-activated CD8+CD44high cells express both adaptive and innate immune system receptors and demonstrate specificity for syngeneic tumor cells[J]. J Immunol, 2003,171(7):3442-3450.
[12] Decot V, Voillard L, Latger-Cannard V, et al. Natural-killer cell amplification for adoptive leukemia relapse immunotherapy: comparison of three cytokines, IL-2, IL-15, or IL-7 and impact on NKG2D, KIR2DL1, and KIR2DL2 expression[J]. Experimental Hematology, 2010,38(5):351-362.
[13] Peest D, Leo R, Deicher H. Tumor-directed cytotoxicity in multiple myeloma-the basis for an experimental treatment pproach with interleukin-2[J]. Stem Cells, 1995,13(2):72-76.
[14] Lu XZ, Zhu AS, Cai XH, et al. Role of NKG2D in cytokine-induced killer cells against multiple myeloma cells [J]. Cancer Biol & Ther, 2012,13(8):623-629.
[15] Denman CJ, Senyukov VV, Somanchi SS, et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells[J]. PLoS One, 2012,7(1):e30264.
Influence of interleukin in inducing the cytotoxicity of NK cells against human multiple myeloma RPMI 8226 cells and its mechanism
HANLu,GAOQuanli,SONGYongping,ZHOUJian
(TheAffiliatedTumorHospitalofZhengzhouUniversity,Zhengzhou450008,China)
Abstract:ObjectiveTo investigate the influence of interleukin (IL) in inducing the cytotoxicity of natural killer (NK) cells against the activity of human multiple myeloma RPMI 8226 and the correlated molecular mechanisms. MethodsThe human peripheral blood mononuclear cells (PBMC) were randomly divided into 6 groups: the control group (simple culture medium), IL-2 group (added with 1 000 U/mL IL-2), IL-7 group (40 ng/mL IL-7), IL-21 group (20 ng/mL IL-21), IL-2+IL-7 group (1 000 U/mL IL-2+40 ng/mL IL-7) and IL-2+IL-7+IL-21 group (1 000 U/mL IL-2, 40 ng/mL IL-7+20 ng/mL IL-21). They were all cultured for 5 days. The proportion of NK cells and the expression of activated receptors (NKG2D, NKp46, NKp44 and NNKp30) were measured by flow cytometry. The expression of NKG2D mRNA, NKP46 mRNA and NKP30 mRNA was measured by RT-PCR. Cytotoxicity of NK cells against RPMI8226 cells was analyzed by CFSE/PI double staining. ResultsExcept the IL-7 group, the proportion of NK cells and the expression of NKG2D in the other groups were increased as compared with those of the control group (all P<0.05). No significant difference in the gene expression of NKG2D, NNKp46 and NKp30 was found among these groups (all P>0.05). The cell-killing rate of NK cells on RPMI8226 cells in the control group was 2.13%±0.42%, and that in the IL-2 group was 58.73%±1.80%, the IL-7 group was 1.90%±0.60%, the IL-21 group was 14.43%±1.22%, the IL-2+IL-7 group was 34.27%±2.35%, and the IL-2+IL-7+ IL-21 group was 37.47%±0.60%. Significant difference was found in the cell-killing rate between the control group and the other groups (all P<0.05). ConclusionsThe single factor IL-2, IL-21, double-factor IL-2+ IL-7 and multi-factor IL-2+ IL-7+IL-21 can enhance the cytotoxic effect of NK cells against RPMI 8226 cells, and the single factor IL-2 is the best. The increased number of NK cells and the expression of cell surface activation acceptor (NKG2D) may be the possible mechanism.
Key words:multiple myeloma; natural killer cell; interleukin; natural cytotoxicity receptor; NKG2D
(收稿日期:2015-12-02)
中图分类号:R733.3
文献标志码:A
文章编号:1002-266X(2016)12-0001-04
doi:10.3969/j.issn.1002-266X.2016.12.001
通信作者简介:周健(1975-),男,副主任医师,主要研究方向为血液病的免疫治疗。E-mail: zhoujiandoctor@163.com
第一作者简介:韩露(1979-),女,住院医师,主要研究方向为血液病的免疫治疗。E-mail: luhan0377@163.com
基金项目:国家自然科学基金资助项目(81000921)。
