外源性瘦素预防糖尿病大鼠呼吸机相关性肺损伤机制探讨
2016-05-12张爱民蒋宗滨李燕尧陈云婷广西医科大学南宁530007广西医科大学第一附属医院
张爱民,蒋宗滨,李燕尧,陈云婷(广西医科大学,南宁530007;广西医科大学第一附属医院)
·基础研究·
外源性瘦素预防糖尿病大鼠呼吸机相关性肺损伤机制探讨
张爱民1,蒋宗滨2,李燕尧2,陈云婷2(1广西医科大学,南宁530007;2广西医科大学第一附属医院)
摘要:目的探讨外源性瘦素对糖尿病大鼠呼吸机相关性肺损伤(VILI)的保护机制。 方法选择Wistar大鼠40只,取其中30只制备2型糖尿病模型并分为B、C、D组各10只,其余10只未造模大鼠为A组。造模后各组腹腔注射麻醉,气管切开并插管,A、B组带管自主呼吸,C组应用40 mL/kg潮气量行呼吸机机械通气4 h,D组经气管插管滴注外源性重组瘦素50 μg/kg后,应用40 mL/kg潮气量行呼吸机机械通气4 h。机械通气结束后,处死各组大鼠,取出肺脏,测定湿干比(W/D),HE染色法观察肺组织病理改变并进行病理评分,免疫组化法检测肺组织瘦素及瘦素受体(OB-Rb)蛋白表达,ELISA法检测肺组织匀浆中白细胞介素1β(IL-1β)、髓过氧化物酶(MPO)、巨噬细胞炎症蛋白2(MIP-2)及肿瘤坏死因子α(TNF-α)水平。结果C、D组W/D、肺组织病理评分均高于A、B组,D组W/D、肺组织病理评分、瘦素、OB-Rb蛋白表达均低于C组(P均<0.05)。D组肺组织匀浆中IL-1β、TNF-α、MIP-2、MPO水平及肺组织瘦素、OB-Rb表达均低于C组(P均<0.05)。结论外源性瘦素预处理可明显减轻糖尿病大鼠VILI,其机制可能与抑制内源性瘦素水平及肺组织炎症反应有关。
关键词:呼吸机相关性肺损伤;糖尿病;瘦素;瘦素抵抗;炎症
糖尿病常引起全身多器官损害,肺脏是主要的损伤部位之一,可导致肺组织炎性细胞浸润[1]、通气功能与弥散功能下降[2],出现代谢源性肺功能异常。当糖尿病患者出现呼吸功能衰竭需行呼吸机治疗时,往往可导致其肺损伤进一步加重,出现呼吸机相关性肺损伤(VILI),表现为肺组织炎症反应、透明膜形成、血管通透性增加及肺水肿。瘦素是由脂肪组织分泌的神经肽类物质,在能量平衡、脂类代谢、胰岛素分泌等机制中发挥重要作用[3]。近年研究发现,瘦素预处理可有效抑制急性肺脏缺血梗死后的炎症因子水平,对肺组织发挥保护作用[4]。但外源性瘦素预处理是否能有效抑制糖尿病VILI尚不明确。2014年3~7月,我们对糖尿病VILI大鼠应用外源性瘦素,探讨其对VILI的保护作用机制。
1资料与方法
1.1动物与试剂清洁级Wistar大鼠40只,4周龄,体质量80~100 g(由广西医科大学动物实验中心提供,合格证号:SYXK 桂2014-003)。外源性重组瘦素(美国PeproTech公司);痩素受体(OB-Rb)抗体(武汉博士德生物工程有限公司);四氧嘧啶(美国Sigma公司);白细胞介素1β(IL-1β)、髓过氧化物酶(MPO)、巨噬细胞炎症蛋白2(MIP-2)和肿瘤坏死因子α(TNF-α)试剂盒(上海蓝基生物科技有限公司);大鼠瘦素单抗(英国ABCAM公司);苏木素染液(上海碧云天生物技术有限公司)。本实验通过广西医科大学动物伦理委员会审核。
1.2模型制备及分组取30只Wistar大鼠,参照文献[5]采用两次腹腔注射四氧嘧啶法制备2型糖尿病模型。72 h后取尾静脉血测空腹血糖,以空腹血糖≥16.7 mmol/L为糖尿病模型制备成功。将糖尿病大鼠按随机数字表法分为B、C、D组各10只。其余10只未造模大鼠作为正常对照组(A组)。
1.3呼吸机干预方法根据文献[6],各组使用6 mg/kg的10%水合氯醛腹腔注射麻醉,气管切开并插管。A、B组带管自主呼吸4 h,C组应用40 mL/kg潮气量行呼吸机机械通气4 h,D组经气管插管滴注50 μg/kg的外源性重组瘦素后,应用40 mL/kg潮气量行呼吸机机械通气4 h。
1.4标本取材机械通气结束后,颈总动脉放血处死各组大鼠,在4 ℃条件下迅速打开胸腔取出肺脏。将一部分标本-80℃冻存,另一部分标本贮存于4%甲醛,分别作肺组织匀浆和病理切片。
1.5肺组织重量测定取右肺上叶,蘸干表面水分称湿重(W),然后75 ℃烘烤48 h称干重(D),计算湿干比(W/D),评估肺组织的水肿程度。
1.6肺组织病理观察采用HE染色法。肺组织固定后石蜡包埋,切片行HE染色,观察病理改变并进行病理评分。对下列四项表现进行评分:①肺泡腔充血;②出血;③肺泡腔或血管壁中性粒细胞浸润聚集;④肺泡壁增厚和透明膜形成。依病变轻重评分[7],0分为无病变或轻微,1分为轻度病变,2分为中度病变,3分为重度病变,4分为极重度病变。各项分数相加作为病理评分。
1.7肺组织瘦素及OB-Rb蛋白表达检测采用免疫组化法。组织切片后进行抗原修复,分别用瘦素单抗、OB-Rb抗体作为一抗4 ℃过夜,二抗和辣根过氧化物酶孵育后,DAB显色、苏木素染核,封片。用Olympus显微镜及显微摄像仪对染色组织切片进行观察。每个切片随机取5个高倍视野,分别测定阳性颗粒的平均光密度值(IOD)作为瘦素和OB-Rb蛋白表达水平。
1.8肺组织匀浆中炎性因子检测采用ELISA法检测各组肺组织匀浆中IL-1β、TNF-α、MIP-2及MPO水平。
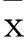
2结果
2.1各组肺组织W/D比较C、D组W/D高于A、B组,D组W/D低于C组(P均<0.05)。见表1。
2.2各组肺组织病理改变及病理评分比较A组未见明显肺损伤;B组有少量白细胞浸润与炎性渗出;D组肺组织点状出血、肺间质水肿明显,大量炎细胞聚集,肺实变明显;E组少量点状出血,肺间质部分水肿与炎细胞聚集,无肺实变。各组肺组织病理评分见表1。
2.3肺组织瘦素、OB-Rb蛋白表达比较D组瘦素、OB-Rb蛋白表达均低于B、C组(P均<0.05)。见表1。
2.4肺组织匀浆中炎性因子水平比较C、D组肺组织匀浆中IL-1β、TNF-α、MIP-2、MPO水平均高于A、B组,D组以上各指标水平均低于C组(P均<0.05)。见表2。
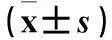
表1 各组肺组织W/D、病理评分、肺组织瘦素
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05。

表2 各组肺组织匀浆中IL-1β、TNF-α、MIP-2
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05。
3讨论
糖尿病是一类全身性的代谢性疾病,可导致多个重要器官的病变。长期高血糖可使肺功能受到损害,其肺功能损伤程度与血糖水平有关[8],胰岛素抵抗也可降低肺弥散功能[9]。随糖尿病病程进展,肺功能损伤可能更加严重。糖尿病患者后期存在因呼吸功能障碍而接受呼吸机治疗的可能。然而,呼吸机常会导致VILI,使肺血管通透性增加、炎性细胞积聚和细胞因子、炎症趋化因子释放,可进一步加重肺损伤[10]。因此,寻找减轻糖尿病患者VILI的方法,对于改善糖尿病患者应用呼吸机治疗的效果、促进病情转归具有重要意义。
瘦素是肥胖基因的产物,除具有调控脂肪代谢和体质量外,还具有促炎、造血、促进血管生成及活性氧生成等作用。糖尿病患者体内高血糖状态可导致脂肪-胰岛素分泌轴失衡,导致高瘦素血症。高瘦素血症(瘦素抵抗)可促进肺内炎症因子生成,诱导促炎性细胞因子前体向活性转化[11]。同时,糖尿病患者呈现胰岛素抵抗,胰岛素抵抗可刺激瘦素基因的过度表达,使血液与组织的内源性瘦素升高,诱导体内产生胰岛素抵抗,加重组织的损伤。而外源性瘦素具有与内源性瘦素不同的作用,外源性瘦素可降低内源性瘦素水平,通过脂肪-胰岛素轴改善胰岛素抵抗,调控胰岛素敏感性,降低体内血糖水平,抑制氧化应激,从而缓解肺组织损伤,对肺组织具有保护作用。研究发现,通过外源性瘦素预处理可以有效降低肺梗死的损伤程度,提示外源性瘦素可能对肺损伤有保护作用。OB-Rb是瘦素识别并结合的主要受体,在呼吸系统的支气管和肺泡上皮细胞、支气管平滑肌细胞上表达丰富。瘦素通过作用于OB-Rb发挥对炎症信号通路的调控。本研究发现,糖尿病模型大鼠W/D均大于4,提示即使未经呼吸机治疗,糖尿病大鼠已经产生明显的肺组织水肿;D组W/D、病理评分、瘦素、OB-Rb蛋白表达均低于C组,提示外源性瘦素预处理后,降低了肺部的瘦素水平、减轻了肺组织损伤,与余帆等[12]研究结果一致。OB-Rb表达量的降低,可能由于高瘦素血症改善,伴随体内胰岛素水平发生下降,对OB-Rb的刺激作用减弱所致。
炎症浸润是导致肺组织病理改变的重要基础。糖尿病大鼠的肺组织可出现炎性细胞浸润,使肺泡上皮、肺泡上皮细胞基底膜、肺泡壁、肺泡毛细血管基底膜、支气管基底膜、肺泡间隔增厚,导致肺间质胶原成分增多,造成呼吸功能障碍[13]。炎症反应时,IL-1β组织水平增加,而IL-1β能够减少趋化因子4的表达,从而提高多形核白细胞(PMN)的含量,PMN能通过活性氧、弹性水解酶等导致肺损伤。TNF-α的增加可启动炎症级联反应,使MIP-2在肺内大量浸润聚集,启动与维持炎症反应导致的肺损伤[14],而MPO活性增高也可直接浸润肺组织[15]。糖尿病出现瘦素抵抗时,体内呈现高炎症水平。本研究发现,C组大鼠肺组织匀浆中IL-1β、TNF-α、MIP-2及MPO等炎性因子水平高于A、B组,提示应用呼吸机后糖尿病大鼠肺组织发生炎症反应,可能与VILI的发生有关;D组肺组织匀浆中IL-1β、TNF-α、MIP-2、MPO水平均低于C组,提示外源性瘦素预处理可明显减轻肺组织炎症反应,从而减轻VILI,考虑外源性瘦素减轻呼吸机对糖尿病大鼠肺功能损害的机制可能与抑制内源性瘦素水平、降低肺组织炎症反应有关。
综上所述,外源性瘦素预处理可明显减轻糖尿病大鼠VILI,其机制可能与抑制内源性瘦素水平及肺组织炎症反应有关。
参考文献:
[1] 张宏, 白景文, 于振涛,等. 2型糖尿病患者慢性肺损伤的超微病理改变及临床意义[J]. 解剖学报,2005,36(6):70-73.
[2] 杨海涛, 田亚强, 张光珍. 2型糖尿病患者肺功能改变及其相关因素分析[J]. 山东医药,2006,46(32):39-40.
[3] Hou N, Luo JD. Leptin and cardiovascular diseases[J]. Bri J Dia Vasc Dis, 2011,38(12):905-913.
[4] 姚艳敏,王希柱,宋巧凤,等.外源性瘦素在急性肺栓塞合并肺损伤中的作用机制研究[J].中华全科医学,2013,11(2):171-174.
[5] Ismail TA, Soliman MM, Nassan MA. Molecular and immunohistochemical effects of metformin in a rat model of type 2 diabetes mellitus[J]. Exp Ther Med, 2015,9(5):1921-1930.
[6] 武庆平, 刘萍, 王立奎, 等. 不同潮气量通气对大鼠呼吸机相关性肺损伤模型的影响[J].华中科技大学学报(医学版),2006,35(4):511-514.
[7] Pastor CM, Rubbia-Brandt L, Hadengue A, et al. Role of macrophage inflammatory peptide-2 in cerulein-induced acute pancreatitis and pancreatitis-associated lung injury[J]. Lab Invest, 2003,83(4):471-478.
[8] 周峥, 曾军, 肖正华, 等. 2型糖尿病对肺功能的影响[J]. 中国煤炭工业医学杂志,2005,8(6):566-567.
[9] 孙建勋, 王静. 2型糖尿病患者肺功能变化及其影响因素[J]. 中国医药导报,2006,3(30):22-24.
[10] Bhattacharya S, Sen N, Yiming MT, et al. High tidal volume ventilation induces proinflammatory signaling in rat lung endothelium[J]. Am J Respir Cell Mol Biol, 2003,28(2):218-224.
[11] Zarkesh-Esfahani H, Pockley G, Metcalfe RA, et al. High-dose Leptin activates human leukocytes via receptor expression on monocytes[J].J Immun, 2001,167(8):4593-4599.
[12] 余帆, 徐彤彤, 吕祥威,等. 瘦素预处理对2型糖尿病大鼠心肌缺血再灌注损伤的保护作用[J]. 吉林大学学报(医学版),2013,39(6):1219-1223.
[13] 穆维新, 沈亚欣, 崔士杰, 等. 2型糖尿病大鼠肺组织基质金属蛋白酶-2、9及其抑制因子-1的表达变化[J].河北医药,2010,32(9):1034-1037.
[14] Pastor CM, Rubbia BL, Hadengue A, et al. Role of macrophage inflammatory peptide-2 in cerulein-induced acute pancreatitis and pancreatitis-associated lung injury[J]. Lab Invest, 2003,83(4):471-478.
[15] Haegens A, Heeringa P, van Suylen RJ, et al. Myeloperoxidase deficiency attenuates lipopolysaccharide-induced acute lung inflammation and subsequent cytokine and chemokine production[J].J Immun, 2009,182(12):7990-7996.
(收稿日期:2015-08-20)
中图分类号:R587.1
文献标志码:A
文章编号:1002-266X(2016)14-0025-03
doi:10.3969/j.issn.1002-266X.2016.14.008
通信作者:蒋宗滨(E-mail: jiangzongbin@hotmail.com)
基金项目:广西自然科学基金资助项目(2013GXNSFAA019137)。
