骨髓间充质干细胞旁分泌效应对胰腺β细胞增殖、凋亡及分泌功能的影响
2016-05-12许聿新井庆平赵翠红淄博市第一医院山东淄博255200
许聿新,井庆平,赵翠红(淄博市第一医院,山东淄博255200)
·论著·
骨髓间充质干细胞旁分泌效应对胰腺β细胞增殖、凋亡及分泌功能的影响
许聿新,井庆平,赵翠红(淄博市第一医院,山东淄博255200)
摘要:目的观察骨髓间充质干细胞(BMSCs)旁分泌效应对胰腺β细胞系INS-1细胞增殖、凋亡及胰岛素分泌的影响。方法培养BMSCs,以胰腺提取物(RPE)模拟胰腺微环境培养BMSCs后,获取BMSCs的条件培养液(BMSCs-CM)。将细胞分为A组、B组、C组,分别以BMSCs-CM、不含RPE的条件培养液、等量RPMI 1640培养液培养。采用MTT法观察各组细胞增殖情况,计算细胞增殖率。采用AnnexinⅤ/PI法观察各组细胞凋亡情况,计算细胞凋亡率。应用放射免疫法(RIA)测定各组胰岛素水平。结果 A组细胞增殖率高于B组及C组(P均<0.05)。A组细胞凋亡率低于B组及C组(P均<0.05)。在葡萄糖溶液终浓度为5.6及20.0 mmol/L时,A组胰岛素水平均高于B组及C组(P均<0.05)。结论BMSCs-CM培养INS-1细胞后可促进其增殖、抑制其凋亡并促进其分泌胰岛素,BMSCs可能通过旁分泌效应发挥以上作用。
关键词:干细胞,骨髓;胰腺β细胞;细胞因子;凋亡;增殖
糖尿病的主要发病机制之一为胰岛β细胞的增殖及凋亡失衡,导致胰岛β细胞团不足,不能分泌充足的胰岛素。骨髓间充质干细胞(BMSCs)是重要的种子细胞,移植BMSCs到胰腺后可以改善糖尿病大鼠的高血糖状态,但其机制尚未明确[1,2]。研究发现,移植到体内的BMSCs并不能直接分化为胰岛素分泌细胞,从而增殖为有功能的胰岛β细胞团[3]。但BMSCs在不同的微环境影响下可以分泌不同的细胞因子,从而调节周围细胞的增殖、凋亡及血管生成等,发挥重要的旁分泌作用。因此,BMSCs旁分泌效应可能在改善靶器官功能、抗凋亡方面发挥重要的作用。我们前期研究发现,以胰腺提取物(RPE)模拟胰腺微环境培养BMSCs后,可使BMSCs通过旁分泌效应分泌多种对胰腺具有保护作用的细胞因子[4]。但这种BMSCs旁分泌效应对胰腺β细胞增殖、凋亡及胰岛素分泌的影响尚不明确。 2015 年1~6月,我们用RPE处理BMSCs后的条件培养液(BMSCs-CM)孵育胰腺β细胞系胰岛细胞瘤INS-1细胞,观察BMSCs旁分泌效应对INS-1细胞增殖、凋亡及胰岛素分泌的影响,探讨BMSCs移植治疗糖尿病的机制。
1材料与方法
1.1动物及试剂雄性Wistar大鼠20只,体质量160~220 g,6~8周龄,清洁级,购自山东大学实验动物中心。大鼠INS-1细胞由佛罗里达大学医学院馈赠。主要试剂:RPE参照文献[4]制备,包含胰腺中多种多肽及细胞因子;FITC-羊抗鼠二抗IgG(Beckman Coulter公司);PI(美国Sigma公司);AnnexinⅤ-FITC(美国BD公司)。
1.2BMSCs培养及鉴定处死大鼠,采用全骨髓贴壁培养法分离培养BMSCs。48 h后,可见少量贴壁细胞,经过3代后BMSCs基本达到形态均一。流式细胞仪分析第3代BMSCs细胞表型,以细胞高表达CD44和CD90,而CD34、CD45低表达或表达阴性,为BMSCs培养成功。
1.3BMSCs-CM制备[5,6]取第3代BMSCs,培养于含10%FBS的LG-DMEM的培养板中,培养基中加入RPE培养7 d,然后用无血清培养液继续培养48 h,获得BMSCs-CM。
1.4分组及干预方法将INS-1细胞分为A组、B组、C组,分别以BMSCs-CM、不含RPE的条件培养液、等量RPMI 1640培养液培养。
1.5BMSCs-CM对INS-1细胞增殖的影响观察采用MTT法。INS-1细胞接种于96孔板,每孔100 μL,5×103个/孔,培养24 h。各组处理同1.4。每组设5个复孔,培养44 h。吸去上清,加入新鲜RPMI 1640培养液80 μL,再加入MTT溶液,继续培养4 h。每孔加入二甲基亚砜溶解产物150 μL。在酶联免疫检测仪490 nm处测量各孔的吸光度值(OD),每组设定6复孔。细胞增殖率=(实验组平均OD值-对照孔平均OD值)/对照孔平均OD值×100%。
1.6BMSCs-CM对INS-1细胞凋亡的影响观察采用AnnexinⅤ/PI法。INS-1细胞培养于含10%FBS的RPMI 1640培养液的24孔板,约5×105/孔,培养24 h后,改为无血清的RPMI 1640培养液。各组处理同1.4。孵育24 h后,添加促凋亡细胞因子混合物(IL-1β 10 ng/mL、TNF-α 50 ng/mL及 IFN-γ 50 ng/mL)孵育18 h。收集细胞,重悬于195 μL结合液。加入Annexin V-FITC 5 μL,室温避光孵育10 min。加入结合液重悬细胞,碘化丙啶染色。荧光显微镜观察凋亡细胞,正常INS-1细胞不被荧光标记,早期凋亡细胞被Annexin V染色,镜下呈绿色;晚期凋亡细胞或坏死细胞被PI染色或同时被Annexin V及PI染色,镜下见细胞核呈红色,或细胞核的红色和细胞膜的绿色同时存在。随机选取6个视野,流式细胞仪计数早期凋亡细胞数、晚期凋亡数及凋亡细胞总数。细胞凋亡率=凋亡细胞总数/细胞总数×100%。
1.7BMSCs-CM对INS-1细胞胰岛素分泌的影响观察INS-1细胞培养于24孔板中,调整细胞数为5×104/L,孵育48 h。各组处理同1.4。温箱孵育48 h。每孔中加入葡萄糖溶液,调整终浓度分别为5.6 mmol/L及20.0 mmol/L,孵育4 h,取样500 μL,应用放射免疫法(RIA)测定胰岛素浓度。
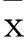
2结果
2.1BMSCs-CM对INS-1细胞增殖的影响A组细胞增殖率高于B组及C组(P均<0.05)。B组与C组细胞增殖率差异无统计学意义(P>0.05)。见表1。
2.2BMSCs-CM对INS-1细胞凋亡的影响 A组细胞凋亡率低于B组及C组(P均<0.05)。三组早期及晚期凋亡细胞数差异均无统计学意义(P均>0.05)。见表1。
2.3BMSCs-CM对INS-1细胞胰岛素分泌的影响在葡萄糖溶液终浓度为5.6 mmol/L及20.0 mmol/L时,A组胰岛素水平高于B组及C组(P均<0.05)。见表1。
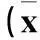
表1 三组细胞增殖率、凋亡率、凋亡细胞数及胰岛素水平比较±s)
注:与A组比较,*P<0.05。
3讨论
BMSCs在不同微环境下的调控下,可以分泌不同的细胞因子,这种效应被称为BMSCs旁分泌效应[7]。BMSCs分泌的多种细胞因子可通过作用于邻近细胞而发挥旁分泌作用,广泛参与细胞增殖、凋亡、免疫调节、血管再生等病理生理过程[8]。研究发现,低氧环境培养BMSCs后,培养液中多种具有心肌保护作用的细胞因子表达上调,表明BMSCs旁分泌效应可能发挥抑制心肌细胞的凋亡,促进其增殖的作用[9,10]。应用模拟胰腺微环境的RPE预处理后,BMSCs可以显著增加具有胰腺保护作用的细胞因子的分泌,也表明BMSCs旁分泌效应可能发挥修复胰腺的作用。由于BMSCs移植到糖尿病模型体内并不能分化为胰岛素分泌细胞、替代受损的胰岛细胞,因此考虑高血糖的缓解可能与BMSCs移植后通过旁分泌效应分泌多种降血糖细胞因子有关,进而促进内源性胰岛细胞增殖、抑制其凋亡。
胰岛β细胞数量的维持是β细胞增殖及凋亡的动态平衡。正常成年胰腺β细胞被认为是相对分化成熟的细胞,但被细胞因子激活后可出现增殖,这些细胞因子主要有胰岛素样生长因子(IGF-1)、肝细胞生长因子(HGF)、碱性成纤维细胞生长因子(bFGF)、VEGF等[11]。它们与细胞表面的受体相结合后,可发挥促进有丝分裂、促进细胞增殖、抑制细胞凋亡、修复损伤的作用。研究发现,应用IGF-1处理胰岛β细胞可以抑制细胞因子诱导的胰岛β细胞凋亡,减少NO的合成,促进胰岛细胞分泌胰岛素[12]。HGF可通过对抗氧化应激来减少游离脂肪酸诱导的RINm5F凋亡,对胰岛细胞具有促进增殖的作用[13]。bFGF及VEGF不仅对胰腺细胞具有促增殖作用,还可通过促进血管生成改善胰腺血供、促进胰腺修复[14,15]。本研究发现, A组增殖率高于B组及C组,提示应用REP制备的BMSCs-CM可促进INS-1细胞的增殖;A组细胞凋亡率低于B组及C组,提示BMSCs-CM可抑制IL-1β、TNF-α和IFN-γ诱导的INS-1细胞的凋亡;在葡萄糖溶液终浓度为5.6 mmol/L及20.0 mmol/L时,A组胰岛素水平均高于B组及C组,提示BMSCs-CM可促进INS-1细胞分泌胰岛素的能力,考虑以上效应均与BMSCs通过旁分泌效应分泌具有胰腺保护作用的细胞因子有关。
综上所述,BMSCs-CM培养INS-1细胞后可促进INS-1细胞的增殖、抑制其凋亡并促进其分泌胰岛素,BMSCs可能通过分泌多种胰腺保护细胞因子的旁分泌效应发挥以上作用,可能是移植BMSCs后逆转高血糖状态的重要机制。
参考文献:
[1] Aali E, Mirzamohammadi S, Ghaznavi H, et al. A comparative study of mesenchymal stem cell transplantation with its paracrine effect on control of hyperglycemia in type 1 diabetic rats[J]. J Diabetes Metab Disord, 2014,13(1):76.
[2] Gunasekaran U, Gannon M. Type 2 diabetes and the aging pancreatic beta cell[J]. Aging (Albany NY), 2011,3(6):565-575.
[3] Bell GI, Meschino MT, Hughes-Large JM, et al. Combinatorial human progenitor cell transplantation optimizes islet regeneration through secretion of paracrine factors[J]. Stem Cells Dev, 2012,21(11):1863-1876.
[4] 许聿新,井庆平.不同胰腺提取物对大鼠骨髓间充质干细胞分泌细胞因子的影响[J]. 山东医药,2015, 55(1):25-27.
[5] Benariba N, Bellakdhar W, Djaziri R, et al. Protective action of seed extracts against the deleterious effect of streptozotocin on both glucose-stimulated insulin release from rat pancreatic islets and glucose homeostasis[J]. Biomed Rep, 2013,1(1):119-121.
[6] Lee J, Han DJ, Kim SC. In vitro differentiation of human adipose tissue-derived stem cells into cells with pancreatic phenotype by regenerating pancreas extract[J]. Biochem Biophys Res Commun, 2008,375(4):547-551.
[7] Kono TM, Sims EK, Moss DR, et al. Human adipose-derived stromal/stem cells protect against STZ-induced hyperglycemia: analysis of hASC-derived paracrine effectors[J]. Stem Cells, 2014, 32(7):1831-1842.
[8] 杨媛媛, 周诺. 骨髓间充质干细胞作为组织工程种子细胞的研究进展[J]. 广西医学, 2010,25(5): 586-589.
[9] Sanina C, Hare JM, Mesenchymal stem cells as a biological drug for heart disease: where are we with cardiac cell-based therapy[J]. Circ Res, 2015,117(3): 229-233.
[10] Gnecchi M, Danieli P, Cervio E. Mesenchymal stem cell therapy for heart disease[J]. Vascul Pharmacol, 2012,57(1): 48-55.
[11] Dai C, Li Y, Yang J, et al. Hepatocyte growth factor preserves beta cell mass and mitigates hyperglycemia in streptozotocin-induced diabetic mice[J]. J Biol Chem, 2003,278(29):27080-27087.
[12] Gao X, Song L, Shen K, et al. Bone marrow mesenchymal stem cells promote the repair of islets from diabetic mice through paracrine actions[J]. Mol Cell Endocrinol, 2014,388(1-2): 41-50.
[13] Castrillo A, Bodelon OG, Bosca L. Inhibitory effect of IGF-I on type 2 nitric oxide synthase expression in Ins-1 cells and protection against activation-dependent apoptosis: involvement of phosphatidylinositol 3-kinase[J]. Diabetes, 2000,49(2):209-217.
[14] Santangelo C, Matarrese P, Masella R, et al. Hepatocyte growth factor protects rat RINm5F cell line against free fatty acid-induced apoptosis by counteracting oxidative stress[J]. J Mol Endocrinol, 2007,38(1-2):147-158.
[15] Hart AW, Baeza N, Apelqvist A,et al. Attenuation of FGF signalling in mouse beta-cells leads to diabetes[J]. Nature, 2000,408(6814):864-868.
Influence of paracrine effects of bone mesenchymal stem cells on proliferation,apoptosis and secretion function of pancreatic β cell line
XUYuxin,JINGQingping,ZHAOCuihong
(TheFirstHospitalofZibo,Zibo255200,China)
Abstract:ObjectiveTo investigate the influence of paracrine effects of bone mesenchymal stem cells (BMSCs) on the proliferation, apoptosis and insulin secretion of pancreatic β cell line INS-1 cells. MethodsThe BMSCs were cultured and BMSCs conditioned media (BMSCs-CM) were obtained by culturing BMSCs with rat pancreatic extracts (RPE) which simulated the pancreatic microenvironment. The INS-1 cells were divided into groups A, B and C, which were cultured with BMSCs-CM, conditioned media without RPE and RPMI 1640 culture solution, respectively. The influence of BMSCs-CM on INS-1 cell proliferation was analyzed by MTT. The cell proliferation rate was calculated. The effects of BMSCs-CM on the INS-1 cell apoptosis were measured by AnnexinⅤ/PI double staining. The rate of apoptosis was counted. The insulin concentration of INS-1 cells was analyzed by radioimmunoassay (RIA).ResultsThe cell proliferation rate in the group A was higher than that in group B and C (P<0.05). The apoptosis rate in the group A was lower than that in group B and C (P<0.05). The insulin concentration in the group A was higher than that in group B and C at the concentration of 5.6 mmol/L and 20.0 mmol/L (all P<0.05).ConclusionsThe incubation of BMSCs-CM can stimulate the INS-1 cell proliferation, inhibit the apoptosis, and promote the insulin secretion. The above actions of BMSCs may be achieved by paracrine effects.
Key words:stem cells, myeloid; pancreatic β cells; cytokines; apoptosis; proliferation
(收稿日期:2015-10-19)
中图分类号:R587.1
文献标志码:A
文章编号:1002-266X(2016)14-0001-03
doi:10.3969/j.issn.1002-266X.2016.14.001
通信作者简介:井庆平(1964-),男,本科,主治医师,主要研究方向为糖尿病慢性并发症的诊治。E-mail: jingqingping@sina.com
第一作者简介:许聿新(1978-),男,博士,主治医师,主要研究方向为糖尿病慢性并发症的诊治。E-mail: hongxin1978@sina.com
基金项目:山东省淄博市科学技术发展计划项目(2012GG01259)。
