PCR鉴定麻类纤维基因组DNA提取方法
2016-04-23保琦蓓尤建武任清庆傅科杰
保琦蓓,尤建武,钱 丹,任清庆,傅科杰
(1.宁波出入境检验检疫局纺织品检测中心,浙江宁波 315012 2.宁波检验检疫科学技术研究院,浙江宁波 315012)
PCR鉴定麻类纤维基因组DNA提取方法
保琦蓓1,2,尤建武1,钱丹1,任清庆1,傅科杰1,2
(1.宁波出入境检验检疫局纺织品检测中心,浙江宁波315012 2.宁波检验检疫科学技术研究院,浙江宁波315012)
摘要:以汉麻原麻韧皮纤维与汉麻纤维两组特殊样品为材料,比较了传统的CTAB法、试剂盒粗提法及磁珠纯化精提法DNA提取方法对提取此类样品的适宜性。结果表明,采用试剂盒粗提法可从汉麻原麻纤维中提取高品质的可用于下一步PCR检测的DNA样本,而麻类纤维的处理工艺对其DNA的影响很大,随着麻类纤维从原麻被加工为精干麻、纱线与织物的过程中,已很难提出高品质DNA样品,虽然存在一定量的DNA,但通过完整性检测发现这类DNA样品已无法满足下一步的PCR鉴定检测的要求。
关键词:麻类纤维;基因组DNA;提取;PCR检测
0 引言
在纤维检测领域,DNA检测技术在天然动物纤维鉴别中已得到广泛应用,研究人员已完成了传统的光学投影仪法。燃烧法与化学溶解法无法完成羊绒与羊毛纤维的鉴别,以及对羊毛、羊绒、骆驼毛与牦牛毛之间快速简便的纤维定性分析[1]。目前国外对羊毛羊绒纤维的分析已从定性分析发展到两组分混纺纤维的定量分析,可用于有实验条件的纺织检测机构进行相应纤维成分的辅助检测[2],而国内将DNA检测技术应用于天然植物纤维的鉴定方面的研究较少,且对麻类植物的分子生物学研究主要集中在改良遗传育种方面。国外采用分子生物学方法对麻类纤维进行鉴定的相关方面研究目前主要集中在公安刑侦与考古学中的纤维鉴定应用方面。
研究和开发麻类纤维的DNA检测技术,关键技术难点在于DNA的提取。一般新鲜叶片提取的DNA品质最高,可基本满足各种测试需求。而麻类植物韧皮纤维中含有大量的多糖、酚类等次生代谢物质,细胞壁厚破壁较难,尤其是多糖易与DNA结合形成极难溶解的黏稠状物质,并抑制PCR反应过程中Taq DNA酶的活性,使扩增的条带模糊甚至消失,严重影响PCR的反应效果[3]。大多数的试验都采用麻类植物幼嫩叶片为材料进行提取,但作为纺织材料的韧皮纤维作物,经过收获、剥制、干燥等过程得到原麻,再经脱胶得到精干麻,得到的麻纤维可用于纺纱与织造。若对各种麻类进行DNA检测,必须首先考虑对纤维中的DNA进行提取。美国研究者Mignon Dunbarden利用PCR片段中的碱基对序列分析或限制性内切酶分析成功鉴别了麻质绳索中的汉麻、剑麻与亚麻纤维的成分,扩增后的PCR片段可达到771碱基对长度[4]。Terence M.Murphya等人利用DNA技术从以色列汲沦谷的犹太人墓穴中发现的麻类织物中鉴定出其成分主要为亚麻,所有样品中均存在少量或微量的汉麻DNA分子,此研究仅利用短片段物种特异性PCR来进行鉴定[5]。候思名等通过优化后的CTAB法,在提取的过程中通过抗氧化和去除多糖的方法成功提取了苎麻幼嫩叶片中的DNA[6]。而陈平等以常温干燥保存一年和六年的陈年苎麻原麻为原材料,也采用改进的CTAB法提取了苎麻原麻中的DNA,得到的DNA约为20 kb[3]。裴黎采用改良高盐低pH方法方法成功提取了陈旧汉麻干叶标本及汉麻树脂中的基因组DNA,并成功提取了一份22年陈旧汉麻树脂的基因组DNA,使其可以用于法庭科学中陈旧汉麻基因组DNA的提取[7]。
作为纺织材料的韧皮纤维作物,麻纤维也会根据生产的需要可能会存放相当长一段时间,再经过收获、剥制、干燥等过程得到原麻,原麻经脱胶后得到精干麻,再用于纺纱与织造。要对各种麻类进行DNA检测,首要问题也是纤维中的DNA提取。本研究中选取了两组特殊样品进行麻类纤维基因组提取方法的优化,希望找到适合麻纤维DNA提取的方法。
1 试验
1.1试验材料
试验采用的样品类型分为两组,第一组为不同存放时间的汉麻原麻韧皮纤维,第二组为根据汉麻纤维的生产工艺流程处于各个生产阶段的纤维产品。同时选择棉花样品作为对照,选择一种存放期约为1年的苎麻纤维来验证优化后的提取方法。样品具体信息见表1。
1.2提取试验方法
采用传统的CTAB法与试剂盒法提取法两种方法进行提取方法的优化,其中试剂盒提取法又分别考察了粗提方法与后续的磁珠纯化精提方法对提取DNA质量的影响。试验开始前均先取一定量的样本于离心管中,加入无菌水在4℃下浸泡2 h。
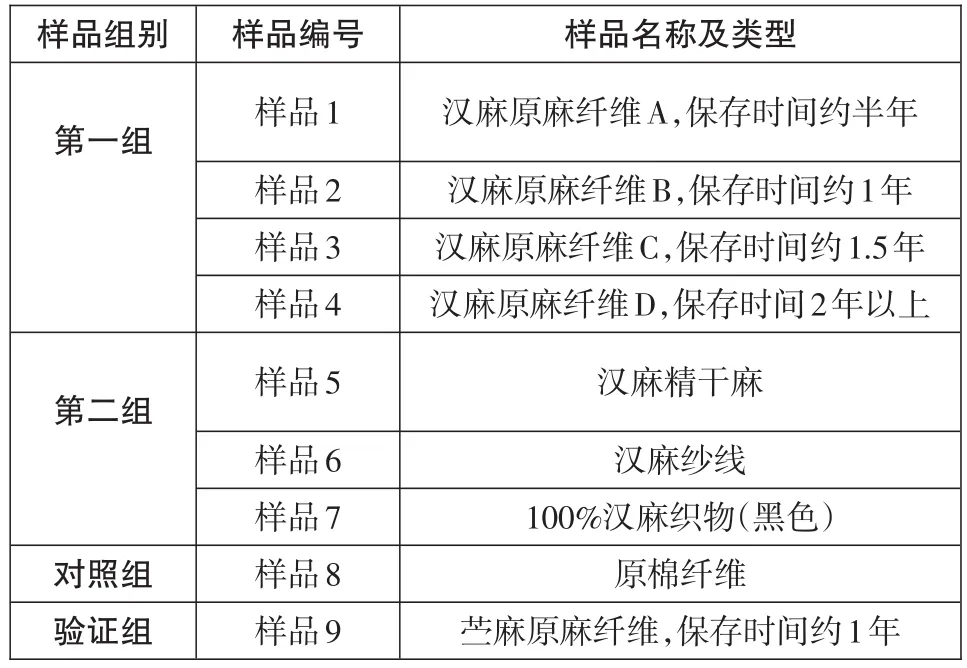
表1 样品信息表
(1)CTAB法
分别选取样品1~8号约1.0 g,在研钵中加入液氮预冷,将叶片放入液氮中研磨均匀,直至全部研磨至粉末,转入1.5 mL离心管中,加入600 μL 65℃预热的CTAB溶液(用前加入2%的巯基乙醇)。将装有CTAB和样品的EP管置入65℃水浴,约1 h。冷却后,加入600 μL的酚:氯仿:异戊醇(25:24∶1= 300∶288∶12),混匀,12 000 rpm,离心15 min。吸取上清液,置入空EP管,加入600 μL氯仿:异戊醇(24∶1=576∶24),12 000 rpm。离心15 min,吸取上清液转入空离心管中,加入1/3体积NaAc(3moL/L),加入1 mL-20℃预冷的无水乙醇,混匀后置于-20℃下3~4 h,然后于12 000 rpm离心10 min,弃去上清液,向离心管中加入75%的乙醇洗涤2~3次,置于吸水纸上倒置晾干。使用时加入ddH2O(10~20 μL)溶解备用。
(2)试剂盒提取方法
a.组织破碎:浸泡后的样本在加液氮的条件下在研钵中捣成粉末,并将粉末装入2 mL离心管中(研磨时应间隔加入液氮以防止组织融化)。加入1 mL Plant DNA zol(货号116901)试剂盒试剂,将离心管置入65℃水浴15 min。
b.DNA沉淀:加1mL氯仿,混合均匀。12000rpm,离心5 min。小心取上清(DNA在上层,试验要求为纯DNA),移入空的1.5 mL离心管中,加0.7体积的异丙醇,4℃下12 000rpm离心10 min,弃上清,12 000 rpm,离心5 min,弃上清。
c.DNA清洗:加入1 mL 75%乙醇至离心管中,颠倒数次以重悬DNA,直立离心管1 min至DNA团块沉至管底,倾去或吸除洗涤液。细小的DNA沉淀团块易在倾倒洗涤液时丢失,可室温3 000 xg离心3~5 min,然后倾去或吸除洗涤液,重复清洗1次,最后简短离心,用枪头小心吸弃残留液体。
d.DNA溶解:室温静置约10 min,使残余乙醇挥发,注意不要完全晾干DNA,加入适量(100 μL)灭菌双蒸水或TE缓冲液,使DNA沉淀溶解。若DNA溶液中存在不可溶杂质,可于4℃12 000rpm,离心10 min去除杂质,并在4℃或-20℃保存DNA溶液(此处得到的为粗提物产物)。
e.DNA纯化:取50 μL的粗提DNA转入新的1.5 mL离心管中,充分涡旋振荡AMPure XP beads(货号A63882),加入90 μL充分悬浮好的AMPure XP beads于上述离心管中,吸打或涡旋振荡混匀,室温放置5 min,然后将上述离心管放置于磁力架上至少2 min,弃上清,保持1.5 mL的离心管在磁力架上,加入200 μL新鲜配制的80%乙醇,室温保持30 s,弃上清。重复上述2个步骤,室温干燥10 min(磁珠出现裂痕即为干燥完全),加入52.5 μL的Re⁃suspension Buffer于上述离心管中,吸打或涡旋振荡混匀,室温保持2 min,离心管放置于磁力架上放置至少5 min,吸取50 μL的上清于空的1.5 mL离心管中,得到的产物为精提物产物。
1.3提取结果评价
各样品DNA提取后,测定OD260与OD280值,计算DNA的产量,同时通过Qubit荧光计定量测定提取的DNA浓度,用1%浓度的琼脂糖凝胶电泳检测DNA的完整性,通过上述参数选择最优的提取方法,最后选择符合质量要求的DNA进行PCR扩增试验,验证DNA的完整性。第1组引物组为汉麻的特征引物,其序列为上游引物5ˊ-ATC⁃GAAGAGCAGCAACAAGC-3ˊ,下游产物5ˊ-ATCGAAGAGCAGCAACAAGC-3ˊ;第2组引物组为苎麻的特征引物,其序列为上游引物5ˊ-TC⁃CAAGCATTTCCCGAACGA-3ˊ,下游产物5ˊ-GCCCGATCTTCCAGCTCTAC-3ˊ;第3组引物组为亚麻的特征引物,其序列为上游引物5ˊ-TCAT⁃CAACAGCGCATCTGGT-3ˊ,下游产物5ˊ-AGCCTTACAGCCACACACTC-3ˊ。对试剂盒方法的粗提法与精提法提取DNA样品进行扩增,对DNA样品的质量进行进一步评价。采用PCR扩增的反应体系为25 μL PCR反应体系包括麻类纤维样品基因组DNA20 ng,2×Premix Taq缓冲液12.5 μL,5 μM上、下游引物各1 μL,Premix Taq DNA聚合酶(Code No.RR003Q),余量为ddH2O。PCR的扩增程序:95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸45 s,27个循环;72℃延伸10 min,10℃保存。
2 结果与讨论
2.1不同提取方法下DNA产量、浓度与完整性
根据1.2的提取方法,对选取的样品进行的基因组DNA的提取,所测OD260/OD280值与浓度的数值结果见表2。从表2可以看出,无论是OD260/OD280值指标还是提取的浓度大小,试剂盒的提取方法优于传统的CTAB法,特别是在提取DNA的浓度上,试剂盒法对较为新鲜的纤维样品的提取浓度高出CTAB法10倍。由于精提法是DNA初提之后的进一步提纯,因此提取的DNA浓度有所降低,但是DNA的质量需要通过电泳方法进行进一步确认。

表2 不同提取方法下DNA的OD260/OD280值与浓度
为了考察试剂盒粗提法与精提法两种处理方法提取的DNA的完整性,为进一步评价提取效果提供依据,试验中采用1%琼脂凝胶电泳对提取的DNA进行检测。将提取的DNA样品在冰上融化后,充分混匀并离心,取适量样品进行检测,采用1%浓度的琼脂糖凝胶在5 V/cm下移动30 min,得到的检测结果见图1。

图1 DNA样品的1%琼脂凝胶电泳图
由图1可以看出,试剂盒粗提法与精提法提取DNA样品的完整性并无太大区别,在提取的DNA浓度的量可供下一步试验使用时,采用粗提方式提取的DNA样品也能够满足下一步的检测要求,可以节约大量的人力和物力。另外,从图1中还可以看出,麻类的原麻纤维样品(样品1~样品4)随着存放时间的增加DNA在发生降解,一般存放超过1年以上对提取DNA的质量影响最大,但即使存放时间在2年以上也可采用本试验的方法提取出可用于PCR检测的DNA样品,但麻类纤维的处理工艺对麻类纤维(样品5~样品7)中DNA的影响很大,随着麻类纤维从原麻被依次加工为精干麻、纱线与织物的过程中,几乎很难提取出高品质DNA样品,虽然其中存在一定量的DNA,但通过完整性检测发现,这类DNA样品已无法满足下一步PCR鉴定检测的要求。
2.2提取DNA的PCR鉴定检测
采用第1组引物组汉麻特征引物对粗提物与精提物的扩增检测结果见图2,条带1~11为粗提物扩增结果,条带12~22为精提物扩增结果。采用汉麻的特征是因为都能对不同存放时间的汉麻原麻纤维(样品1~样品4)进行特异扩增,扩增后条带为100~200 bp。此组引物并不能对(样品5~样品9)样品进行特异性扩增,可以用来鉴定汉麻纤维。

图2 汉麻特征引物对粗提物与精提物扩增检测结果
采用第2组引物组苎麻特征引物对粗提物与精提物的扩增检测结果见图3,条带23~33为粗提物扩增结果。由图3还可以看出,采用苎麻的特征条带可以对存放时间约1年的苎麻纤维进行扩增,条带为200~300bp,采用此组苎麻的特征引物均不能对不同存放时间的汉麻原麻纤维(样品1~样品4)与其他汉麻产品(样品4~样品7)进行特异扩增。

图3 苎麻特征引物对粗提物与精提物扩增检测结果
采用第3组引物组亚麻特征引物对粗提物与精提物的扩增检测结果见图4,条带45~55为粗提物扩增结果,条带56~66为精提物扩增结果。由图4还可以看出,采用亚麻的特征条带对所有样品均不能扩增出亚麻的特征产物,与预期结果相一致。

图4 亚麻特征引物对粗提物与精提物扩增检测结果
3 结论
通过对各组特殊麻类纤维样品的DNA提取方法进行优化,发现采用试剂盒提取方法比传统CTAB法提取DNA的品质高,且试剂盒粗提法与精提法提取DNA样品的浓度和完整性并无太大区别。在提取DNA浓度的量可供下一步试验使用时,采用粗提方式提取的DNA样品也能够满足下一步的检测要求,可以节约大量的人力和物力。研究发现,麻类的原麻纤维样品随着存放时间的增加DNA在发生降解,一般存放超过1年以上对提取DNA的质量影响最大,但即使存放时间在2年以上也能采用本试验的方法提取出能用于PCR检测的DNA样品。然而麻类纤维的处理工艺对麻类纤维中DNA的影响很大,随着麻类纤维从原麻被依次加工成精干麻、纱线与织物的过程中,几乎很难提出高品质的DNA样品。虽然存在一定量的DNA,但通过完整性检测发现这类DNA样品已无法满足下一步的PCR鉴定检测的要求。
参考文献:
[1]费静,唐敏峰,杨娟等.DNA检测技术在天然动物纤维鉴别中的应用[J].纺织导报,2012,5:90-91.
[2]董晓东,杨素英,丁楠等.DNA分析技术在动物纤维鉴别领域的研究进展[J].中国纤检,2015,17:70-72.
[3]陈平,谭龙涛,喻春明等.一种适用于PCR检测的苎麻成年原麻DNA提取方法[J].中国麻业科学,2012,34(6):249-251.
[4] D Mignon,TM Murphy.DNA analysis of natural fiber rope [J].Jour⁃nal of Forensic Sciences,2009,54(1):108-113.
[5] Terence M.Murphy,Nahum Ben-Yehuda,R.E.Taylar,et al..Hemp in ancient rope and fabric from the Christmas Cave in Israel: Tal⁃mudic background and DNA sequence identification[J].Journal of ar⁃chaeological science,2011,38:2579-2588.
[6]侯思名,段继强,梁雪妮等.苎麻总DNA提取的CTAB法优化方案[J].西北植物学报,2005,25(11):2193-2197.
[7]裴黎.毒品原植物大麻DNA检测技术的研究[D].河北医科大学,2007.
《纺织检测与标准》杂志专家委员会会议顺利召开
2016年1月5日下午,《纺织检测与标准》杂志专家研讨会在上海市纺织科学研究院顺利举行,来自于检测标准领域的各位大咖级专家委员会成员悉数到场,编辑部全体成员享用了一场行业领域的盛宴。
首先,编辑部对于杂志的创刊背景和创刊设想进行了详细的阐述,并对杂志的具体栏目做了介绍。随后,专家们对杂志未来的发展方向、栏目内容的设定、杂志平台的运行提出了宝贵的意见和建议。其中主任委员、中国工程院院士俞建勇对于杂志的创办进行了充分的肯定,并强调称,在纺织服装业中检测标准有着关键的作用,随着纺织行业的多元化、绿色生态方面的发展,标准检测方面也需要实时更新,以顺应时代的发展,希望杂志能够在国际化、市场化、产业升级、生态性及技术升级方面能够起到引领作用,杂志整体内容呈现全面的基础上,努力形成杂志专业特色。
解德诚院长总结时表示,自杂志创刊伊始即对其倾注殷切希望,目前在纺织制造工业加工总量稳定的大势下,若能把标准、检测方法与市场需求有效地结合,就会看到一个巨大的市场。同时希望《纺织检测与标准》杂志越办越好,成为标准检测领域内获取信息的重要渠道以及专业人士经验共享的重要载体。
检测技术
Optimized method of extracting genomic DNA in hemp and ramie bast fiber for PCR detecting
Bao Qi-bei1,2,You Jian-wu1,Qian Dan1,Ren Qing-qing1,Fu Ke-jie1,2
(1.Ningbo Entry-Exit Inspection and Quarantine Bureau,Textile testing center,Zhejiang 315012,China; 2.Ningbo Academy of Science & Technology for Inspection & Quarantine,Zhejiang 315012,China)
Abstract:Two special sample groups including hemp bast fibers and hemp fiber were used as material,the effects of traditional CTAB,kit crude extraction and beads purification DNA extraction on extraction were compared.The results showed that the extracted DNA samples by kit crude extraction from hemp bast fiber could be used directly for PCR detecting.The treatment process of hemp fiber greatly impact the DNA quality in the fiber.With hemp fiber from raw jute to yarn and fabric,it was difficult to extract high-quality DNA sample.Although a certain amount of DNA can be extracted in these samples,the DNA sample could not be directly used for PCR detecting.
Key words:bast fiber,genomic DNA,extraction,PCR detecting
作者简介:保琦蓓(1982-),女,博士,工程师,E-mail:baoqibei@126.com,主要研究方向为生态纺织品检测与研究。
项目基金:国家质检总局科技计划项目(2014IK178),浙江省自然科学基金(LQ13B070003)
收稿日期:2015-11-01
中图分类号:TS107
文献标识码:A
文章编号:1001-7046(2016)01-0007-05
