激光微孔脱细胞猪真皮支架对Ⅲ度皮肤烧伤血管化的影响
2016-04-21盛小辉朱宝昌冯世海于维陆天津医科大学研究生院天津00070天津市第四医院烧伤科天津00天津市托福医用原子能科技有限公司天津009
盛小辉,朱宝昌,冯世海,刘 群,于维陆(.天津医科大学研究生院,天津 00070;.天津市第四医院烧伤科,天津 00;.天津市托福医用原子能科技有限公司,天津 009)
激光微孔脱细胞猪真皮支架对Ⅲ度皮肤烧伤血管化的影响
盛小辉1,朱宝昌1,冯世海2,刘群2,于维陆3
(1.天津医科大学研究生院,天津300070;2.天津市第四医院烧伤科,天津300222;3.天津市托福医用原子能科技有限公司,天津300192)
摘要目的:探讨新的脱细胞方法配合激光打孔制备的激光微孔脱细胞猪真皮支架对大鼠Ⅲ度皮肤烧伤创面血管化的影响。方法:将激光微孔脱细胞猪真皮(A组)、普通打孔脱细胞猪真皮(B组)两种真皮支架分别移植至Ⅲ度皮肤烧伤清创后创面,另设无真皮支架对照创面(C组),1周后加植表皮。大体观察植入真皮支架1、2、3周创面的修复情况,并通过HE染色和免疫组化标记创面中CD31、α-SMA表达阳性血管并计数。结果:制备的脱细胞猪真皮呈瓷白色,有光泽,柔软;显微镜下未见细胞残留。加植表皮后,A组较B组存活率高。两组支架植入后及无支架对照组1~3周创面中CD31、α-SMA表达阳性血管数持续增加,其中两组真皮支架均较无支架组多,差异有统计学意义(P<0.05);A组显著高于B、C组(P<0.05)。结论:该方法制备的激光微孔脱细胞猪真皮基质能快速血管化,提高表皮存活率,为一种较理想的真皮替代物。
关键词真皮替代物;脱细胞真皮,猪;微孔;皮肤移植;烧伤;大鼠
Effectoflasermicroporeporcineacellulardemalmatrixonvascularizationofwoundswithfull-thicknessburn
SHENG Xiao-hui1,ZHU Bao-chang1,FENG Shi-hai2,LIU Qun2,YU Wei-lu3
(1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.Department of Burn,The Fourth Hospital of Tianjin,Tianjin 300222,China;3.Tianjin Toefl Medical Atomic Energy Technology Co.,Ltd,Tianjin 300192,China)
Abstract Objective:To explore the influence of the new method-laser micropore porcine acellular demal matrix in vascularization of wounds in rats with full-thickness burn.Methods:Laser micropore porcine acellular demal matrix(A group)and porcine acellular demal matrix(B group)were respectively transplanted on the rats with full-thickness burn after wound debridement,and there were no dermal in the control group(C group).Then skin was transplanted into the rats of the three groups one week later.The reparation of dermal implant wound was recorded after 1,2 and 3 weeks respectively.At the same time,CD31,α-SMA positive signals detected by immunohistochemical staining and HE staining were used to observe the effect of repairation.Results:The well-prepared laser microspore porcine acellular dermal matrix was characterized by its porcelain white color,softness and good elasticity.Histological examination revealed that laser microspore porcine acellular dermal matrix was totally devoid of epidermis and cellular components.Group A had higher survival rate than group B.From 1th to 3th week,the number of vessels with CD31 and α-SMA expression were continuously increased in the three groups.The number of vessels with CD31 and α-SMA expression in group A and B were significantly higher than in group C(P<0.05).The difference was statistically significant(P<0.05).Conclusion:Laser microspore porcine acellular demal matrix can be used as an ideal dermal substitute due to its ability of initiating revascularization rapidly which may increase the survival rate of the grafted skin.
Key words dermal substitutes;acellular dermal matrix;microporous;skin transplantation;burns;rat
大面积烧伤患者创面多需要进行自体皮肤移植才能修复,但是由于患者的供皮区有限,用皮肤替代物覆盖创面用以保护和促进创面的愈合已成为迫切需要。近年来,异种(猪)脱细胞真皮基质在临床得到了广泛地推广应用[1]。目前表皮分离和去除真皮细胞成分的方法有酶消化法、化学去污剂、高渗盐水法及戊二醛等法,物理的方法对支架结构的破坏较小但脱细胞效果较差,而化学方法脱细胞效果较好却容易破坏细胞结构,且一些化学试剂的残留可能导致一些不良反应,妨碍细胞生长,影响应用效果。我们在前人脱细胞方法的基础上进行改进,并配合激光打孔技术制备的激光微孔脱细胞猪真皮,移植入大鼠Ⅲ度烧伤模型,观察血管化过程及组织学改变,为临床提供理论和实验依据。
1 材料与方法
1.1材料
1.1.1实验动物72只质量300g左右雄性无病原体级SD大鼠(北京维通利华实验动物技术有限公司)。
1.1.2主要仪器及实验材料恒温振荡器(上海医疗器械厂);-80℃冰箱(安徽中科都菱);0.5%戊二醛水溶液;胰蛋白酶(美国Sigma公司),0.1%新洁尔灭;二氧化碳激光加工机(天津物理激光研究所)。脱细胞(猪)真皮,制作方法见下。试剂:CD31单克隆抗体(美国Abbiotec公司),α-SMA单克隆抗体(英国Abcam公司),生物素-链霉亲和素-过氧化物酶(SP)免疫组织化学检测试剂盒(美国Zymed公司)。
1.1.3激光微孔脱细胞真皮的制作新鲜无疫猪皮8块(天津市托福医用原子能科技有限公司提供),每块约10 cm×20 cm,洗净、剃毛,置于体积分数0.1%新洁尔灭溶液内浸泡15 min。在无菌条件下用取皮鼓切取厚度0.4 mm的断层皮片,将获得的断层真皮片即真皮基质随机分成两部分,一部分打孔:采用悬空法激光打孔技术,打孔时真皮基质不直接接触台面,以l mm为孔间隙,在悬空固定的真皮基质材料上行均匀贯穿性打孔,从而获得一种新型激光微孔化真皮基质;一部分断层真皮基质不打孔。两组皮片在含青霉素、链霉素各1 g/L的等渗盐水中浸泡1 h。将断层皮片浸入0.4 g/L胰蛋白酶溶液中20℃消化2 h。无菌条件下揭去表皮,将真皮在磷酸盐缓冲液(PBS)中持续振荡洗涤,去除已分离的细胞;再用同样浓度的胰蛋白酶37℃下消化1 h,PBS洗涤后取标本行组织学观察。将皮片分别置于4℃预冷、-70℃冷冻2 h、37℃下融化,如此反复冻融3次,PBS充分洗涤后,置入含青霉素、链霉素各1 g/L的PBS中浸泡2 h,再用PBS洗涤2次,将其置于无菌培养瓶中,封口,60Co照射杀菌,-18℃冰箱冷藏保存备用(冻融脱细胞激光微孔异种真皮基质制备方法及其产品专利号:ZL201110150545.7)。
1.2方法
1.2.1动物模型的制作及实验方法SD大鼠以10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,俯卧位固定,背部脱毛,在背部制备1个3 cm×3 cmⅢ度皮肤烧伤创面[2],常规清创后用碘伏纱布包扎,每日换药1次。伤后48 h内行创面切痂,切痂直径为(3.10± 0.05)cm,切痂彻底止血后将真皮基质缝合于创面,留长线打包备用。72只大鼠根据创面覆盖物的不同分为以下3组,每组24只:A组予以激光微孔脱细胞(猪)真皮、B组予以普通打孔脱细胞(猪)真皮、C组暂以油纱覆盖。于真皮覆盖1周后揭开油纱,观察各组大鼠创面大体情况,并加植表皮,取创面组织固定、包埋。加植表皮方法:避开烧伤创面剔毛后切取背部全层皮肤,剪成0.6 cm×0.6 cm大小置于4 g/L胰蛋白酶4℃消化过夜后镊子分离获得表皮,于支架或者油纱覆盖后1、2周打开敷料,将表皮植入3组创面上,加压固定。
1.2.2创面及对照创面的取材A、B、C 3组均在支架移植术后1、2、3周时,每组取8只大鼠的创面打开内层敷料,观察创面,在创面中间切取1 cm×0.5 cm深至肌层的组织块。同样对1、2、3周时对照组创面进行观察和取材。HE染色后进行组织学观察。
1.2.3创面免疫组织化学检测按SP免疫组化试剂盒说明书检测CD31、α-SMA表达情况。CD31、α-SMA一抗稀释浓度分别为1∶100和1∶50,实验阴性对照用磷酸盐缓冲液代替一抗。CD31阳性信号为红色,主要由血管内皮细胞表达,镜下着红色的单个或相邻2个细胞以及环状物均视为1条阳性血管;α-SMA阳性信号为棕色或黄色,主要在血管中层表达,镜下每个黄色或棕色环状物视为1条阳性血管,黄色或棕色点状物可能为肌成纤维细胞不计入内。不同时间点实验和对照组,每例组织切片于400倍光镜下随机观察10个视野的阳性信号计数,取平均值作为单个样本检测值。
2 结果
2.1脱细胞猪真皮支架性状实验制备的脱细胞猪真皮支架呈瓷白色,有光泽,柔软,弹性和韧性佳,剪切方便,未见明显皱缩。组织学检测无表皮,真皮内无任何细胞成分、皮肤附件及血管,胶原结构完整,未见断裂(图1)。
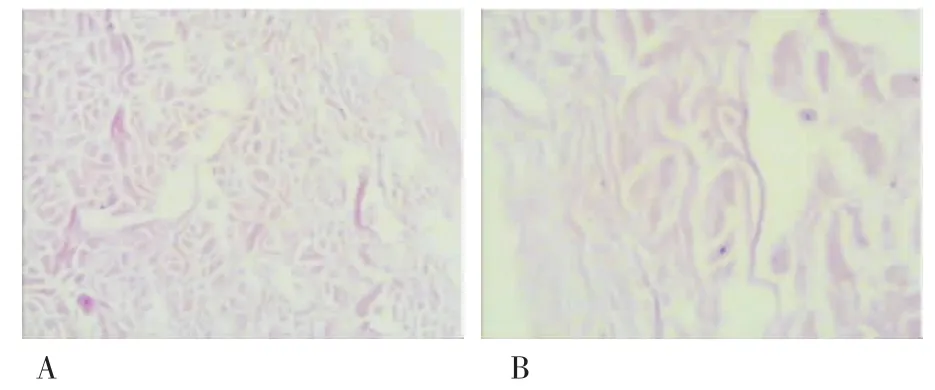
图1 脱细胞猪真皮胶原结构完整,无断裂(A.HE×100,B.HE×400)Fig 1 Porcine acellular dermal collagen was intact and without fractrue(A.HE×100,B.HE×400)
2.2创面基本情况及切片组织学观察
2.2.1 A组:术后1周大体观察真皮基质红润,创面无分泌物,与基底部结合紧密;组织学观察显示:真皮基质与基底创面未完全结合,自基底长出新生组织,支架与创面结合部位可见少量炎性细胞浸润,微孔周围的胶原有较多的成纤维细胞,内含多个红细胞征象,创面内可见新生血管形成。术后第2周:A组创面皮片融合,皮片生长情况好;组织学观察显示:支架与创面完全结合,支架内全层可见大量炎性细胞浸润,但表面无明显血管形成的支架层仍较厚,创面内可见较多的新生血管。术后3周:A组皮片融合成片,皮片生长情况好,支架已与创面完全结合,但仍可见其分界,支架表层可见血管形成,创面内可见较多垂直于创面生长血管。
2.2.2 B组:术后1周真皮基质红润,无分泌物;组织学显示真皮基质与基底创面未完全结合,支架与创面结合部位可见少量炎性细胞浸润,创面内新生血管形成较A组少。术后2周,少量表皮皮片存活,取标本见基底部结合松散易揭下并见少许分泌物,组织学观察显示支架与创面基底结合松散。术后3周皮片发黑坏死,有较多的分泌物。
2.2.3 C组:术后1周可见肉芽组织生长;术后2周皮片存活,凹陷不平坦;术后3周皮片有瘢痕形成。
2.3同支架植入创面及对照创面CD31、α-SMA免疫组化实验结果移植后1~3周,A、B组创面CD31、α-SMA表达阳性的血管数均明显多于C组,A组明显多于B组,B组明显多于C组;各组不同观察时间点2周均明显多于1周,3周明显多于2周,差异均具有统计学意义(P<0.05),见表l、2,图2~5。
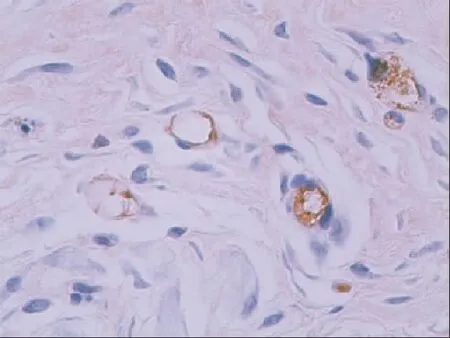
图2 激光微孔脱细胞猪真皮植入3周后CD31表达(IHC×100)Fig 2 Positive signals(red)of CD31expressedinwoundin3weeks afterthe lasermicrosporeporcineacellulardermalmatrix (IHC×100)

图3 普通打孔脱细胞猪真皮植入3周后CD31表达(IHC×100)Fig 3 Positive signals(red)of CD31 expressed in wound in 3 weeks after the porcine acellular dermal matrix(IHC×100)
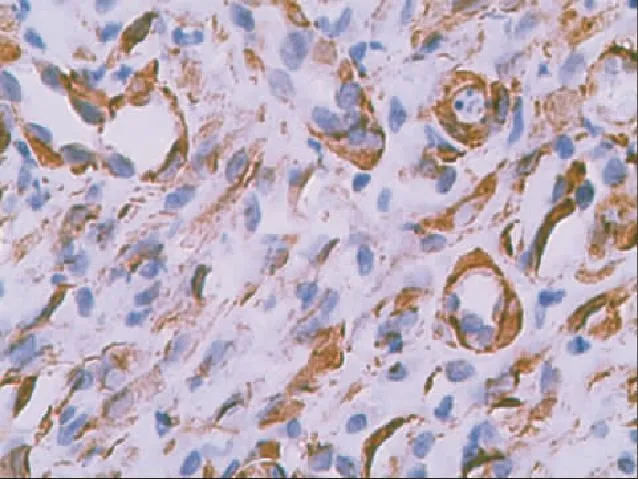
图4 激光微孔脱细胞猪真皮植入3周后α-SMA表达(IHC×100)Fig4 Positivesignals(brown)of CD31expressedinwoundin3weeks after the laser microspore porcine acellular dermal matrix (IHC×100)
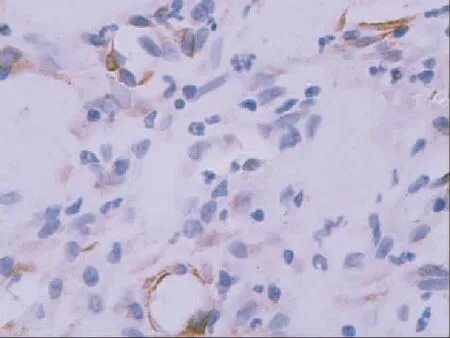
图5 普通打孔脱细胞猪真皮植入3周后α-SMA表达(IHC×100)Fig 5 Positivesignals(brown)of CD31expressedinwoundin3weeks after the porcine acellular dermal matrix(IHC×100)

表1 各组创面CD31阳性血管数比较(条)Tab 1 Comparison of CD31 positive blood vessels in each group

表2 各组创面α-SMA阳性血管数比较(条)Tab 2 Comparison of α-SMA positive blood vessels in each group
3 讨论
皮肤移植是救治大面积烧伤、创伤和后期整形的重要措施,对于大面积深度烧伤创面而言,切削痂后采用大张异体皮加微粒自体皮(或嵌入小块自体皮)覆盖可使创面尽早封闭。然而异体皮来源困难且价格昂贵,又有传播疾病的可能性[3]。寻找一种理想的皮肤替代物一直是临床上一个亟待解决的难题。国内外在真皮替代物方面开展了大量研究,并且已生产出人工真皮,如Integra、Dermagraft和Apligraf等[4]成品,这些皮肤替代物在临床上的应用取得了一定的效果,但是其价格昂贵,限制了其应用。由于猪皮肤与人类有着相似的结构,特别是两者真皮基质胶原成分和含量相似,而且来源广泛、成本低廉,因此猪脱细胞真皮基质可成为人类真皮缺损的理想替代物。近几年来异种脱细胞(猪)真皮基质在临床得到了推广应用[5-6]。
目前脱细胞真皮基质的制备方法较多,无论何种方法,最佳的处理应该是能够达到去除真皮内所有的细胞成分而最大限度保留真皮内胶原结构等的完整性。我们在总结传统脱细胞方法的优缺点及先期的研究基础上进行了创新性研究,在脱细胞之前先采用激光打微孔,其优点是减少了热量作用于真皮组织所致的损伤;将打孔后的中厚皮反复冻融3次,配合胰蛋白酶进一步消化残存的细胞,可减少反复冻融的次数,超声振荡可脱去已被破坏、死亡细胞及细胞碎片;本制备方法减轻了其他方法对真皮结构的损伤,能脱去有抗原性的细胞成分,保留异种皮中胶原的完整性。梁黎明等[7]在猪脱细胞真皮基质的加工过程中引入激光打孔技术,在真皮基质上制作出均匀密布的微孔,以利于组织间液渗透和微血管再生,从而提高复合皮移植成活率,改善创面愈合质量。其研究对孔间距做了专门探讨,认为孔间距为1.0 mm的激光微孔脱细胞(猪)真皮与自体刃厚皮复合移植效果最佳。
血管化速度是影响组织工程皮肤的主要因素[8],决定了表皮移植的成功率和成活速度[9]。新生组织中的血管,可以为胶原网架中迁入的成纤维细胞提供足够的氧气等营养物质,从而为真皮的修复和重建提供良好的微环境[10]。CD31是一种跨膜蛋白,为血管内皮细胞的特异性表面标志[11],常用于评价新生血管。如血管成熟,血管内皮细胞周围会有平滑肌细胞环绕,α-SMA能特异性标记平滑肌细胞[12],因此可用来判断新生血管成熟度,且为成熟血管的一种标志。本实验采用CD31和α-SMA免疫组化染色法观察创面血管化情况。结果表明,不同脱细胞(猪)真皮支架组和油纱对照组处理后1~3周,创面新生血管和成熟血管均持续增多,其中以激光微孔脱细胞(猪)真皮组最多、普通打孔脱细胞(猪)真皮组次之、油纱对照组最少。由此可见2种脱细胞(猪)真皮支架均可诱导新生血管的产生及其成熟,以激光微孔脱细胞(猪)真皮支架效果尤为明显。创面大体观察和HE染色结果也支持这一结论。支架内新生血管不能及时到达支架的表层,可使支架表面移植的表皮不能成活,同时也说明支架表面移植表皮的成活依赖于支架的血管化水平[13]。
综上所述,本研究研制的激光微孔脱细胞(猪)真皮基质能快速血管化和促进表皮成活,提高复合皮移植成功率,可较好较快地修复皮肤Ⅲ度烧伤创面,其在烧伤皮肤移植及组织工程皮肤构建中有良好应用前景。
参考文献:
[1]柴家科,杨红明,李利根,等.去细胞异体真皮、去细胞猪真皮和自体刃厚皮移植在临床中的应用[J].中华外科杂志,2000,38(10):790
[2]吴志谷,耿淼,付小兵,等.小面积标准烫伤仪的实验应用[J].中国临床康复,2002,6(20):3033
[3]陈晓东,施彦,杨荣华,等.异种(猪)脱细胞真皮基质对大鼠深Ⅱ度烧伤创面肿瘤坏死因子-α、白细胞介素-8、白细胞介素-1表达的影响[J].中华损伤与修复杂志(电子版),2014,9(2):137
[4]Boyce S T.Design principles for composition and pedormance of cultured skin substitutes[J].Bums,2001,27(5):523
[5]周牮,李影学,迟云飞,等.早期应用异种脱细胞真皮基质修复小儿Ⅱ度烫伤创面的疗效观察[J].中华临床医师杂志,2015,9 (8):1472
[6]宁勇,刘明锁,刘文文,等.异种脱细胞真皮基质覆盖自体微粒皮治疗大面积深度烧伤疗效观察[J].山东医药,2014,54(44):91
[7]梁黎明,柴家科,杨红明,等.激光微孔猪脱细胞真皮基质制备及创面移植的观察[J].中华烧伤杂志,2007,23(2):122
[8]Metcalfe A D,Fergnson M W.Harnessing wound healing and regeneration for tissue engineering[J].Biochem Soc Trans,2005,33 (Pt 2):413
[9]Wang Y,Mithieux S M,Kong Y,et a1.Tropoelastin incorporation into a dermal regeneration template promotes wound angiogenesis[J].Adv Healthc Mater,2015,4(4):577
[10]辛国华,曾逃,方罗旭,等.微孔结构对脱细胞真皮基质胶原网架功能重建的影响[J].广东医学,2012,33(3):310
[11]Valarmathi M T,Davis J M,Yost M J,et a1.A three-dimensional model of vasculogenesis[J].Biomaterials,2009,30(6):1098
[12]Nillesen S T,Geujes P J,Wismans R,et a1.Increased angiogenesis and blood vessel maturation in acellular collagen-heparin scarfolds containingboth FGF2and VEGF[J].Biomatefials,2007,28(6):1123
[13]徐少骏,马列,滕建英,等.不同材料人工真皮支架修复猪Ⅲ度烧伤创面比较[J].中华整形外科杂志,2010,26(5):360
(2015-07-30收稿)
作者简介盛小辉(1986-),男,硕士在读,研究方向:吸入性损伤、重症烧伤、烧伤后整形;通信作者:刘群,E- mail:zbcgzyx@163.com。
文章编号1006-8147(2016)01-0017-04
中图分类号R644
文献标志码A
