补肾健骨方对肾性骨病模型大鼠钙磷代谢紊乱与股骨密度的影响
2016-03-10于思明裴春鹏代丽娟郭丹丹
于思明,裴春鹏,代丽娟,郭丹丹
(1.黑龙江中医药大学附属第一医院肾病科,哈尔滨 150040;2.黑龙江中医药大学附属第二医院心内一科)
·基础研究·
补肾健骨方对肾性骨病模型大鼠钙磷代谢紊乱与股骨密度的影响
于思明1,裴春鹏1,代丽娟1,郭丹丹2
(1.黑龙江中医药大学附属第一医院肾病科,哈尔滨 150040;2.黑龙江中医药大学附属第二医院心内一科)
[摘要]目的探讨补肾健骨方对肾性骨病模型大鼠钙磷代谢紊乱与股骨密度的影响。方法采用0.75%腺嘌呤联合高磷饮食饲喂法建立肾性骨病大鼠模型,按体重从轻到重依次编号,采用随机数字表分为健康组、模型组、补肾健骨低剂量组、补肾健骨高剂量组、骨化三醇对照组,分别给予相应药物灌胃8周。检测各组大鼠血清肌酐(Scr)、尿素氮(BUN)、碱性磷酸酶(ALP)、血钙(Ca2+)、血磷(P3-)、全段甲状旁腺激素(iPTH)水平,在骨密度仪上测定股骨整体骨密度(W-BMD)、松质骨骨密度(T-BMD)及皮质骨骨密度(C-BMD),并观察股骨组织形态学变化。结果补肾低剂量、高剂量组BUN水平低于模型组(P<0.05),且低于骨化三醇对照组(P<0.05);补肾低剂量、高剂量组Scr水平低于模型组(P<0.01),且低于骨化三醇对照组(P<0.01);补肾高剂量组血清Ca2+水平高于模型组(P<0.01),低于骨化三醇对照组(P<0.01),补肾低剂量组血清Ca2+水平与模型组比较差异无统计学意义(P>0.05);补肾低剂量组、高剂量组血清P3-水平均低于模型组(P<0.01),且低于骨化三醇对照组(P<0.01);补肾低剂量组、高剂量组及骨化三醇对照组ALP水平均低于模型组(P<0.01),组间比较差异无统计学意义(P>0.05);补肾低剂量组、高剂量组及骨化三醇对照组iPTH水平均低于模型组(P<0.01),组间比较差异无统计学意义(P>0.05);补肾低剂量组、高剂量组及骨化三醇对照组大鼠W-BMD与C-BMD高于模型组(P<0.01),组间比较差异无统计学意义(P>0.05)。结论补肾健骨方在保护肾性骨病模型大鼠的肾功能、降低血磷方面具有一定作用,同时有助于提高大鼠股骨整体骨密度与皮质骨骨密度。
[关键词]肾性骨营养障碍;磷代谢障碍;骨密度;肾病治法; 大鼠, Wistar
随着慢性肾脏病(CKD)患者生存时间的延长,肾性骨病(ROD)逐渐成为CKD患者常见而严重的并发症之一,ROD常导致CKD患者的骨痛、骨骼畸形,直接影响CKD患者的生存质量。肾性骨病的发生源于肾精亏虚,又与瘀血、痰浊、水湿等病理因素胶着固结,故难以祛除。基于肾性骨病的发病机制,我们以补肝肾、强筋骨、化瘀泄浊为治则,组成补肾健骨方,对其干预肾性骨病的作用进行了初步研究。
1材料与方法
1.1实验动物Wistar大鼠,雌雄各半,体质量(200±20)g,由吉林大学实验动物中心提供,动物许可证号:SCXK-(吉)2013-0001。
1.2药品与试剂补肾健骨方由盐杜仲,酒大黄,煅牡蛎,土鳖虫组成,由黑龙江中医药大学附属第一医院制剂室煎煮、浓缩制得。骨化三醇由上海罗氏制药有限公司生产,腺嘌呤购自上海源聚生物科技有限公司。
1.3主要仪器Hologic Discovery骨密度仪由美国Hologic公司生产,超低温冰箱由中科美菱低温科技有限责任公司生产。
1.4造模与分组给药方法参考相关文献方法[1-2],采用0.75% 腺嘌呤联合高磷饮食饲喂法(腺嘌呤含量0.75%,磷含量1.03%)建立肾性骨病大鼠模型,持续腺嘌呤及高磷饮食4 周,继续以不含腺嘌呤的高磷饮食饲喂4 周。将大鼠按体重从轻到重依次编号,采用随机数字表分为健康组、模型组、补肾健骨低剂量组、补肾健骨高剂量组、骨化三醇对照组,每组10只。补肾健骨低剂量组、补肾健骨高剂量组分别给予补肾健骨方(生药)1.2 g/kg、2.4 g/kg灌胃,骨化三醇对照组给予骨化三醇0.009 μg/200 g浓度灌胃,灌胃容量均为1 mL/100 g,健康组、模型组给予等量0.9%氯化钠注射溶液灌胃,1次/d,持续8 周。
1.5血清学指标测定连续给药8周后予水合氯醛腹腔注射麻醉,心脏采血处死大鼠,收集血液,离心后保存在-80 ℃低温冰箱待检。采用全自动生化分析仪检测血清肌酐(Scr)、尿素氮(BUN)、碱性磷酸酶(ALP)、血钙(Ca2+)、血磷(P3-),以免疫化学发光法检测全段甲状旁腺激素(iPTH)。
1.6股骨密度及股骨病理检测从大鼠腹股沟处切开、分离双侧股骨,剔除肌肉组织及肌腱,两端离断,完整取出股骨,以0.9%氯化钠注射溶液浸湿纱布包裹,置于-80 ℃低温冰箱待检。参考文献方法[3],检测时选取左侧股骨远端1/4作为松质骨,中段1/2作为皮质骨,将股骨置于Hologic Discovery骨密度仪上分别测定整体骨密度(W-BMD)、松质骨骨密度(T-BMD)及皮质骨骨密度(C-BMD)。取右侧股骨,离断远端股骨头部,置入EDTANa2脱钙液中浸泡3周,包埋,制成石蜡切片,常规脱蜡至水,HE染色,在光镜下观察股骨组形态结构变化。
1.7统计学处理采用SPSS 13.0软件进行统计学分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2结果
2.1各组大鼠存活情况及Scr、BUN、ALP检测结果 第8周末健康组、模型组、补肾低剂量组、补肾高剂量组、骨化三醇对照组分别存活10、7、9、8、7只。检测结果见表1。


组别鼠数(只)BUN(mmol/L)Scr(μmol/L)ALP(U/L)健康组105.31±1.5428.14±5.20121.50±14.94模型组718.77±4.42183.55±17.33192.35±17.82补肾低剂量组912.49±3.76ab104.30±11.29cd152.33±13.70a补肾高剂量组812.18±3.35ab107.01±12.84cd154.66±15.80a骨化三醇对照组718.05±4.63178.62±16.71147.44±16.69a
注: 与模型组比较,aP<0.05,cP<0.01;与骨化三醇对照组比较,bP<0.05,dP<0.01
2.2各组大鼠血清Ca2+、P3-、iPTH的比较补肾高剂量组及骨化三醇对照组血清Ca2+水平高于模型组(P<0.01),骨化三醇对照组高于补肾高剂量组(P>0.05);补肾低剂量组、高剂量组血清P3-水平低于模型组(P<0.01),且低于骨化三醇对照组(P<0.01);补肾低剂量组、高剂量组及骨化三醇对照组iPTH水平低于模型组(P<0.01),组间比较差异无统计学意义(P>0.05),见表2。

组别鼠数(只)Ca2+(mmol/L)P3-(mmol/L)iPTH(pg/ml)健康组102.86±0.132.17±0.227.74±2.50模型组71.63±0.253.90±0.4918.25±3.92补肾低剂量组91.70±0.332.56±0.34ac11.73±1.55a补肾高剂量组82.28±0.26ab2.68±0.51ac10.86±1.33a骨化三醇对照组72.62±0.30a3.24±0.36a10.67±1.01a
注: 与模型组比较,aP<0.01;与骨化三醇对照组比较,bP<0.05,cP<0.01
2.3各组大鼠股骨密度检测结果比较补肾低剂量组、高剂量组及骨化三醇对照组W-BMD、C-BMD水平高于模型组(P<0.01),补肾高剂量组、骨化三醇对照组T-BMD水平低于模型组(P<0.01),组间比较差异无统计学意义(P>0.05),见表3。
2.4各组大鼠股骨组织形态变化健康组骨皮质及骨髓腔无明显变化,骨细胞分布均匀。模型组大鼠股骨皮质厚度变薄,骨髓腔变大,骨陷窝增大,骨小梁数增多,脂肪空泡数减少,骨细胞数量增多,呈条束状堆积分布。骨化三醇对照组骨皮质可见纤维细胞增生,骨陷窝较大,骨小梁数增多。补肾低剂量组、高剂量组骨细胞数量、排列接近正常,骨陷窝较小,骨小梁数增多。
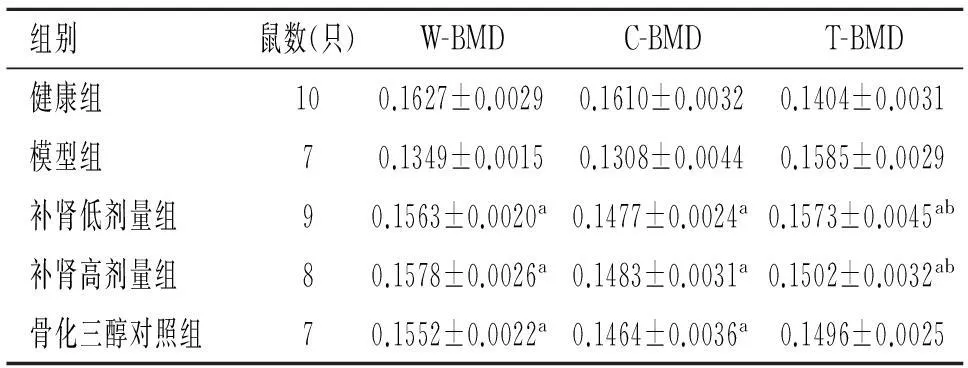
组别鼠数(只)W-BMDC-BMDT-BMD健康组100.1627±0.00290.1610±0.00320.1404±0.0031模型组70.1349±0.00150.1308±0.00440.1585±0.0029补肾低剂量组90.1563±0.0020a0.1477±0.0024a0.1573±0.0045ab补肾高剂量组80.1578±0.0026a0.1483±0.0031a0.1502±0.0032ab骨化三醇对照组70.1552±0.0022a0.1464±0.0036a0.1496±0.0025
注: 与模型组比较,aP<0.01;与骨化三醇对照组比较,bP<0.01
3讨论
CKD已成为威胁全球人类健康的一类重大疾病。在CKD这一患者群体中,矿物质和骨代谢紊乱十分常见,随着肾功能的不断减退,该紊乱逐渐加重最终导致严重的后果[4-5]。随着肾脏替代治疗技术的发展,CKD甚至终末期肾病患者的生存时间显著延长,肾性骨病的发病率也随之上升[6-7]。近年研究发现,肾性骨病不但会导致骨钙减少、骨质疏松,还与CKD患者的心血管钙化和透析患者死亡率密切相关[8]。因此,加强对CKD患者钙磷代谢紊乱的防控,积极治疗肾性骨病具有比较重要的现实意义。
肾性骨病是由脏腑内伤导致的骨病,故在病因病机上与一般骨病有所不同。根据中医学脏腑相关理论,“肝肾同源”,肝藏血,主筋,肾藏精,主骨,精血互生,筋骨相连,密不可分。又如《素问·五脏生成篇》言:“肾之合骨也,其荣发也,其主脾也”。故肾性骨病虽病位在骨,但其本在肾,又与肝脾相关,因此在治疗上不应局限于补肾填精,还应注意调补肝肾以强筋骨,同时助脾气运化,以气血充养肾精。此外,慢性肾脏病患者多兼有湿浊、瘀血、痰饮等,还需针对上述病理因素辅以通腑泄浊、清利湿热、活血化瘀等治疗方法、才能取得较好的治疗效果。补肾健骨方中盐杜仲补肝肾、强筋骨,是治疗骨质疏松的常用药物。有研究显示,单味杜仲可抑制骨吸收,提高骨的强度,对去势大鼠的骨质疏松具有一定的防治作用[9]。酒大黄活血化瘀,排毒泄浊;煅牡蛎软坚散结,涩肠收敛,与酒大黄同用有利于磷及尿毒症毒素的排出。现有的研究表明,高磷血症不但与肾性骨病密切相关,而且CKD患者的血磷水平与冠状动脉钙化程度呈正相关,是心血管事件与死亡的独立影响因素[10]。土鳖虫破血逐瘀、续筋接骨,合大黄取大黄蟅虫丸祛瘀生新之意。该方经长期临床使用,具有比较满意的疗效。
本研究采用腺嘌呤联合高磷饮食成功建立肾性骨病大鼠模型,其造模方法较5/6肾切除法钙磷代谢紊乱更为突出,因高磷饮食可以对骨代谢产生直接影响,与人类肾性骨病特点比较接近。有研究表明,腺嘌呤能较快地制造大鼠肾性骨病模型,对骨组织没有直接影响[1]。其肾脏损伤与大量腺嘌呤形成的-2,8-二羟腺嘌呤有关,后者系一难溶晶体,沉积于肾小管可造成小管损伤[11]。本研究观察到,成模后,各组大鼠Scr、BUN上升,补肾健骨方2个剂量组均能降低大鼠血清Scr、BUN水平,骨化三醇对照组对大鼠血清Scr、BUN没有明显作用,提示骨化三醇不能抑制腺嘌呤对肾小管的损伤,而补肾健骨方具有肾小管保护作用。ALP为骨代谢产物,对肾性骨病的诊断有一定参考价值。本研究中,造模大鼠ALP水平上升,补肾健骨方与骨化三醇均能降低ALP水平,提示两者均可对肾性骨病的骨代谢异常产生影响。高磷血症是血管钙化的独立危险因素,与CKD患者的病死率呈正相关,以往多采用含钙的磷结合剂治疗,但与不含钙的磷结合剂相比,其引起血管钙化的危险性更高[12]。在纠正钙磷代谢紊乱方面,补肾2个剂量组均展现了较好的降低血磷的作用,且优于骨化三醇,可能与大黄、牡蛎直接从肠道排除血磷的作用有关,杜仲、土鳖虫是否也通过其他机制降低了血磷水平,有待于在后续研究中探讨。补肾低剂量组对血钙水平无明显影响,高剂量组具有升高血钙的作用,但不及骨化三醇组。分析方中含钙药物为牡蛎,但在煎煮后其吸钙收能力有限,故在升高血钙方面与骨化三醇比较不具有优势,同时表明补肾健骨方降低血磷的作用并非依赖于补充钙质,值得进一步探究。在降低iPTH水平方面,补肾组与骨化三醇的作用相当。对骨组织形态学的观察结果显示,腺嘌呤联合高磷饮食可导致大鼠皮质骨BMD下降,厚度变薄,松质骨BMD上升,因该方法导致的骨病为骨高转换模型[2],松质骨与皮质骨的骨形成、吸收速率不同。补肾健骨方可以改善骨组织形态学变化,其作用机制可能与改善肾功、降低血磷及iPTH有关。
本研究对补肾健骨方干预肾性骨病的作用进行了初步研究,该方在保护肾功、降低血磷方面具有一定作用,同时有助于提高皮质骨骨密度,其作用机制有待于后续研究。
参考文献
[1]吴志良,阳惠林,赵波,等.大鼠肾性骨病模型的建立[J].江苏医药,2013,39(9):1012-1014.
[2]张豪,孟彦,金小冬,等.高磷联合腺嘌呤饮食诱导大鼠高转化型肾性骨病模型的建立与分析[J].中国骨质疏松杂志,2014,20(5):485-489.
[3]白亚玲,徐金升,韩佩桐,等.慢性肾衰竭大鼠股骨cbfal表达与骨密度关系的研究[J].中国骨质疏松杂志,2014,20(6):653-657.
[4]Dempster DW,Compston JE,Dreznet Mk,et al.Standardized nomenclature,symbols,and units for bone histomorhometry:a 2012 update of the report of the ASBMR Histomorphometry Nomenclature Committee[J].J Bone Miner Res,2013,28(1):2-17.
[5]陈孜瑾,陈楠.从KDOQI到KDIGO指南解读慢性肾脏病矿物质和骨异常[J].中国实用内科杂志,2011,31(12):927-929.
[6]周蓉,张芸,蒋更如,等.慢性肾脏病非透析患者营养状况的评价及分析[J].中国临床保健杂志,2010,13(4):360-363.
[7]黄业华,任伟,杨沐,等.慢性肾脏病患者血清同型半胱氨酸的变化及影响因素[J].中国临床保健杂志,2011,14(1):11-13.
[8]Roman-Garcia P,Carrillo-Lopez N,Fernandez-Martin JL,et al.High phosphorus diet induces vascular calcification,a related decrease in bone mass and in the aortic gene expression[J].Bone,2010,46(1):121-128.
[9]蔡建平,张贤,夏树林,等.杜仲对去势大鼠股骨重、矿物含量、胫骨抗弯力及血清碱性磷酸酶的影响[J].时珍国医国药,2009,20(8):1967-1969.
[10] 印获,章旭,刘必成.慢性肾脏病血管钙化治疗新进展[J].中国血液净化,2014,13(9):650-653.
[11] Zhao YY,liu J,Cheng XL,et,al.Urnary metabonomics study on biochemical changes in an experimental model of chronic renal failure by adenine based on UPLC Q-TOF/MS[J].Clin Chim Acta,2012,413(5/6):642-649.
[12] 生杰,赵久阳.慢性肾脏病患者的血管钙化[J].中国血液净化,2012,11(1):49-50.
Effects of Bushen Jiangu Decoction on calcium and phosphorus metabolism and femoral density of renal osteodystrophy ratsYuSiming*,PeiChunpeng,DaiLijuan,GuoDandan(*DepartmentofNephrologytheFirstAffiliatedHospitalofHeilongjiangCollegeofTraditionChineseMedicine,Harbin150040,China)
[Abstract]ObjectiveTo investigate the effect of Bushen Jiangu Decoction on calcium and phosphorus metabolism and femoral density of renal osteodystrophy rats. MethodsTo establish the rat model of renal osteodystrophy by 0.75% adenine combined with high phosphorus diet feeding method.Rats were numbered according to the weight from light to heavy. All rats randomly divided into normal control group, model group, low dose group, high dose group,and calcitriol group in accordance with the random number table, the corresponding medicine were gavaged for 8 weeks. The levels of iPTH, BUN, P3-, ALP, Ca2+and Scr of rats were detected; and bone mineral density, cancellous bone mineral density and cortical bone mineral density were measured. ResultsThe serum BUN and Scr level of low dose and high dose group were lower than those in model group and calcitriol control group (P<0.05). The serum Ca2 +level of high dose group was higher than model group (P<0.01), and lower than calcitriol group (P<0.01).There was no statistically significant difference between low dose group and model group (P>0.05). The serum level of P3 of low dose group and high dose group were less than that of model group and calcitriol group (P<0.01). The ALP and iPTH levels of low dose group, high dose group and calcitriol group were lower than those of model group (P<0.01), but the differences among three groups had no statistical significance (P>0.05). ConclusionBushen Jiangu Decoction can protect renal function and reduce blood phosphorus for renal osteodystrophy rats, while can help to improve the rat femur overall bone density and cortical bone mineral density.
[Key words]Renal osteodystrophy;Phosphorus metabolism disorders;Bone density;Kidney disease therapeutic methods; Rats, wistar
(收稿日期:2015-10-10)
Corresponding author:Guo Dandan,Email:guodan9634@sohu.com
中图分类号:R681.1
文献标识码:A
DOI:10.3969/J.issn.1672-6790.2016.01.025
作者简介:于思明,博士,副主任医师,硕士生导师,Email:simingyu1978@sina.com通信作者:郭丹丹,副主任医师,Email:guodan9634@sohu.com
基金项目:黑龙江省教育厅科学技术研究项目(12541771)
