多种过继性细胞免疫联合替吉奥治疗老年晚期胃癌患者的临床研究
2016-03-07张晓蕾魏玮杨春梅刘曰芬郭海生王旬果山东省东营市人民医院肿瘤科山东东营257000
张晓蕾,魏玮,杨春梅,刘曰芬,郭海生,王旬果(山东省东营市人民医院肿瘤科,山东东营257000)
多种过继性细胞免疫联合替吉奥治疗老年晚期胃癌患者的临床研究
张晓蕾,魏玮,杨春梅,刘曰芬,郭海生,王旬果
(山东省东营市人民医院肿瘤科,山东东营257000)
摘要:目的探讨多种过继性细胞免疫(ACI)联合替吉奥治疗老年晚期胃癌患者的近期疗效,观察两组的有效性、安全性及患者的生活质量。方法选取该院32例初治为晚期胃癌的老年患者,按照拟定的纳入及排除标准,采用随机数字表法随机分为两组:联合治疗组(多种ACI联合替吉奥治疗)和对照组(单用替吉奥)。通过影像学、实验室检查结果观察临床疗效、患者生活质量改善状况及毒性反应。结果老年晚期胃癌患者应用联合组的中位无进展生存期(PFS)为4.7个月,对照组的中位PFS为3.9个月,差异有统计学意义(P<0.05)。联合治疗组改善失眠、乏力、食欲等的效果优于对照组,可显著改善患者生活质量。联合组与对照组的不良反应比较,仅增加发生率极低的发热症状,安全性高。结论多种ACI联合替吉奥治疗老年晚期胃癌患者的中位PFS较单独应用替吉奥患者明显延长,疾病控制率和有效率提高,患者的生活质量明显提高,毒性反应更低、更安全,免疫力也显著提高。
关键词:过继性细胞免疫治疗;替吉奥胶囊;晚期胃癌;生活质量;免疫功能
我国是胃癌高发国家之一,根据2013年最新发布的中国肿瘤发病率排行,胃癌的发病率居第2位。胃癌多发于中老年人,其高发年龄段为55~70岁。目前,随着我国人口老龄化,加上老年人症状不明显,多数胃癌患者就诊时已为晚期,失去手术治疗的机会。对无法切除或转移性的晚期胃癌的治疗基本上是姑息性的,包括姑息性手术、放射治疗、化学药物治疗(以下简称化疗)、生物免疫治疗及中医中药治疗。主要目的是改善不适症状,提高患者的生活质量,延长生命。目前,国内外晚期胃癌化疗已广泛应用,相关研究显示,单药有效率可达44.6%[1]。化疗可作用于全身,但在杀灭肿瘤细胞的同时对无辜的健康细胞也有损伤,破坏人体的免疫功能,显著降低免疫力,且癌细胞对药物逐步产生耐药性成为影响其治疗效果的主要原因。近年来,过继性细胞免疫治疗(adoptive cellular immunotherapy,ACI)备受瞩目,是一种新兴的通过自身免疫细胞治疗肿瘤的方法。主要通过采集患者的自体免疫细胞,在实验室内进行体外培养和扩增,诱导、分化出可杀灭肿瘤的多种无免疫缺陷的自体免疫细胞,再将培养出的具有抗瘤活性的正常免疫细胞输入肿瘤患者体内,起免疫监视、启动自身抗瘤免疫反应、修复自身免疫系统的作用,提高肿瘤患者机体免疫力,并循序渐进的杀灭肿瘤细胞。目前应用的ACI主要包括:树突状细胞(dendritic cell,DC)、细胞因子诱导的杀伤细胞(cytokine-induced kill cells,CIK)、自然杀伤细胞(natural killer cell,NK)、抗CD3单克隆抗体激活的杀伤细胞(anti-CD3McAb activated killer cells,CD3AK)、γδT细胞等[2]。
1 资料与方法
1.1一般资料
选取2013年1月-2014年1月本科收治的32例符合条件的晚期胃癌患者,全部入组患者签署知情同意书。分组方法采用随机数字表法,32例患者随机分入联合治疗组与对照组。两组患者中印戒细胞癌5例,乳头状腺癌19例,黏液腺癌4例,管状腺癌4例。年龄65~88岁,平均76.5岁;Kamofsky体力状况评分(kamofsky performance status,KPS)70~90分。其中联合治疗组(多种ACI联合替吉治疗)16例,男性9例,女性7例;胃癌原发灶位于贲门7例,幽门6例,胃体3例。对照组(单用替吉奥)16例,男性10例,女性6例;胃癌原发灶位于贲门6例,幽门8例,胃体2例。两组患者在性别、年龄、KPS评分、病理类型等临床特征方面比较,差异无统计学意义(P>0.05),有可比性。
1.1.1纳入标准经胃镜病理检查确诊为胃癌,影像学证实临床分期为Ⅳ期。既往未接受任何化疗方案,目前患者全身状况无法耐受静脉化疗或可耐受静脉化疗但患者及家属拒绝。未出现明显消化道梗阻、出血及穿孔等并发症。KPS评分70~90分,生存期预计≥3个月。年龄65~88岁。依照实体瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1,所有入组患者有≥1个客观可测量病灶。
1.1.2排除标准①无可测量病灶;②严重冠状动脉粥样硬化性心脏病或重要脏器功能不全;③不易控制的精神病史;④联合组中对白介素-2及其他生物制剂过敏;⑤合并其他肿瘤;⑥合并严重感染或活动性乙肝、肺结核、艾滋病或其他传染病史;⑦正使用激素类、免疫抑制剂的自身免疫性疾病患者。⑧实验室检查存在严重异常。
1.2实验分组
1.2.1联合治疗组治疗前1天完善相关检查,排除治疗禁忌证后行外周血单核细胞采集。细胞采集后的第1天开始口服替吉奥胶囊治疗,2次/d,1~14 d,3周为1个周期,具体剂量根据体表面积(body surface measurement,BSM)<1.25 m2,40 mg/次;BSM 1.25~1.50 m2,50 mg/次;BSM>1.5 m2,60 mg/次,出现病情进展或不能耐受不良反应可停药。治疗期间根据病情需要复查血常规及肝、肾功能,如出现≥Ⅲ度骨髓抑制、消化道反应,≥Ⅱ度肝、肾功能损伤则暂时停止治疗,直至症状及血液学指标恢复至无明显治疗禁忌证。如停药≥4周上述不良反应仍无明显改善,则终止治疗。第22天开始第2周期口服替吉奥。2周期治疗结束后1个月复查。
1.2.2对照组治疗前1 d完善相关检查,治疗第1天开始口服替吉奥,方法及剂量同联合治疗组。
1.3ACI治疗
分外周单核细胞采集、实验室培养、定期免疫细胞回输3个阶段。
1.3.1细胞采集采用细胞分离机为纳入患者进行细胞采集。通过患者外周静脉采集血液标本,应用封闭性与安全性更佳的全封闭式费森尤斯配套采集套件,避免交叉感染,时间约1 h。采集肿瘤患者体内的单个核细胞,液体总量为60~100 ml。采集前后及采集过程中需密切关注患者血压、心率、呼吸等生命体征变化。
1.3.2细胞培养在符合药品生产质量管理规范(good manufacturing practice,GMP)标准的实验室,应用培养液和细胞因子将分离的外周血单核细胞(pe ripheral blood mononuclear cell,PBMC)进行反复刺激细胞分裂增殖。分别诱导生成DC、CIK、NK、γδT等多种免疫细胞。经过培养,各种免疫细胞大量扩增,细胞总量扩增至≥1×109个。
1.3.3细胞回输培养完成的细胞,经检测细胞存活率≥85%,并经厌氧菌、需氧菌、真菌培养、内毒素等检测为阴性。细胞数量达到标准后,按照既定的回输方案和不同的回输时间要求分别进行回输。见表1。
1.4疗效评价
1.4.1疗效标准按RECIST 1.0标准评价,客观有效率(objective response rate,ORR)为完全缓解(complete response,CR)+部分缓解(complete response,PR),疾病控制率(disease control rate,DCR)为CR+PR+疾病稳定(stable disease,SD)+无进展生存期(progression-free survival,PFS)。
1.4.2临床受益反应评定标准采用KPS评分、疼痛及体重指标。
1.4.3免疫指标每周期化疗前及化疗后检测外周血淋巴细胞表型的变化,采用美国Becton Dickinson公司生产的流式细胞仪(FACSCalibur)检测血CD8+、CD4+、CD3+、NK细胞的百分率,比较其治疗前后的变化。
1.4.4不良反应不良反应主要为恶心、呕吐、骨髓抑制、发热、腹泻、口腔炎、手足综合征等。
1.5统计学方法
采用SPSS 20.0统计软件进行数据处理,计量资料以均数±标准差(±s)表示,计数资料以率表示,组间临床特征均衡性比较用方差分析和Fisher精确检验,组间无进展生存期比较用Kaplan-meier法,P<0.05为差异有统计学意义。
2 结果
2.1近期疗效
2.1.1有效率从有效率来看,两组无CR,考虑与晚期肿瘤负荷大有关。联合治疗组ORR为31.25%,DCR为87.5%,对照组ORR为25%,DCR为62.5%,两组比较差异无统计学意义(P>0.05),但联合治疗组的有效率和临床受益率明显高于对照组。此外,两组患者的ORR低于目前国内外研究的44.6%,考虑与两组患者高龄、晚期肿瘤广泛侵犯、肿瘤负荷大有关。见表2。
2.1.2PFS联合治疗组中位PFS为4.7个月(95% CI:3.916,5.484),对照组中位PFS为3.9个月(95% CI:3.116,4.684),两组比较差异有统计学意义(P= 0.015)。
2.2临床受益率

表1 回输时间表
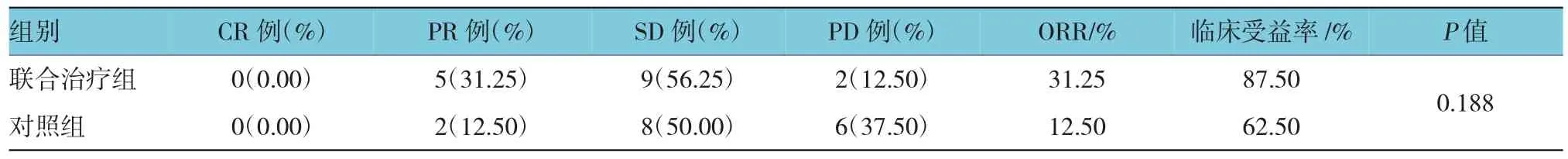
表2 两组有效率比较
通过比较治疗前后KPS评分,分析症状是否缓解。本研究中联合治疗组KPS评分提高7例,稳定6例,减退3例;对照组KPS评分提高4例,稳定5例,减退7例,两组比较差异有统计学意义(P<0.05)。联合治疗组KPS评分改善较对照组更明显,提示ACI与替吉奥联合治疗对患者体力的恢复有较大帮助。见表3。
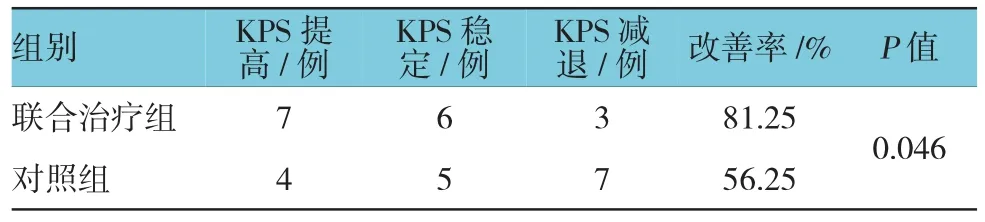
表3 两组KPS评分比较
2.3免疫指标变化
免疫指标主要观察T细胞亚群(CD3+、CD4+、CD8+)及NK细胞的变化。联合治疗组治疗后CD3+、CD4+、NK与治疗前比较,差异有统计学意义(P<0.05);CD8+有所下降,但差异无统计学意义(P>0.05)。对照组T细胞亚群较治疗前略改善,但差异无统计学意义(P>0.05)。CD4+比例升高提示预后较好,而CD8+升高则是免疫受损的标志[3]。研究结果证实,患者联合治疗后免疫功能较前恢复,且免疫力明显提高。对照组NK细胞增多较T细胞明显,但差异无统计学意义。见表4。
2.4不良反应
两组主要不良反应为骨髓抑制、恶心、呕吐、腹泻及发热症状。其中联合治疗组的恶心、呕吐及白细胞减少的发生率低于对照组,差异有统计学意义(P<0.05)。手足综合征、腹泻、口腔炎是替吉奥最常见的不良反应,两组均出现该不良反应,总发生率较低。两组无严重肝、肾功损伤。联合治疗组1例患者出现发热症状,考虑为生物治疗所致,该患者体温最高38.6℃,经退热对症治疗后体温恢复正常。见表5。
表4 两组T细胞亚群及NK细胞治疗前后变化(±s)

表4 两组T细胞亚群及NK细胞治疗前后变化(±s)
组别联合治疗组CD3+ CD4+ CD8+ NK治疗前 45.23±6.58 21.90±6.32 30.23±5.73 15.61±1.62治疗后 68.63±5.45 42.00±4.95 25.57±4.14 30.52±3.56 t值 6.470 2.490 1.720 3.220 P值对照组治疗前治疗后0.0000.0000.8900.000 16.41±1.47 21.66±2.30 t值P值46.21±6.50 49.54±7.51 32.35±5.07 34.05±5.05 31.07±5.69 29.07±6.47 1.900 0.210 1.530 0.130 1.190 0.160 2.080 0.080
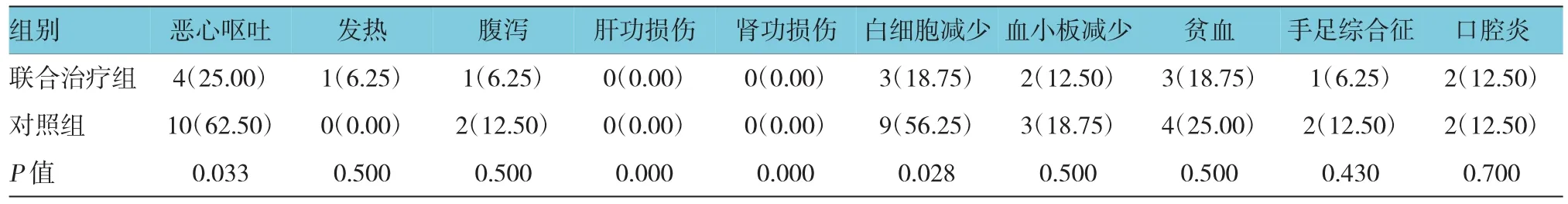
表5 两组不良反应比较 例(%)
3 讨论
目前,我国每年胃癌的新发病例即将突破40万,是世界胃癌总发病率的2倍多。随着食品、环境等污染加剧,胃癌的发病率仍然呈上升趋势。由于早期临床症状无特异性,多数患者就诊时已为晚期。对晚期胃癌患者的治疗主要为姑息性的,无明显梗阻症状不推荐行姑息手术;姑息放射治疗临床效果欠佳;靶向治疗主要针对少部分Her-2阳性患者且费用昂贵。因此,姑息化疗是晚期胃癌治疗的主要手段,但无标准化疗方案。铂类和5氟尿嘧啶(5-fluorouracil,5-FU)类是晚期胃癌最基本的药物,但铂类药物胃肠道及肾毒性反应较重,使其在老年晚期胃癌患者中使用受限。5-FU类药物是特异性细胞周期嘧啶类药物,在细胞周期的S期发挥主要作用,其半衰期短只有6~21 min,在体内代谢快。第3代氟尿嘧啶类口服药替吉奥胶囊(tegafur gimeracil and oteracil potassium capsules,S-1),在氟尿嘧啶类药物抗瘤活性的基础上,对进展期胃癌的治疗高更安全。JCOG991试验显示,S-1的ORR和PFS优于5-FU单药组,分别为28%和9%及4.8和2.9个月[4]。Kang等[5]研究表明,SP方案(替吉奥/顺铂)的ORR (54.0% vs 31.1%)及PFS(13个月vs 11个月)皆优于S-1单药组,但其Ⅳ级骨髓抑制和胃肠道反应显著增大。据统计,日本≥80%晚期胃癌患者选择S-1化疗,有效率可达44.6%。Maruo等[6]报道一项单药S-1治疗21例晚期胃癌的开放性实验,其中1例达CR,24例达PR,总有效率为49%。一项4 177例晚期胃癌患者加入的Ⅱ期临床研究显示,S-1在实验中≥Ⅲ级血液学及胃肠道毒性反应发生率只有14.9%[7]。虽然S-1的血液学毒性比优福啶及其他口服5-FU类药物更常见,但是总发生率≤6%[8],患者的耐受性良好。Tsuburaya等[9]报道,一项多中心(23个国家)Ⅲ期临床试验结果表明,S-1在晚期胃癌和胃食管腺癌患者的安全性方面具有显著优势。因此,对身体状况欠佳无法承受联合化疗,以及不能耐受化疗副作用的老年晚期胃癌患者,选择单药口服S-1是唯一有效的办法。但是,化疗药物常会损伤一定的机体免疫力,随着目前分子生物学和细胞免疫技术飞速发展,补充DC-CIK的ACI联合化疗在临床越来越受到关注,联合治疗既保证疗效,又增强患者的自身免疫力,逐渐被人们接受并认可。
Jiang等[10]用CIK细胞治疗29例中晚期胃癌患者,ORR为58.6%。蔡俊霞等[11]选取56例确诊为晚期胃癌并采用DC-CIK联合化疗的患者对比28例单纯化疗,结果表明,联合治疗组DCR为78.6%,与对照组DCR(53.6%)比较,差异有统计学意义(P<0.05);两组KPS评分改善率分别为82.14%和57.14%,差异有统计学意义(P<0.05)。孙明芳等[12]选取62例晚期胃癌患者应用多西他赛+顺铂+氟尿嘧啶化疗联合自体CIK比较单纯化疗组,结果近期疗效评价显示,两组ORR比较差异无统计学意义,但实验组DCR较对照组提高(83.9% vs 61.3%,P= 0.046)。实验组患者生活质量改善明显优于对照组。张娜等[13]通过体外研究显示,5-氟尿嘧啶联合DC-CIK细胞对晚期胃癌细胞的杀伤率较单独应用5-FU或DC-CIK明显升高,为ACI联合化疗奠定理论依据。
目前手术、靶向治疗、放射治疗及化疗等传统的治疗方法不能有效控制晚期胃癌患者的病情进展,传统治疗模式破坏机体免疫平衡,且副反应明显,患者生活质量受到严重影响,尤其对于晚期患者无法耐受上述治疗,总体预后极差。所以晚期患者迫切需要一种或多种不但不会损害免疫系统,反而能增强患者自身免疫功能、提高生活质量的治疗手段。过继性细胞免疫联合化疗药物治疗模式可以起固本培元的作用,尤其对晚期肿瘤患者,不良反应少,患者耐受性好,在增强免疫功能、改善生活质量、控制肿瘤转移及延缓肿瘤进展等方面疗效确切,为肿瘤患者带来新的希望。由于其高效、低度、安全性高,有广阔的应用前景。本实验结论为ACI结合替吉奥治疗能明显改善老年晚期胃癌患者中位无疾病进展时间,具有安全性高、不良反应小、耐受性好等特点。临床上,多种过继性细胞免疫联合化疗受到晚期恶性肿瘤患者的认可。
目前,多种过继性细胞免疫联合化疗治疗晚期胃癌患者多为小样本的临床研究,且具体的培养技术和回输途径还需要更成熟的研究,以后DC-CIK及其他多种过继性细胞免疫联合化疗还需要大量的研究,期待在临床应用中更加成熟,为广大患者提供福音。过继性细胞免疫治疗方案价格昂贵,对临床推广造成一定困难,但随着社会的进步,人们经济水平的提高及医疗社会保障体系的进一步完善,越来越多的患者有条件应用该先进的医疗技术。
参考文献:
[1] Chen Y, Wang XJ, Lin RB, et al. Efficacy of intraperitoneal and intravenous chemotherapy for advanced gastric cancer with peritoneal metastasis[J]. Tumori, 2014, 100(5): 180-188.
[2] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. The Lancet Oncology, 2012, 13(3): 239-246.
[3] Li Pira G, Ivaldi F, Starc N, et al. A registry of HLA-typed donors for production of virus-specific CD4 and CD8 T lympho cytes for adoptive reconstitution of immune-compromised patients[J]. Transfusion, 2014, 54(12): 3145-3154.
[4] Koizumi W, Kim YH, Fujii M, et al. Addition of docetaxel to S-1 without platinum prolongs survival of patients with advanced gastric cancer: a randomized study (START)[J]. Journal of Cancer Research and Clinical Oncology, 2014, 140(2): 319-328.
[5] Kang BW, Kim JG, Kwon OK, et al. Non-platinum-based chemotherapy for treatment of advanced gastric cancer: 5-fluorouracil, taxanes, and irinotecan[J]. World Journal of Gastroenterology, 2014, 20(18): 5396-5402.
[6] Maruo H, Suzuki K, Ishikawa S, et al. Study of S-1 and oxaliplatin(SOX) plus bevacizumab as first-line therapy in patients with unresectable colorectal cancer [J]. Gan to Kagaku Ryoho Cancer Chemotherapy, 2014, 41(13): 2583-2586.
[7] Takahashi T, Saikawa Y, Fukuda K, et al. Phase I study of S-1 plus fractional cisplatin as adjuvant chemotherapy for advanced gastric cancer in an outpatient setting (KOGC-03)[J]. Anticancer Research, 2015, 35(1): 467-471.
[8] Bittoni A, Scartozzi M, Giampieri R, et al. Clinical evidence for three distinct gastric cancer subtypes: time for a new approach[J]. PLoS One, 2013, 8(11): DOI: 10.1371/journal.pone.0078544.
[9] Tsuburaya A, Morita S, Kodera Y, et al. A randomized phaseⅡtrial to elucidate the efficacy of capecitabine plus cisplatin (XP) and S-1 plus cisplatin(SP) as a first-line treatment for ad-vanced gastric cancer: XP ascertainment vs. SP randomized PⅡtrial (XParTSⅡ)[J]. BMC Cancer, 2012, (12): 307-401.
[10] Jiang J, Wu C, Lu B. Cytokine-induced killer cells promote antitumor immunity[J]. Journal of Translational Medicine, 2013, 11: 83-86.
[11]蔡俊霞,吴锦昌,王彬,等. DC-CIK联合化疗治疗晚期胃癌的近期疗效观察[J].南京医科大学学报(自然科学版), 2014, 34(1): 36-40.
[12]孙明芳,丁震宇,刘兆喆,等.化疗联合自体CIK细胞治疗晚期胃癌的随机对照研究[J].现代肿瘤医学, 2013, 21(7): 1537-1540.
[13]张娜,杜昱蕾,李晶,等. 5-氟尿嘧啶联合DC-CIK细胞对胃癌细胞杀伤作用的体外研究[J].白求恩医学杂志, 2014, 12(1): 3-5.
(童颖丹编辑)
Multicellular adoptive immunotherapy combined with S-1 in the elderly patients with advanced gastric cancer
Xiao-lei Zhang, Wei Wei, Chun-mei Yang, Yue-fen Liu, Hai-sheng Guo, Xun-guo Wang
(Department of Oncology, Dongying Peopleˊs Hospital, Dongying, Shandong 257000, China)
Abstract:Objective To explore the recent treatment effect and toxicity of multicellular adoptive immunotherapy combined with S-1 in the elderly advanced gastric cancer patients, and compare the difference in the therapeutic effect between multicellular adoptive immunotherapy combined with S-1 and S-1 used alone. Methods Thirty-two elderly patients who were diagnosed as advanced gastric cancer in our hospital were selected. The patients were randomly divided into two groups. The combined treatment group used multicellular adoptive immunotherapy combined with S-1, while the control group used S-1 alone. The clinical therapeutic effect was observed through imaging and laboratory results. The median progression-free survival (PFS), the patientsˊquality of life, the toxicity and immunity were observed. Results The median progressionfree survival in the combined treatment group and the control group was 4.7 months and 3.9 months respectively, the difference was statistically significant (P<0.05). Multicellular adoptive immunotherapy in combination with S -1 therapy significantly improved the patientsˊquality of life, especially for insomnia, fatigue and stomachic effect. Comaring the adverse reactions of both groups, the combined treatment group only had additional fever with lower incidence. The combined treatment had high safety compared to S-1 alone. Conclusions Compared with the therapy of S-1 alone, multicellular adoptive immunotherapy combined with S-1 has significant efficacy and low toxicity for the treatment of advanced gastric cancer in elderlybook=121,ebook=127patients, can prolong their progression-free survival, and improve the patientsˊquality of life and immunity.
Keywords:adoptive cellular immunotherapy; S-1 capsule; advanced gastric cancer; quality of life; immunity
[通信作者]王旬果,E-mail:wangxunguocn@126.com;Tel:13864768818
收稿日期:2015-04-24
文章编号:1005-8982(2016)03-0120-06
DOI:10.3969/j.issn.1005-8982.2016.03.025
中图分类号:R735.2
文献标识码:B
