来曲唑配合高脂膳食诱导胰岛素抵抗多囊卵巢综合征大鼠代谢表型的实验研究*
2016-03-07林莺张宏黄鸣清于志文纪峰黄黎珊杨娟许金榜广州中医药大学广东广州50006福建中医药大学福建福州50福建省妇幼保健院福建福州5000
林莺,张宏,黄鸣清,于志文,纪峰,黄黎珊,杨娟,许金榜(.广州中医药大学,广东广州50006;.福建中医药大学,福建福州50;.福建省妇幼保健院,福建福州5000)
来曲唑配合高脂膳食诱导胰岛素抵抗多囊卵巢综合征大鼠代谢表型的实验研究*
林莺1,张宏1,黄鸣清2,于志文2,纪峰2,黄黎珊2,杨娟3,许金榜3
(1.广州中医药大学,广东广州510006;2.福建中医药大学,福建福州350122;3.福建省妇幼保健院,福建福州350001)
摘要:目的建立来曲唑及高脂饲料诱导的大鼠多囊卵巢综合征(PCOS)胰岛素抵抗(IR)动物模型,探讨其生殖内分泌异常及代谢表型特征。方法将24只3周龄雌性SD大鼠随机分为PCOS-IR组、PCOS组、高脂组、对照组,每组6只。PCOS-IR组予高脂饲料喂养12周,第6周龄时开始每日灌胃来曲唑羧甲基纤维素钠(CMC-Na)溶液,连续9周;PCOS组常规饲料喂养12周,第6周龄时开始每日灌胃来曲唑CMC-Na溶液,连续9周;高脂组予高脂饲料喂养12周,第6周龄时开始每日灌胃0.5%CMC-Na溶液,连续9周;对照组常规饲料喂养12周,第6周龄时开始每日灌胃0.5%CMC-Na溶液,连续9周。观察体重和卵巢组织学变化,测定血脂水平、糖耐量、胰岛素耐量、空腹血糖(FPG)和空腹胰岛素(FINS)浓度,并计算胰岛素抵抗指数(HOMA-IR)。结果PCOS-IR组和PCOS组卵巢呈多囊样改变,卵巢闭锁卵泡增多,闭锁卵泡的直径较大,颗粒细胞层数有所减少,未见黄体分布;高脂组及对照组卵巢分布有各级卵泡,可见较多黄体分布。与对照组比较,PCOS-IR组的体重增加(P=0.000),总胆固醇升高(P<0.05),低密度脂蛋白升高(P<0.01),糖耐量曲线下面积(AUC)增加(P<0.05),胰岛素耐量AUC增加(P<0.01),FINS升高(P<0.01),HOMA-IR升高(P<0.05)。结论来曲唑合并高脂膳食可成功诱导胰岛素抵抗PCOS大鼠典型的代谢表型。
关键词:来曲唑;高脂饮食;糖脂代谢;胰岛素抵抗;多囊卵巢综合征
多囊卵巢综合征(polycystic ovary syndrome,PCOS),育龄期妇女常见的妇科内分泌疾病,以持续性无排卵、雄激素过多和胰岛素抵抗为特征,患病率高达6%~8%,也是女性不孕症的主要病因之一[1]。PCOS不仅影响女性的生殖功能,越来越多的循证医学研究表明,PCOS患者2型糖尿病、代谢综合征及心脑血管疾病等远期并发症的发病风险亦明显高于一般人群并可持续到绝经后,这些均与PCOS的胰岛素抵抗(insulin resistance,IR)、肥胖和血脂异常等有关。诸多临床研究也发现PCOS普遍存在胰岛素抵抗[2]。胰岛素抵抗是PCOS的核心病理机制,是导致PCOS患者超重和肥胖的主要原因,同时超重和肥胖也加重了PCOS的内分泌和代谢紊乱[3-4]。PCOS胰岛素抵抗已成为近年来的研究热点,建立多囊卵巢综合征胰岛素抵抗动物模型对该病的深入研究具有深远的意义。
多囊卵巢综合征的造模方法有多种,但迄今为止,尚无一种公认的标准方法。目前,较常用的PCOS造模方法是皮下注射雄激素,如脱氢表雄酮或丙酸睾丸酮等。本课题组预实验研究表明皮下注射给药大鼠卵巢多囊样表型不明显,且卵巢条索化明显,与临床上PCOS患者卵巢增大的表型有着显著区别。故在既往来曲唑造模的基础上,结合高脂饲料喂养,成功诱导了大鼠胰岛素抵抗及卵巢多囊样表型。
1 材料与方法
1.1实验动物
3周龄Sprague Dawley SPF级雌大鼠24只,由上海斯莱克实验动物责任有限公司提供,合格证号:2007000571938,体重68~90 g不等,按体重由小到大编号,用随机数字表随机分为PCOS-IR组、PCOS组、高脂组、对照组,每组6只。
1.2实验条件
实验场所为福建中医药大学实验动物中心SPF实验室。实验动物使用许可证号为:SYXK(闽)2014-0005,温度22~23℃,湿度50%~60%,清洁饲养,给水充分,环境安静,实验室环境符合清洁级动物饲养要求。
1.3药物和试剂
来曲唑(江苏恒瑞医药股份有限公司,产品批号:15011956,国药准字H19991001),羧甲基纤维素钠(sodium carboxyl methyl cellulose,CMC-Na,美国Sigma-Aldrich公司,批号:1002004956),高脂饲料(D12492)[5.24 kal/g(1 kal=4.184 kJ),供能比:蛋白20%,碳水化合物20%,脂肪60%],对照饲料(D12450-B)(3.85 kal/g,供能比:蛋白20%,碳水化合物70%,脂肪10%)由广东省医学实验动物中心加工配送,胰岛素放免试剂盒(天津市协和医药科技有限公司),拜耳1455型血糖仪(德国拜耳有限公司)。
1.4实验方法
所有大鼠适应性喂养3 d,PCOS-IR组予高脂饲料喂养12周,第6周龄时开始每日灌胃来曲唑溶液[来曲唑1 mg/(kg·d)溶于0.5%CMC-Na中],连续9周;PCOS组常规饲料喂养12周,第6周龄时开始每日灌胃来曲唑溶液,连续9周;高脂组高脂饲料喂养12周,第6周龄时开始每日灌胃0.5%CMC-Na溶液,连续9周;对照组常规饲料喂养12周,第6周龄时开始每日灌胃0.5% CMC-Na溶液,连续9周。
1.5检测指标
1.5.1阴道涂片大鼠灌胃7周后每天早上阴道涂片,10%甲醛固定,HE染色,镜检。连续10 d。
1.5.2卵巢组织学检查卵巢组织4%多聚甲醛固定,常规脱水,石蜡包埋,以4μm厚度切片,常规脱蜡、水化后苏木素染色5~10 min,1%盐酸酒精分化,1%伊红溶液染色,脱水,透明,中性树胶封片,显微镜下观察各组大鼠卵巢组织学变化。
1.5.3糖耐量试验灌胃9周后,20:00开始禁食,次日晨8:00鼠尾采血,利用拜耳1455型血糖仪测空腹血糖值,腹腔注射50%葡萄糖注射液(2 g/kg),鼠尾采血测量注射后15、30、45、60和120 min血糖值。Med Calc 11.4.2.0统计软件分析对比曲线下面积(area under the curve,AUC)。
1.5.4胰岛素耐量试验灌胃9周后,晨8∶00开始禁食2 h,鼠尾采血,测血糖值,腹腔注射胰岛素溶液(0.75 u/kg),鼠尾采血测量注射后15、30、45、60、90 和120 min血糖值。MedCalc 11.4.2.0统计软件分析对比AUC。
1.5.5血脂及胰岛素抵抗指数糖耐量检测结束后第3天,20∶00开始禁食,次日晨8∶00鼠尾采血,测空腹血糖值(fasting plasma glucose,FPG),以2%戊巴比妥钠(0.2 ml/100 g)腹腔注射麻醉后,腹主动脉采血5~8 ml,离心后收集血清,BECMAN全自动生化分析仪检测血清总胆固醇(total cholesterol,TC)、三酰甘油(Triglycerides,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL);放射免疫法检测胰岛素(insulin released test,INS)。计算胰岛素抵抗指数(homeostasis model of assessment for insulin resistence index,HOMA-IR),HOMA-IR=空腹胰岛素(fasting insulin,FINS)×FPG/22.5。
1.6统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1阴道涂片
PCOS-IR组与PCOS组阴道涂片染色镜检结果显示大鼠均处于动情间期时相,仅见大量白细胞,偶见少量角化细胞,提示无排卵。高脂组与对照组仍保持规律的动情周期。
2.2卵巢病理切片
对照组与高脂组卵巢可见多个黄体以及不同发育阶段的卵泡,颗粒细胞多层,排列整齐。与对照组比较,PCOS-IR组与PCOS组卵巢的闭锁卵泡增多,且闭锁卵泡的直径较大,卵巢呈多囊样改变,颗粒细胞层数有所减少,白膜增厚。见图1。
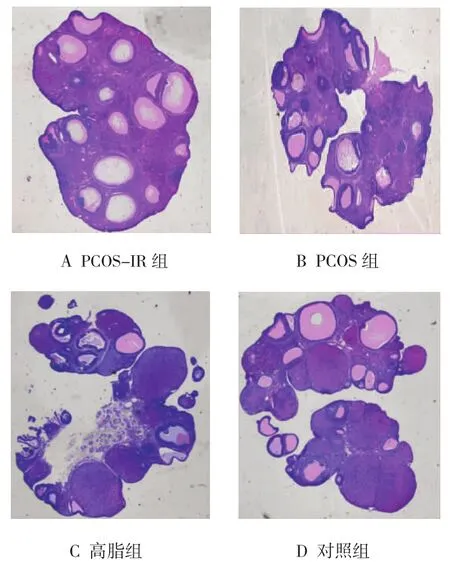
图1 4组大鼠卵巢病理切片
2.3体重
4组大鼠实验前体重无明显差异,PCOS-IR组大鼠的体重在高脂喂养至8周开始明显增加,喂养至15周时增加明显,与对照组比较,差异有统计学意义(P=0.000)。见图2和表1。
表1 4组大鼠体重比较(n=6,g±s)

表1 4组大鼠体重比较(n=6,g±s)
注:1)与对照组比较,P=0.000;2)与对照组比较,P<0.05
组别 实验前 实验后 F值 t值 P值PCOS-IR组84.58±4.76 519.95±42.341) 1.523 7.424 0.000 PCOS组 79.58±6.11 406.05±22.612) 0.085 2.250 0.048高脂组 82.4±6.84 403.60±50.29 6.111 1.130 0.288对照组 80.6±4.27 378.58±19.56

图2 4组大鼠体重增长趋势图
2.4糖耐量及胰岛素耐量情况
PCOS-IR组大鼠的糖耐量曲线下面积与对照组比较差异有统计学意义(P<0.05),PCOS-IR组大鼠的胰岛素耐量曲线下面积与对照组比较差异有统计学意义(P<0.01)。见表2。
2.5胰岛素抵抗指数
与对照组比较,PCOS-IR组大鼠的空腹血糖差异无统计学意义(P>0.05),空腹胰岛素差异有统计学意义(P<0.01),胰岛素抵抗指数与对照组比较差异有统计学意义(P<0.05)。见表3。
2.6血脂水平
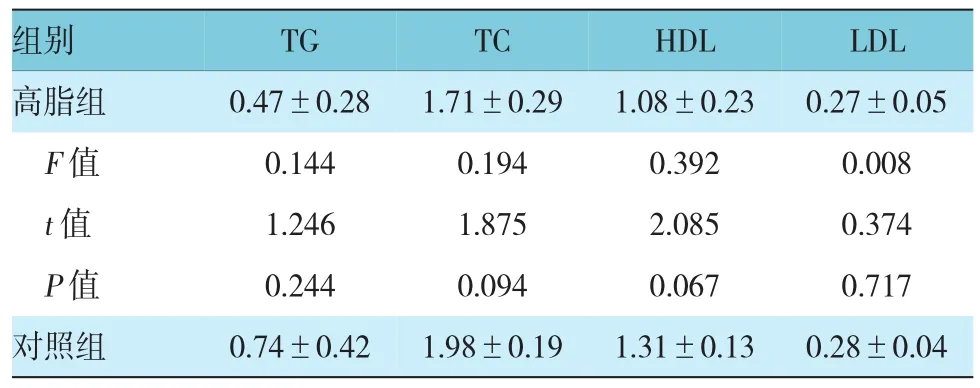
PCOS-IR组大鼠的血清TC水平与对照组比较差异有统计学意义(P<0.05),血清LDL水平与对照组比较差异有统计学意义(P<0.01)。与对照组比较,PCOS-IR组大鼠的血清TG、HDL水平差异无统计学意义(P>0.05)。见表4。
表2 4组大鼠糖耐量及胰岛素耐量AUC比较(n=6,±s)
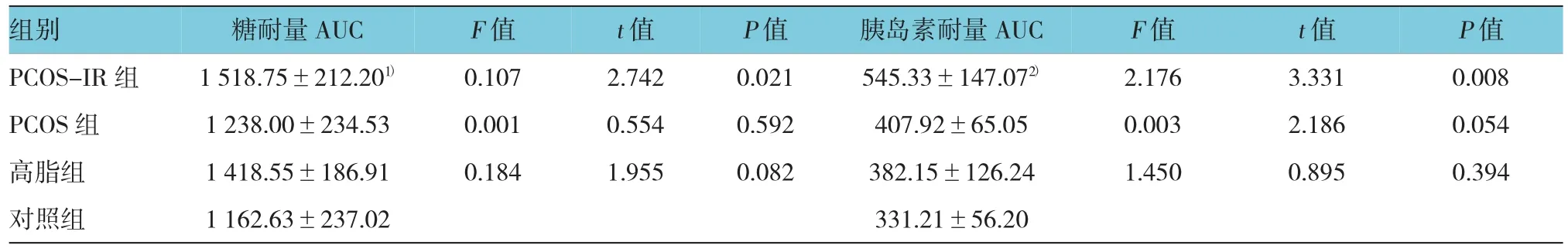
表2 4组大鼠糖耐量及胰岛素耐量AUC比较(n=6,±s)
注:1)与对照组比较,P<0.05;2)与对照组比较,P<0.01
组别 糖耐量AUC F值 t值 P值 胰岛素耐量AUC F值 t值 P值PCOS-IR组 1 518.75±212.201) 0.107 2.742 0.021 545.33±147.072) 2.176 3.331 0.008 PCOS组 1 238.00±234.53 0.001 0.554 0.592 407.92±65.05 0.003 2.186 0.054高脂组 1 418.55±186.91 0.184 1.955 0.082 382.15±126.24 1.450 0.895 0.394对照组 1 162.63±237.02 331.21±56.20
表3 4组大鼠胰岛素抵抗指数比较(n=6,±s)

表3 4组大鼠胰岛素抵抗指数比较(n=6,±s)
注:1)与对照组比较,P<0.01;2)与对照组比较,P<0.05
组别 FINS/(mIU/L) FPG/(mmol/L) HOMA-IR PCOS-IR组 35.19±9.191) 5.57±0.56 8.83±2.952)F值 0.008 2.224 0.597 t值 3.244 1.280 3.127 P值 0.009 0.229 0.011 PCOS组 27.31±10.69 4.95±0.46 5.93±2.15 F值 0.558 0.011 0.015 t值 1.551 1.100 1.354 P值 0.152 0.298 0.206高脂组 38.71±11.041) 5.40±0.84 9.34±3.182)F值 1.938 2.040 2.830 t值 3.420 0.486 3.232 P值 0.008 0.638 0.010对照组 18.69±8.41 5.22±0.37 4.33±1.93
表4 4组大鼠血脂水平比较(n=6,mmol/L±s)

表4 4组大鼠血脂水平比较(n=6,mmol/L±s)
组别 TG TC HDL LDL PCOS-IR组 0.54±0.17 2.30±0.191) 1.40±0.10 0.46±0.062)F值 1.593 0.103 1.028 1.370 t值 1.098 2.904 1.286 5.754 P值PCOS组F值0.000 0.34±0.05 0.031 t值P值0.298 1.46±0.401)0.191 0.016 2.08±0.31 2.075 0.227 1.27±0.25 3.82 3.041 0.012 0.640 0.537 0.300 0.770 2.313 0.043
续表4
3 讨论
PCOS是女性最常见的内分泌代谢异常性疾病,约50%~70%的PCOS患者存在胰岛素抵抗[5],10%的PCOS患者伴有糖尿病[6]。近20年来,越来越多的研究表明,胰岛素代谢异常或胰岛素信号传导途径异常是PCOS发病机制的核心。PCOS常表现为IR及代偿性高胰岛素血症。
来曲唑是一种芳香化酶抑制剂,本研究采用来曲唑造模法建立PCOS动物模型。该造模的主要机制是通过抑制芳香化酶的生物学作用,减少雄激素向雌激素转化,降低雌激素水平,消除雌激素对下丘脑的负反馈抑制,从而导致垂体促性腺激素分泌增加,高水平、失去脉冲的黄体生成素作用于卵泡膜细胞,生成过多的雄激素,体内雄激素堆积,特别是卵巢局部雄激素增加,导致排卵障碍和卵巢多囊样改变。本研究PCOS-IR组与PCOS组卵巢的闭锁卵泡增多,且闭锁卵泡的直径较大,卵巢呈多囊样改变,颗粒细胞层数有所减少,白膜增厚,与国内外研究相一致[7-9]。
高脂膳食是用于诱导肥胖症和胰岛素抵抗的常用方法,杨宇峰等[10]研究表明,高脂饮食能直接降低胰岛素作用下骨骼肌和脂肪组织对葡萄糖的吸收作用,同时提高肝脏葡萄糖的生成,改变对胰岛素敏感组织的葡萄糖的转变规律,从而导致整个机体糖代谢紊乱和胰岛素抵抗。
虽然来曲唑造模法建立起来的PCOS大鼠模型表现出和人类PCOS相类似的代谢特征,包括体重增加、脂肪增多、肠系膜脂肪细胞增宽及一定程度胰岛素抵抗,但是仍不够典型,如本研究PCOS组糖耐量与胰岛素耐量曲线下面积、FINS以及HOMA-IR等指标较对照组高,但差异无统计学意义。故本研究在来曲唑造模的基础上,配合高脂膳食诱导法,成功诱导出与临床上PCOS胰岛素抵抗相类似的代谢表型:肥胖;糖耐量与胰岛素耐量曲线下面积增高,空腹胰岛素与胰岛素抵抗指数升高;脂质代谢紊乱,胆固醇与低密度脂蛋白升高等,上述指标PCOS-IR组与对照组比较,差异有统计学意义。
综上所述,来曲唑配合高脂膳食诱导法模型大鼠同时具有排卵障碍和卵巢多囊样改变、高雄激素血症、肥胖及胰岛素抵抗等PCOS的典型特征,较适合用于研究PCOS胰岛素抵抗动物模型。
参考文献:
[1]陈子江,石玉华.多囊卵巢综合征遗传学新认识[J].中华妇产科杂志, 2012, 47(1): 2-4.
[2] Sathyapalan T, Atkin SL. Recent advances in cardiovascular aspects of polycystic ovary syndrome[J]. Eur J Endocrinol, 2012, 166(4): 575-583.
[3] Jayasena CN, Franks S. The management of patients with polycystic ovary syndrome [J]. Nat Rev Endocrinol, 2014, 10 (10): 624-636.
[4] Maliqueo M, Benrick A, Stener-Victorin E. Rodent models of polycystic ovary syndrome: phenotypic presentation, pathophysiology, and the effects of different interventions[J]. Semin Reprod Med, 2014, 32(3): 183-193.
[5] Teede H, Deeks A, Moran L. Polycystic ovary syndrome:a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan[J]. BMC Med, 2010, (8): 41.
[6] Freeman R, Pollack R, Rosenbloom E. Assessing impaired glucose tolerance and insulin resistance in polycystic ovarian syndrome with a muffin test:an alternative to the glucose tolerance test[J]. Endocr Pract, 2010, 16(5): 810-817.
[7] Kafali H, Iriadam M, Ozardali I, et al. Letrozole-induced poly cystic ovaries in the rat: a new model for cystic ovarian disease[J]. Arch Med Res, 2004, 35(2): 103-108.
[8] Maliqueo M, Benrick A, Alvi A, et al. Circulating gonadotropins and ovarian adiponectin system are modulated by acupuncture independently of sexsteroid or β-adrenergic action in a female hyperandrogenic rat model of polycystic ovary syndrome[J]. Mol Cell Endocrinol, 2015, 412: 159-169.
[9]王慧兰,徐霞,郑志群.二甲双胍对多囊卵巢综合征大鼠的排卵及对卵巢中IL-6、TNF-α表达的影响[J].福建医科大学学报, 2013, 47(5): 288-292.
[10]杨宇峰,王莉,石岩,等.脾气虚证2型糖尿病大鼠模型的复制[J].辽宁中医杂志, 2015, 40(12): 2590-2592.
(申海菊编辑)
Glucose and lipid metabolism in Letrozole and high-fat diet induced PCOS-IR rats*
Ying Lin1, Hong Zhang1, Ming-qing Huang2, Zhi-wen Yu2, Feng Ji2, Li-shan Huang2, Juan Yang3, Jin-bang Xu3
(1. Guangzhou University of Traditional Chinese Medicine, Guangzhou, Guangdong 510006, China; 2. Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian 350122, China; 3. Fujian Maternity and Children Health Hospital, Fuzhou, Fujian 350001, China)
Abstract:Objective To investigate glucose and lipid metabolism in Letrozole and high-fat diet (HFD) induced polycystic ovary syndrome-insulin resistance (PCOS-IR) rats. Methods Twenty-four female SD rats of 3 weeks were randomly divided into 4 groups: control group, HFD group, PCOS group and PCOS-IR group. The rats in the HFD group and the PCOS-IR group were fed with high-fat diet for 12 weeks, while those of the control group and PCOS group were fed with normal diet. At the age of 6 weeks, the PCOS and PCOSIR groups received Letrozole intragastric administration for 9 weeks. The changes in weight and ovarian mor-book=10,ebook=16phology were observed; blood lipid, blood fasting plasma glucose (FPG), blood fasting insulin (FINS) and homeostasis model of assessment for insulin resistence index (HOMA-IR) were determined; and intraperitoneal glucose tolerance test (IPGTT) and insulin tolerance test were conducted in all the groups. Results Compared with the control and HFD groups, the PCOS and PCOS-IR groups showed polycystic ovaries with high incidence of atretic follicle and ovarian cyst together with decreased layers of granulosa cells and no corpora lutea. Compared with the control group, the PCOS-IR group exhibited increased weight (P= 0.000) with higher total cholesterol concentration (P<0.05) and low-density lipoprotein concentration (P<0.01), and increased AUC of IPGTT (P<0.05) and AUC of insulin tolerance (P<0.01). The PCOS-IR group also showed higher FINS concentration (P<0.01) and increased HOMA-IR(P<0.05). Conclusions Letrozole and high-fat diet can successfully induce typical metabolic phenotypes of insulin resistance in PCOS-IR rats.
Keywords:Letrozole; high-fat diet; glucose and lipid metabolism; insulin resistance; polycystic ovary syndrome
[通信作者]许金榜,E-mail:jinbangxu@yahoo.com
*基金项目:国家自然科学基金(No:81302998);福建省科技计划项目(No:2015Y0002);福建省中医药科研项目(No:wzfg201304);福建省卫生计生委青年科研课题(No:2014-1-20)
收稿日期:2015-07-08
文章编号:1005-8982(2016)03-0009-05
DOI:10.3969/j.issn.1005-8982.2016.03.002
中图分类号:R711.75
文献标识码:A
