消退素D1对百草枯致急性肺损伤大鼠肺泡表面活性物质与巨噬细胞的影响
2016-03-07索冬卫陈炅孙秋虹张玉华郑州大学第五附属医院河南郑州450052
索冬卫,陈炅,孙秋虹,张玉华(郑州大学第五附属医院,河南郑州450052)
消退素D1对百草枯致急性肺损伤大鼠肺泡表面活性物质与巨噬细胞的影响
索冬卫,陈炅,孙秋虹,张玉华
(郑州大学第五附属医院,河南郑州450052)
摘要:目的探讨消退素D1对于百草枯诱导的急性肺损伤大鼠体内肺泡表面活性物质水平和肺泡巨噬细胞功能的影响。方法将90只健康雄性SD大鼠完全随机分为3组:对照组(C组:生理盐水2.5 ml/kg、生理盐水2.5 ml/kg)、百草枯组(P组:百草枯60 mg/kg、生理盐水2.5 ml/kg)、消退素D1组(Rv组:百草枯60 mg/kg、消退素5μg/kg)。按照分组情况,每组分别给予规定量的生理盐水或百草枯灌胃造模,3 h后再给予规定量的生理盐水或消退素D1尾静脉注射。百草枯给药24 h后取大鼠肺脏组织,采用实时荧光定量PCR法检测其中肺泡表面活性蛋白A、B及C-mRNA的表达水平,采用BCA法测定肺泡灌洗液中总蛋白含量。采用体外培养的大鼠肺泡巨噬细胞研究消退素D1对其功能的影响。结果3组大鼠肺泡表面3种活性蛋白mRNA的表达差异有统计学意义,其中对照组大鼠肺泡表面活性蛋白的表达量最高,消退素D1组其次,百草枯组最低(P<0.05)。3组大鼠肺泡灌洗液中总蛋白含量差异均有统计学意义,其中消退素D1组大鼠灌洗液中总蛋白的含量最高,百草枯组其次,对照组最低(P<0.05)。加入百草枯的体外培养肺泡巨噬细胞的培养上清液中白细胞介素-6 (IL-6)、肿瘤坏死因子-α(TNF-α)和乳酸脱氢酶(LDH)含量增加(P<0.05),同时,消退素D1可以降低由于百草枯导致的IL-6、TNF-α和LDH含量的增加(P<0.05)。结论消退素D1可通过促进肺泡表面活性蛋白表达、抑制巨噬细胞分泌IL-6、TNF-α和LDH等炎症因子来达到治疗由百草枯导致的急性肺损伤的目的。
关键词:消退素D1;百草枯;急性肺损伤;巨噬细胞
百草枯,即1-1-二甲基-4-4-联吡啶阳离子盐,是一种快速灭生性除草剂,具有触杀作用和内吸入作用[1]。能迅速被植物绿色组织吸收,使其枯死,但对植物根部及多年生地下茎无效。百草枯对人畜具有很大的毒性作用,且尚无特效解毒药,有数据显示[2],口服百草枯的死亡率高达90%。肺部是百草枯主要的靶器官,它造成的急性肺损伤(acute pulmonary injury,ALI)是致死的主要原因[3]。ALI是指由于各种原因造成的毛细管内皮细胞和肺泡上皮细胞损伤,导致肺泡及肺间质水肿[4]。ALI的临床病死率很高,患者即使度过急性期,也有可能由于后续的肺纤维化导致死亡[5]。因此对与由百草枯造成的ALI的治疗方法还有待进一步探究。消退素D1(resolving D1,RvD1)是一种不饱和脂肪酸的衍生物,不仅可以抗炎,还具有促进炎症消退的作用。已有不少研究表明[6],RvD1对由脂多糖引发的肺水肿具有一定的治疗作用,可降低其致死率。本研究旨在探讨消退素D1对百草枯诱导的急性肺损伤大鼠体内肺泡表面活性物质水平和肺泡巨噬细胞功能的影响。以期为将来百草枯中毒的治疗提供一定的研究参考。
1 资料与方法
1.1一般资料
选择一级雄性SD大鼠95只。月龄2.5~4.0个月,平均(3.1±0.6)个月;体重(200±20)g,由郑州大学实验动物饲养中心提供。所有大鼠在研究期间均饲养与20~25℃条件下,给予普通颗粒饲料和自来水。所有大鼠月龄、体重等基本资料上差异无统计学意义(P<0.05)。将其中90只大鼠完全随机分为3组,每组30只:对照组:灌胃2.5 ml/kg生理盐水、3 h后再尾静脉注射2.5 ml/kg生理盐水;百草枯组:灌胃60 mg/kg百草枯、3 h后再尾静脉注射2.5 ml/kg生理盐水;消退素D1组:灌胃百草枯60 mg/kg、3 h后再尾静脉注射5μg/kg消退素D1溶液。所有大鼠均于灌胃给药后24 h处死,收集大鼠右肺组织,保存于-70℃环境下,用于检测其中肺泡表面活性蛋白(surfactant protein,SP)A、B及C-mRNA的表达水平;同时收集左肺肺泡灌洗液,离心过滤后取上清液,保存于-70℃环境下,用于测定肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中总蛋白(total protein,TP)含量。
另取5只大鼠,行肺泡巨噬细胞分离和体外培养实验。具体操作步骤为:收集健康大鼠的肺泡灌洗液,离心后收集细胞团,先将细胞团接种于含有血清的培养基中,当细胞生长一段时间后再将其接种于不含血清的培养基中。此时,将细胞随机分为3组:对照组:不添加任何药物;百草枯组:培养基中加入最终浓度为8 mg/L的百草枯溶液;消退素D1组:培养基中加入最终浓度为8 mg/L的百草枯溶液和4 mmol/L的消退素D1。无血清培养基在37℃条件下培养4 h后,收集其上清液用以测定其中白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-)和乳酸脱氢酶(lactate dehydrogenase,LDH)含量。
1.2研究方法
1.2.1材料与试剂荧光定量PCR仪器(北京百泰克生物技术有限公司,BTK-6系列),RNA提取试剂盒,RP5101(北京百泰克生物生物技术有限公司),逆转录试剂盒All-in-OneTMFirst-Strand cDNA Synthesis Kit,AORT-0020(广州锦生物技术有限公司),荧光定量PCR检测试剂盒Fast Fire qPCR Pre Mix(SYBR Green),FP207[天根生化科技(北京)有限公司],BCA试剂盒(北京四正柏生物科技有限公司),大鼠IL-6、TNF-α和LDH ELISA试剂盒(上海酶联生物科技有限公司)。
1.2.2SP-A、SP-B及SP-C mRNA表达水平检测首先,提取目标RNA。采用RNA提取试剂盒在严格的无RNA酶和无菌条件下按照试剂盒操作步骤提取RNA。注意提取过程保持低温,防止RNA降解。采用琼脂凝胶电泳检测提取RNA的完整性。而后采用逆转录试剂盒逆转录合成cDNA第一链,在严格的无菌条件下按照试剂盒标示剂量加入所有试剂。随后在40℃条件下孵育45 min,紧接着用90℃高温失活逆转录酶。最后,采用Quant Studio3型实时荧光定量PCR系统(赛默飞世尔科技公司)扩增和定量检测标本中SP-A、SP-B和SP-C mRNA的表达量。
1.2.3BALF中TP检测使用4℃的生理盐水经导管注入大鼠左肺,用量为10 ml/kg,按摩左肺5 min左右,抽出其中的生理盐水并收集,重复该过程5次,得到BALF,采用BCA试剂盒检测其中TP含量,按照BCA试剂盒步骤严格操作。
1.2.4细胞培养上清液中IL-6、TNF-α和LDH含量检测无血清培养基在37℃条件下培养4 h后,收集其上清液,使用大鼠IL-6、TNF-α和LDH ELISA试剂盒测定其含量。
1.3统计学方法
采用SPSS 17.0统计软件对本研究各组各项指标间的差异进行分析评价。对3组大鼠的所有生理指标用方差进行分析处理,P<0.05为差异有统计学意义。
2 结果
2.1SP-A、SP-B及SP-C mRNA表达水平
3组大鼠3种肺泡表面活性蛋白的mRNA表达水平对比见表1。通过比较,3组大鼠的肺泡表面活性蛋白mRNA表达量间差异有统计学意义(P<0.05),其中,对照组大鼠的肺泡表面活性蛋白mRNA表达量最高,消退素D1组大鼠次之,百草枯组大鼠最低。
2.2BALF中总蛋白含量
3组大鼠肺泡灌洗液中总蛋白含量对比见表2。通过比较,3组大鼠BALF中TP含量之间差异有统计学意义(P<0.05),其中,对照组大鼠的TP含量最低,消退素D1组大鼠次之,百草枯组大鼠最高。
2.3IL-6、TNF-α和LDH含量
3组大鼠肺泡巨噬细胞体外培养液中IL-6、TNF-α和LDH含量对比见表3,3组大鼠肺泡巨噬细胞体外培养液中IL-6、TNF-α和LDH含量之间差异存在统计学意义(P<0.05),其中,对照组大鼠的三者含量最低,消退素D1组大鼠次之,百草枯组大鼠最高。
3 讨论
本研究对大鼠急性肺损伤造模时,并没有选用现在大量肺损伤研究造模时用到的脂多糖,而选用的是百草枯。这主要是由于百草枯在造成人畜中毒时,主要的损伤部位就是肺脏,同时现在临床上对百草枯中毒的解救还没有找到特效药,百草枯造成肺损伤的机制也尚不清楚。因此,本研究使用百草枯造模后再用消退素D1解救,以期可以发现解救百草枯造成的急性肺损伤的更加有效的方法。
表1 SP-A、SP-B及SP-C mRNA表达水平(n=30±s)
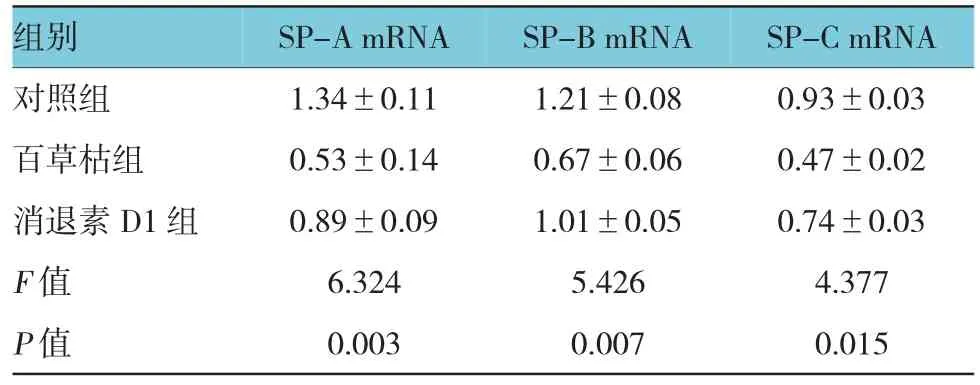
表1 SP-A、SP-B及SP-C mRNA表达水平(n=30±s)
组别 SP-A mRNA SP-B mRNA SP-C mRNA对照组 1.34±0.11 1.21±0.08 0.93±0.03百草枯组 0.53±0.14 0.67±0.06 0.47±0.02消退素D1组 0.89±0.09 1.01±0.05 0.74±0.03 F值 6.324 5.426 4.377 P值 0.003 0.007 0.015
表2 BALF中总蛋白含量(±s)

表2 BALF中总蛋白含量(±s)
组别 例数 TP/(g/L)对照组 30 0.31±0.04百草枯组 30 0.84±0.10消退素D1组 30 0.51±0.06 F值 5.013 P值 0.008
表3 IL-6、TNF-α和LDH含量(n=30±s)
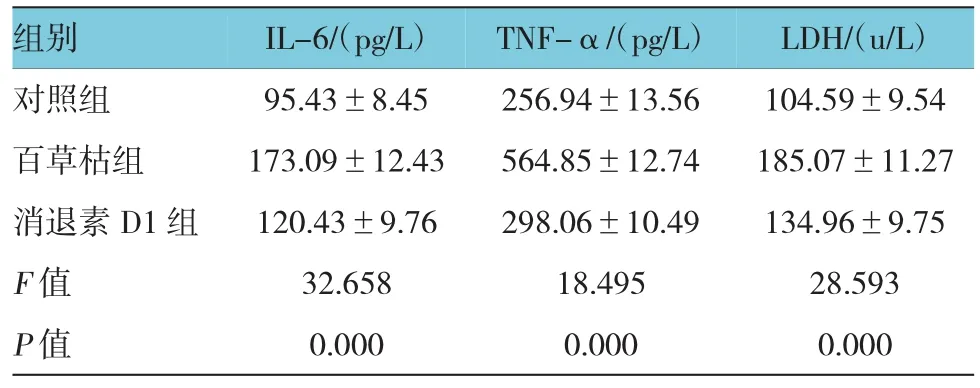
表3 IL-6、TNF-α和LDH含量(n=30±s)
组别 IL-6/(pg/L) TNF-α/(pg/L) LDH/(u/L)对照组 95.43±8.45 256.94±13.56 104.59±9.54百草枯组 173.09±12.43 564.85±12.74 185.07±11.27消退素D1组 120.43±9.76 298.06±10.49 134.96±9.75 F值 32.658 18.495 28.593 P值 0.000 0.000 0.000
急性肺损伤中的重要一环就是肺泡表面活性物质的合成减少和破坏,肺泡表面活性物质包括磷脂和蛋白,本研究主要关注3种表面活性蛋白SP-A,SP-B和SP-C。这3种蛋白中,SP-A是亲水性蛋白[7],主要功能为免疫防御,它可以与进入肺部的微粒和微生物等结合,协助吞噬细胞完成吞噬过程,它同时还可以抑制多种炎症因子的释放。SP-B和SP-C是亲脂性蛋白[8],主要功能是保持肺泡表面张力,帮助维持磷脂分子在肺泡表面的正常排列,保持肺泡不坍塌。当发生急性肺损伤时,这3种蛋白将受到不同程度的影响。从本研究中可以看出,由百草枯诱导的急性肺损伤中,这3种蛋白的mRNA表达水平都明显降低。但同时,笔者也观察到,在肺泡灌洗液中,总蛋白的含量在百草枯组是远高于对照组的。这是由于急性肺损伤会造成肺-血屏障被破坏,本来处于肺组织中的表面活性蛋白外溢,出现在血清中。现在,已经有越来越多的临床工作者提议将血清中SP-A、SP-B和SP-C这3种蛋白在血清中的水平作为诊断肺损伤的依据之一[9]。急性肺损伤时,肺组织细胞的这些改变与炎症因子的大量释放和ROS的大量释放有关。笔者从结果中可以发现,百草枯导致体外培养的肺泡巨噬细胞释放IL-6、TNF-α和LDH。
如前所述,急性肺损伤时,肺组织细胞的这些改变与炎症因子的大量释放和ROS的大量释放有关。消退素D1是一种不饱和脂肪酸的衍生物,有研究表明[10],RvD1可以促进血红素氧合酶HO-1的生成和表达。OH-1可以通过促进cGMP的生成激活细胞保护通路。该通路已被证实广泛的存在于损伤细胞中[11]。从本研究中可以发现,给予RvD1治疗的大鼠,在百草枯造成急性肺损伤以后,出现3种肺泡表明活性蛋白mRNA表达水平上升,肺泡灌洗液中总蛋白含量降低,同时体外培养的肺泡巨噬细胞释放的炎症因子减少的现象。综上所述,RvD1对于百草枯中毒后改善肺部损伤具有积极作用。
参考文献:
[1] Palmer JL, Deburghgraeve CR, Bird MD, et al. Combined radiation and burn injury results in exaggerated early pulmonary inflammation[J]. Radiation Research: Official Organ of the Radiation Research Society, 2013, 180(3): 276-283.
[2] Battikha M, Sà L, Porter A. et al. Relationship between pulmonary function and exercise capacity in individuals with spinal cord injury[J]. American Journal of Physical Medicine and Rehabilitation, 2014, 93(5): 413-421.
[3] Stundner O, Taher F, Pawar A. Pulmonary complications after spine surgery[J]. World Journal of Orthopedics, 2012, 3(10): 156-161.
[4]黄莉,王美娟,陈正荣,等.肺表面活性物质蛋白C基因I73T突变相关性婴幼儿肺间质疾病一例并文献复习[J].中华儿科杂志, 2014, 52(11): 846-850.
[5]卢伟能,周伟,荣箫,等.早产儿采用不同方式气管内滴入肺表面活性物质前后脑电活动的变化[J].中华实用儿科临床杂志, 2014, 29(2): 126-129.
[6]王静,杜江,周细中,等.肺表面活性物质相关蛋白C原核表达载体的构建、表达及纯化[J].中国组织工程研究, 2012, 16(15): 2699-2703.
[7]杨一民.气管插管-肺表面活性物质-拔管后经鼻持续正压通气模式治疗新生儿呼吸窘迫综合征的临床疗效研究[J].中国全科医学, 2013, 16(10): 1134-1136.
[8]李倬哲,瞿介明,何礼贤,等.免疫受损大鼠铜绿假单胞菌肺部感染后肺表面活性物质的改变[J].中华结核和呼吸杂志, 2001, 24(4): 204-207.
[9]李立萍,张建新,李兰芳,等.氨基胍对脂多糖诱导的大鼠肺表面活性物质和肺泡巨噬细胞的影响[J].中国药理学通报, 2009, 25(7): 876-880.
[10]张德明,李永旺,毛宝龄,等. LPS急性肺损伤大鼠肺巨噬细胞TLR4与IL-18 mRNA表达的变化[J].中国病理生理杂志, 2003, 19(5): 589.
[11]张凤,潘秀颉,杨陟华,等.香烟凝集物诱导大鼠肺巨噬细胞细胞因子释放及调控研究[J].中国科技博览, 2009(21): 180-181.
(王荣兵编辑)
Effect of resolvin D1 on surfactant and alveolar macrophages in rats with Paraquat-induced acute pulmonary injury
Dong-wei Suo, Hao Chen, Qiu-hong Sun, Yu-hua Zhang
(The Fifth Affiliated Hospital of Zhengzhou University, Zhengzhou, Henan 450052, China)
Abstract:Objective To investigate the effect of resolvin D1 on pulmonary surfactant and alveolar macrophages (AM) in rats with pulmonary injury which was induced by Paraquat. Methods Ninety rats with pulmonary injury were randomly divided into 3 groups: control group (group C, normal saline, normal saline), Paraquat group (group P, Paraquat, normal saline) and resolvin D1 group (group Rv, Paraquat, resolvin D1). According to the grouping information, normal saline or Paraquat was given for modeling, and 3 hours later resolvin D1 or normal saline was given for treatment. The rat lung tissues were collected 24 hours after modeling to detect the mRNA expression levels of of surfactant proteins A, B and C using RT-PCR. The total protein in the bronchial alveolar lavage fluid (BALF) was also detected. The effect of resolvin D1 on AM was measured on isolated rat AM. Results The expression of three surfactant protein mRNAs in the three groups was different, where the expression level was the highest in the group C, the second in the group Rv, and the lowest in the group P(P<0.05). The total protein content in BALF was also different, where it was thebook=24,ebook=30highest in the group C, the second in the group Rv, and the lowest in the group P (P<0.05). The content of IL-6, TNF-α and LDH increased when Paraquat was added to in vitro culture medium (P<0.05); while adding resolvin D1 reversed it (P<0.05). Conclusions Resolvin D1 can help to treat pulmonary injury induced by Paraquat through boosting the expression of surfactant proteins and inhibiting the release of IL-6, TNF-α and LDH.
Keywords:resolvin D1; Paraquat; pulmonary injury; alveolar macrophage
收稿日期:2015-09-17
文章编号:1005-8982(2016)03-0023-04
DOI:10.3969/j.issn.1005-8982.2016.03.005
中图分类号:R563.1
文献标识码:A
