非生物因子胁迫对何首乌二苯乙烯苷含量的影响
2016-03-01刘红昌李金玲王华磊罗春丽
张 先, 刘红昌, 李金玲, 王华磊, 罗春丽, 赵 致*
(1.贵州大学 资助管理中心, 贵州 贵阳 550025; 2.贵州省药用植物繁育与种植重点(工程)实验室, 贵州 贵阳 550025)
非生物因子胁迫对何首乌二苯乙烯苷含量的影响
张 先1, 刘红昌2, 李金玲2, 王华磊2, 罗春丽2, 赵 致2*
(1.贵州大学 资助管理中心, 贵州 贵阳 550025; 2.贵州省药用植物繁育与种植重点(工程)实验室, 贵州 贵阳 550025)
为探明何首乌主要活性成分二苯乙烯苷在非生物因子胁迫下的变化,为人工栽培调控提供参考。采用UV-C照射、茉莉酸甲酯和乙烯利喷施胁迫处理遗传背景一致的何首乌组培苗。结果表明:用茉莉酸甲酯溶液处理何首乌组培苗,0.20×10-3mol/L溶液能有效诱导二苯乙烯苷的产生,根中的二苯乙烯苷含量增加极显著,茎中略有下降,叶中略有升高,但不显著;0.25×10-3mol/L溶液抑制根、茎中的二苯乙烯苷的生物合成,且根中的下降量与对照相比达极显著水平,叶中的量略有增加,但不显著。用乙烯利溶液喷施何首乌组培苗,250 mg/L溶液处理的组培苗根和茎中的二苯乙烯苷增加量与对照相比达极显著水平,叶中略有升高,但不显著;300 mg/L溶液处理根和茎中的二苯乙烯苷的生物合成均受抑制,且根中的下降量与对照相比达极显著水平,叶中含量略微增加,但不显著。用UV-C照射刺激何首乌组培苗,10 min/d持续处理5 d,何首乌植株根、茎中二苯乙烯苷的生物合成均被抑制,与对照相比达极显著水平,叶中略有上升但不显著;20 min/d处理5 d时,何首乌植株根、茎、叶中的二苯乙烯苷的生物合成均被抑制,且与对照相比,根和茎中的下降量均达极显著水平。二苯乙烯苷作为茋类化合物,在外界因子胁迫下其生物合成会被诱导合成或抑制。
何首乌; 二苯乙烯苷; 茋类化合物; 非生物因子
茋类化合物是一类具有二苯乙烯母核的物质总称,目前已在葡萄、花生和松树等多个科属的植物中分离鉴定得到,其多是在受到紫外照射、化学因素(如O3、表面活性剂、抗生素、部分植物激素等)、病原菌侵染等各种诱发因子作用下被诱导合成,具有提高植物抗性的作用,被视为一种重要的植保素[1-2]。另外,茋类化合物对于人类也有很好的保健作用,其中研究最深入的白藜芦醇被广泛用于抗肿瘤、降血脂、降血压、保护心血管及神经系统等的保健治疗[3]。二苯乙烯苷作为茋类化合物的重要成员,目前已有大量文献对其进行了研究报道,现代药理研究表明,二苯乙烯苷具有抗氧化清除自由基、抗衰老、保护肝脏、提高记忆功能、血管舒张等药理作用[4]。二苯乙烯苷作为茋类化合物是否也如白藜芦醇、赤松素等茋类化合物一样,作为一种植保素在植物受到外界非生物因子或生物因子胁迫下产生,目前还不清楚。为了探究非生物因子对何首乌二苯乙烯苷合成的影响,以及为下一步从转录组水平研究非生物因子胁迫导致的转录差异,采用UV-C不同时间照射处理、茉莉酸甲酯和乙烯利不同浓度喷施处理何首乌组培苗,检测非生物因子胁迫下何首乌二苯乙烯苷含量的变化情况,为何首乌生产中人工调控其二苯乙烯苷含量以及下一步从转录组水平研究其转录差异奠定基础。
1 材料与方法
1.1 试验材料
何首乌:于2010年采自贵州省施秉县何首乌GAP基地,并种植于贵州大学教学试验场大棚内,该何首乌于1994年引种自广东德庆县,经贵阳中医学院药学院鉴定为蓼科(Polygonaceae)蓼属(Polygonum)植物何首乌(PolygonummultiflorumThunb.)。
试剂:二苯乙烯苷(生产批号110844-201109)标品购自中国药品生物制品检定所,茉莉酸甲酯(产品编号392707-5,含量≥95.0%)和乙烯利(产品编号090M1155V)均购自Sigma,色谱纯乙腈购自Fisher公司,超纯水,其余试剂均为分析纯。
仪器:Agilent1260型高效液相色谱仪(四元泵、DAD检测器及配套色谱工作站),万分之一天平(丹佛仪器有限公司),KQ-800KDE型高功率数控超声波清洗器(昆山市超声波仪器有限公司),灭菌锅,超净工作台,回流装置等。
1.2 组培苗的培养及其胁迫试验
于2010年3月上旬,取大棚内生长健壮的何首乌植株带芽茎段作为外植体,在9:00左右取材。外植体用自来水冲洗3~4 h后,于超净工作台上用75%酒精浸泡15~20 s,无菌水冲洗4次,0.1%升汞溶液浸泡8 min,再无菌水冲洗5次,取出外植体用无菌吸水纸吸干表面水分,接种至已备好的MS+2 mg/L 6-BA长丛生芽培养基中培养31 d。待茎段长出大量丛生芽后,将丛生芽转接至1/2 MS+0.2 mg/L NAA+1.5 mg/L多效唑(Paclobutrazol)生根培养基中,每个培养瓶中接丛生芽5株,将培养瓶置于(25±2)℃、光照强度为2 000 lx、光照时间为12 h/d的组培室中培养60 d,植株带3~4片叶,高8~10 cm,根长2~3 cm即为遗传背景一致的何首乌组培苗。当组培苗群体建成后,用UV-C照射、MeJA溶液喷施和乙烯利溶液喷施3种非生物因子进行胁迫处理,处理后的培养条件仍同上。
1.2.1 UV-C照射 采用单因素两水平试验,即用UV-C照射10 min/d和20 min/d,连续处理5 d,然后继续培养30 d。紫外灯功率30 W,波长254 nm,组培苗植株离灯距离40 cm,照射时揭开封口膜,每次照射时把培养瓶混排,保证照射均衡性。以相同功率日光灯照射处理的组培苗作为对照。试验操作于上午9时左右进行,重复3次,每个重复30株苗。培养30 d后取样,检测二苯乙烯苷含量变化。
1.2.2 喷施MeJA溶液 设单因素2水平试验,即分别用0.20×10-3mol/L和0.25×10-3mol/L1的茉莉酸甲酯溶液喷施何首乌组培苗。茉莉酸甲酯因难溶于水,应先用少量0.1%乙醇溶解后加蒸馏水至所需浓度,其中含0.1%(v/v)植物细胞活性剂TritonX-100,溶液配好后经0.22 μm一次性滤膜过滤灭菌置于无菌的小喷壶中备用,每个培养瓶喷施2 mL茉莉酸甲酯溶液。喷施时,每片叶均需喷到且喷均匀,以未加茉莉酸甲酯的溶液喷施的组培苗作对照。试验操作在上午9时左右进行,3次重复,每个重复30株组培苗。喷施后继续培养30 d,然后取样检测二苯乙烯苷含量变化。
1.2.3 喷施乙烯利溶液 采用单因素2水平试验,即分别用250 mg/L和300 mg/L的乙烯利溶液喷施何首乌组培苗。乙烯利溶液中含有0.1%(v/v)植物细胞活性剂Triton X-100,溶液配至所需浓度后经0.22 μm一次性滤膜过滤灭菌置于无菌的小喷壶中备用。其余试验操作同茉莉酸甲酯溶液的处理方法。
1.3 检测样品的制备
将组培苗的根、茎、叶分开,105℃烘30 min,75℃烘36 h,置干燥器中保存备用。用研钵将已干燥样品磨至能过2号筛,万分之一天平称样0.5 g左右,记录到万分之一位,样品倒入锥形瓶,加入50%乙醇,静置过夜,称重,回流30 min,取出冷却、补重,最后取1 mL过0.22 μm油性有机滤膜,4℃条件下可贮存7 d备用。3次重复,每重复取植株30株。
1.4 色谱条件及标准曲线制作
色谱条件参照2010版中国药典[5]。色谱柱为Agilent SB-C18(4.6 mm×150 mm,5 μm)原装进口色谱柱,流动相为乙腈-水(25∶75),流速为1 mL/min,检测波长为320 nm,柱温25℃,进样量10 μL。
二苯乙烯苷标样原始浓度5 μg/mL,分别进样0.5 μL、1 μL、2 μL、4 μL、6 μL、8 μL、10 μL、12 μL、14 μL、16 μL、18 μL、20 μL、22 μL及24 μL,记录每次进样体积的色谱图,以横坐标数值为二苯乙烯苷浓度,纵坐标数值为二苯乙烯苷峰面积制作标准曲线图。线性方程为y=3601.2x-0.7196(R2=0.999 9),样品浓度在0.01~0.4 μg/mL范围呈良好的线性关系。
1.5 方法学考察
1.5.1 精密度试验 取同一供试品溶液,进样量10 μL,重复进样5次,记录二苯乙烯苷的保留时间和色谱峰面积并计算各自的相对标准偏差(RSD)。二苯乙烯苷保留时间变化范围为4.623~4.637 min,二苯乙烯苷重复5次的峰面积分别为269.93、274.86、275.35、269.74、270.12。保留时间RSD为0.19%,峰面积RSD(%)为1.05%。一般规定RSD窗口阀值<3%,表明试验所用设备精密度良好。
1.5.2 重现性试验 取0.20×103mol/L茉莉酸甲酯溶液处理根样平行制备6份供试品溶液,每份进样10 μL,记录二苯乙烯苷的保留时间和色谱峰面积并计算各自的RSD。二苯乙烯苷保留时间为4.628~4.641 min,6份平行样供试溶液中二苯乙烯苷的峰面积分别为111.31、117.17、114.50、117.21、117.14、113.54。保留时间RSD为0.49%,峰面积RSD为2.04%,均小于3%的RSD窗口阀值,表明样品重复性较好。
1.5.3 加样回收试验 取0.20×10-3mol/L茉莉酸甲酯溶液处理根样平行制备3份供试溶液,分别加入5 μg/mL二苯乙烯苷标液2 μL,分别进样10 μL,进行含量测定,计算回收率。经测定平均加样回收率达99.39%,表明试验条件稳定,可进行下一步操作。
1.5.4 最低检测限试验 分别进样二苯乙烯苷标液(5 μg/mL)0.1 μL、0.2 μL、0.3 μL,3次重复,进行二苯乙烯苷含量测定。当进样量为0.1 μL时,仪器未能检测出二苯乙烯苷。进样量0.2 μL时,检测出的二苯乙烯苷量为0.002 7 μg。即所测样品中二苯乙烯苷含量低于0.2 μL时,则不能被检测。
2 结果与分析
2.1 UV-C照射何首乌组培苗的二苯乙烯苷含量
由表1可知,UV-C照射处理10 min/d,持续进行5 d,与对照相比,何首乌组培苗根、茎中二苯乙烯苷的生物合成均受抑制,叶中则呈升高趋势,根、茎中二苯乙烯苷含量分别下降33.88%、55.73%,下降量达显著水平;叶中二苯乙烯苷含量上升21.05%,但不显著。当照射时间达20 min/d时,处理根、茎、叶中二苯乙烯苷含量分别下降35.48%、46.11%和39.13%,与对照比均达极显著水平。表明,一定剂量的UV-C照射会抑制何首乌根、茎中二苯乙烯苷的生物合成,超过一定剂量后叶中的合成也会受阻。
表1 UV-C照射何首乌组培苗的二苯乙烯苷含量
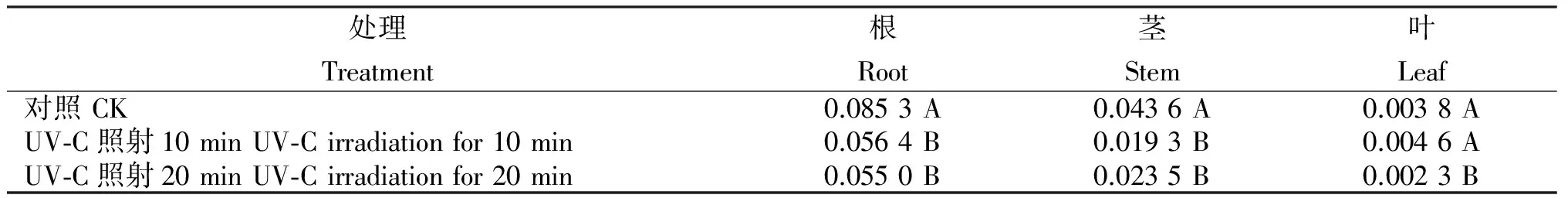
Table 1 Stilbene glucoside content of stibene glucoside in P. multiflorum tissue culture seedlings treated with UV-C irradiation %
注:表中同列大、小写字母分别表示差异极显著(P<0.01)和显著(P<0.05),下同。
Note: Different capital and lowercase letters in the same column indicated 1% and 5% significant levels respectively. The same below.
2.2 茉莉酸甲酯(MeJA)溶液喷施何首乌组培苗的二苯乙烯苷含量
表2结果明,与对照相比,0.20×10-3mol/L MeJA溶液喷施何首乌组培苗能显著提高根中二苯乙烯苷的生物合成,升高42.09%,差异极显著;茎中二苯乙烯苷含量对照和处理差异不大,处理略有下降(4.13%);叶中二苯乙烯苷含量略有升高(10.53%),但不显著。0.25×10-3mol/L MeJA处理根中的二苯乙烯苷含量极显著下降,下降率达47.06%;茎中二苯乙烯苷含量对照与处理差异不明显,处理略下降(10.34%);叶中二苯乙烯苷的含量对照与处理间差异也不大,处理略高,上升5.48%。
表2 (MeJA)溶液喷施何首乌组培苗的二苯乙烯苷含量
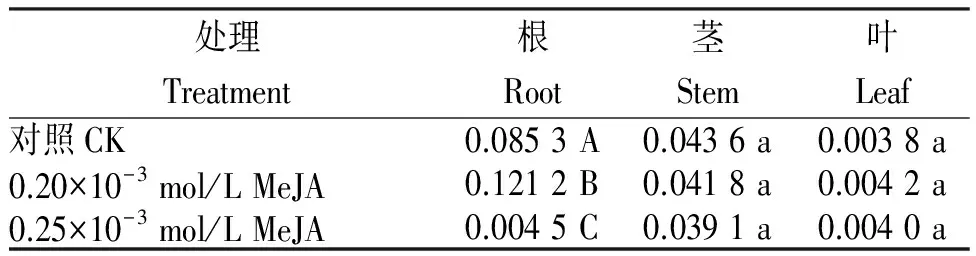
Table 2 Stilbene glucoside content in P.multiflorum tissue culture seedlings sprayed with MeJA solution %
2.3 乙烯利溶液喷施何首乌组培苗的二苯乙烯苷含量
由表3可知,250 mg/L的乙烯利溶液喷施处理何首乌组培苗能显著诱导根、茎的二苯乙烯苷的生物合成,叶的略有上升,但不显著,其中,根增加47.65%,茎增加38.97%,叶增加18.92%。当乙烯利溶液喷施浓度提高到300 mg/L时,处理根、茎中的二苯乙烯苷含量极显著降低,根的下降达45.02%,茎下降25.69%;叶的变化差异不大,上升18.42%。
表3 乙烯利溶液喷施何首乌组培苗的二苯乙烯苷含量
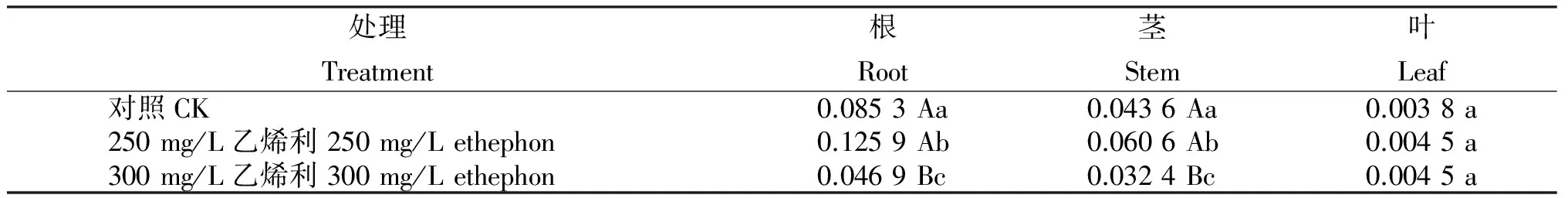
Table 3 Stilbene glucoside content in P.multiflorum tissue culture seedlings sprayed with ethephon solution %
3 结论与讨论
1)试验结果表明,一定浓度的茉莉酸甲酯和乙烯利溶液能有效诱导何首乌中二苯乙烯苷的生物合成,超过一定浓度限度后反而会抑制二苯乙烯苷的产生,此研究结果与在葡萄系列种质中的研究结果一致[6-8]。同时,不论是诱导二苯乙烯苷的生物合成还是抑制其产生,反应最敏感的器官首先是根,其次是茎,叶的反应较迟钝。这为后面利用何首乌的根从转录组水平上探索二苯乙烯苷生物合成相关基因进一步提供了参考。
2) UV-C能有效提高花生、葡萄等植物中的茋类化合物的含量[9-11]。本试验中,UV-C照射何首乌组培苗10 min/d和20 min/d,持续处理5 d,根、茎、叶中除叶照射10 min/d外,各处理器官中的二苯乙烯苷的生物合成均被抑制,原因可能是试验所用材料为组培苗,比较幼嫩,长时间紫外照射引起苗中二苯乙烯苷生物合成代谢最终受阻。
3) 二苯乙烯苷、茉莉酸甲酯、和乙烯利3种非生物因子诱导何首乌中二苯乙烯苷的生物合成结果表明,二苯乙烯苷应是一种诱导型化合物,其作为植物植保素茋类化合物的重要成员,当植株受到外界因素刺激时其合成代谢途径会迅速启动以抵御外界因素的刺激,从而避免植株受到进一步伤害[12];但不论何种处理,叶均是作为主要受体,二苯乙烯苷作为一种植保素,为避免非生物因子对何首乌的进一步损伤,其生物合成途径理应在叶中迅速启动并大量积累,但二苯乙烯苷含量变化最大的却是根,其次是茎。因此,推测二苯乙烯苷的主要合成部位可能在根部。
[1] Jeandet P, Douillet-Breuil A C, Bessis R,et al. Phytoalexins from the Vitaceae: biosynthesis, phytoalexin gene expression in transgenic plants, antifungal activity, and metabolism[J].J Agric Food Chem,2002,50(10):2731-2741.
[2] 生书晶,赵树进.茋合酶基因的分子生物学研究[J].生物技术通报,2009(11):24-29.
[3] Delaunois B,Cordelier S,Conreux A,et al. Molecular engineering of resveratrol in plants[J].Plant biotechnology journal,2009,7(1):2-12.
[4] 吕丽爽.何首乌中二苯乙烯苷的研究进展[J].食品科学,2006,27(10):608-612.
[5] 国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2010:165.
[6] Belhadj A, Telef N, Cluzet S, et al. Ethephon elicits protection against Erysiphe necator in grapevine[J].Journal of agricultural and food chemistry,2006,56(14):5781-5787.
[7] Faurie B, Cluzet S, Corio-Costet M F, et al.Methyl jasmonate/ethephon cotreatment synergistically induces stilbene production inVitisviniferacell suspensions but fails to trigger resistance to erysiphe necator[J].Journal international des sciences de la vigne et du vin,2009,43(2):99-110.
[8] Santamaria A R, Antonacci D, Caruso G, et al. Stilbene production in cell cultures ofVitisviniferaL. cvs Red Globe and Michele Palieri elicited by methyl jasmonate[J].Natural product research,2010,24(15):1488-1498.
[9] Guerrero R F, Puertas B, Fernandez M I, et al. Induction of stilbenes in grapes by UV-C: Comparison of different subspecies of Vitis [J].Innovative food science and emerging technologies,2010,11(1):231-238.
[10] Tang K, Zhan J C, Yang H R, et al. Changes of resveratrol and antioxidant enzymes during UV-induced plant defense response in peanut seedlings[J].Journal of plant physiology,2010,167(2):95-102.
[11] Wang W, Tang K, Yang H R, et al. Distribution of resveratrol and stilbene synthase in young grape plants (VitisviniferaL. cv. Cabernet Sauvignon) and the effect of UV-C on its accumulation[J].Plant physiology and biochemistry,2010,48(2-3):142-152.
[12] Vannozzi A, Dry I B, Fasoli M, et al. Genome-wide analysis of the grapevine stilbene synthase multigenic family: genomic organization and expression profiles upon biotic and abiotic stresses[J].BMC Plant Biology,2012,12:130.
(责任编辑: 聂克艳)
Effects of Abiotic Factors Stress on Stilbene Glucoside Content inPolygonummultiflorum
ZHANG Xian1, LIU Hongchang2, LI Jinling2, WANG Hualei2, LUO Chunli2, ZHAO Zhi2*
(1.StudentFinancialAssistanceManagementCenter,GuizhouUniversity,Guiyang,Guizhou550025; 2.GuizhouKey(Engineering)LaboratoryofPropagationandCultivationonMedicinalPlants,Guiyang,Guizhou550025,China)
In order to explore the changes of the main active component stilbene glucoside inP.multiflorumunder abiotic factors stress, and provide references for artificial cultivation regulation, tissue culture seedlings with the same genetic backgrounds were treated with UV-C irradiation,MeJA and ethephon. Results: Applying 0.20×10-3mol/L MeJA solution could effectively induce the produce of stilbene glucoside, very significantly increase the content of stilbene glucoside in root, slightly decrease the content in stem and increase the content in leaf with no significant difference. Applying 0.25×10-3mol/L MeJA solution inhibited the biosynthesis of stilbene glucoside in root and stem, the decrement in root reached the very significant level compared with the control. The content in leaf increased with no significant difference. Applying 250 mg/L ethephon solution very significantly increased the content of stilbene glucoside in root and stem compared with the control, and the content in leaf increased with no significant difference. Applying 300 mg/L ethephon solution inhibited the biosynthesis of stilbene glucoside in root and stem. And very significantly decreased the content in root compared with the control, slightly increase the content in leaf. 10 min/d UV-C irradiation for five days inhibited the biosynthesis of stilbene glucoside in root and stem very significantly compared with the control. The content in leaf slightly increased. 20 min/d UV-C irradiation for five days inhibited the biosynthesis of stilbene glucoside in root, stem and leaf. The decrement in root and stem reached the very significant level. As one kind of stilbenes, its biosynthesis could be induced or inhibited under stress of external factors.
Polygonummultiflorum; stilbene glucoside; stilbenes; abiotic factors
2015-09-19; 2016-04-13修回
国家科技支撑计划子课题“何首乌种质资源遗传多样性及优良种源筛选研究”(2009BAI74B01)
张 先( 1981-),女,讲师,硕士,从事药用植物资源及次生代谢研究。E-mail: yelang7113@163.com
*通讯作者:赵 致(1959-),男,教授,从事药用植物生理生态及其栽培研究。E-mail: zzhao@ gzu.edu.cn
1001-3601(2016)04-0173-0116-04
S567.1+9
A
