PEG-CaCl2介导牛樟芝遗传转化体系的构建
2016-03-01林雄杰林冬梅鲁国东林占熺
李 晶, 林雄杰, 林冬梅, 鲁国东, 林占熺*
(1.国家菌草工程技术研究中心, 福建 福州 350002; 2.福建农林大学 菌草研究所, 福建 福州 350002; 3.福建省农业科学研究院 果树研究所, 福建 福州 350013)
PEG-CaCl2介导牛樟芝遗传转化体系的构建
李 晶1,2, 林雄杰3, 林冬梅1,2, 鲁国东1, 林占熺1,2*
(1.国家菌草工程技术研究中心, 福建 福州 350002; 2.福建农林大学 菌草研究所, 福建 福州 350002; 3.福建省农业科学研究院 果树研究所, 福建 福州 350013)
为建立稳定的牛樟芝(Antrodiacinnamomea)遗传转化体系,同时筛选出适宜介导牛樟芝原生质体转化的PEG-CaCl2浓度。利用潮霉素抗性、绿色荧光蛋白(Green Fluorescent Protein,GFP)标记和PCR扩增验证拟转化子。结果表明:新鲜的牛樟芝菌丝体在10 mg/mL溶壁酶溶液中,30℃条件下酶解4 h,原生质体的获得率为3.55×105个/mL;菌丝体和原生质体在潮霉素B浓度分别为60 μg/mL和40 μg/mL时不能生长,最终确定筛选拟转化子的潮霉素B浓度为60 μg/mL;浓度为20%~40%的PEG均可介导牛樟芝原生质体转化,且40%的PEG转化效率最高。
牛樟芝; 原生质体; 聚乙二醇; 潮霉素B; 重组子
真菌是世界第二大类生物,主要分成微生物和大型真菌(食、药用菌)两类[1]。牛樟芝(Antrodiacinnamomea)是我国台湾特有的珍稀药用菌,属担子菌门(Basidiomycota)、多孔菌目(Polyporales)、白肉迷孔菌科(Fomitopsidaceae)、薄孔菌属(Antrodia),最早发现生长在腐烂的空心牛樟树(Cinnamomumkanehirai)内壁,长期以来,牛樟树被认为是牛樟芝的唯一宿主[2-3]。牛樟芝味苦,含有大量的三萜类、酚类和多糖类等物质[4],对抗过敏、抗炎症、抗氧化、抗肿瘤、保肝和提高免疫力等具有显著功效[5-7]。
转化是将外源DNA通过载体、媒介,以物理、化学等方法导入受体细胞,并完整表达的过程[8];食药用菌属担子菌类,难以被转化。关于食药用菌转化的研究始于20世纪90年代,利用电击和基因枪等不同转化方法提高双孢蘑菇(Agaricusbisporus)[9]和杨树菇(Agrocybeaegerita)[10]原生质体转化效率,但外源DNA整合重组后活性较低,异源启动子不能有效调控外源基因表达,易出现假阳性等现象。但随着技术的不断发展,草菇[11-12]、香菇[13-14]、灵芝[15-16]、平菇[17]和猴头菇[18]等经济菌类通过改进转化技术均成功建立了遗传转化体系。绿色荧光蛋白(Green Fluorescent Protein,GFP)最早在水母中发现并分离,该蛋白在紫外光或蓝光激发下发荧光,并发现其在无任何底物和辅助因子的情况下也能在活细胞中发荧光[19-21],故用于细胞和蛋白质标记。在牛樟芝遗传转化体系中,利用GFP标记的载体转入牛樟芝原生质体中,能快速筛选并确定转化子,具有高效、稳定等特征。
随着牛樟芝的分类和生物学特性研究的不断深入,陆续开展了其药理学、质量控制、栽培条件和分子生物学等方面的研究[22],而牛樟芝分子生物学的前提条件是必需建立稳定的遗传转化体系。目前,李刚[23]建立灵芝原生质体转化体系,并连续培养5代以上仍可以稳定表达潮霉素抗性;张新涛等[24]建立了我国传统药用菌灵芝的遗传转化体系,但国内外对牛樟芝遗传转化体系的研究鲜见报道,笔者利用PEG-CaCl2介导建立的牛樟芝遗传转化体系,并通过GFP标记对其进行验证,为深入开展分子生物学研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株及质粒 台湾牛樟芝菌株AC 001(Genbank Accession NO.:KM925002),由台湾神农真菌生物技术有限公司惠赠,保存于福建农林大学菌草研究所;pCX62为含抗潮霉素抗性标记质粒载体,pCT74为含抗潮霉素抗性和GFP标记质粒载体[25]均由福建农林大学功能基因组学研究中心提供。
1.1.2 培养基及常用溶液 牛樟芝液体培养基:葡萄糖25 g,蛋白胨5 g,麦芽糖3 g,酵母提取物3 g,KH2PO41 g,MgSO4·7H2O 1 g,维生素B11 g,蒸馏水定容至1 L,pH 5.5;牛樟芝固体培养基:葡萄糖25 g,蛋白胨5 g,麦芽糖3 g,酵母提取物3 g,KH2PO41 g,MgSO4·7H2O 1 g,维生素B11 g,琼脂20~25 g,蒸馏水定容至1 L,pH 5.5;马铃薯培养基(PDA):马铃薯200 g(去皮切块加水煮30 min,用纱布过滤取滤液),葡萄糖20 g,琼脂20 g,蒸馏水定容至1 L;TB3再生培养基:酸水解酪蛋白3 g,酵母提取物3 g,蔗糖200 g,蒸馏水定容到1 L,配制固体培养基时加入琼脂粉10 g。0.6 mol/L甘露醇:109.302 g甘露醇,溶于适量去离子水中,定容到1 L;MTC缓冲液:10 mmol/L Tris-HCl(pH 7.5),10 mmol/L CaCl2,0.6 mol/L甘露醇;PEG溶液:取适量PEG4000,溶于适量dd H2O,定容到100 mL,现配现用;PEG-CaCl2溶液:适宜比例PEG溶液,10 mmol/L Tris-HCl,50 mmol/L CaCl2,现配现用;溶壁酶溶液(北京索莱宝生物科技有限公司):适量溶壁酶用0.6 mol/L甘露醇配置,现配现用;以上溶液均过滤除菌。
1.2 原生质体的制备与再生
1.2.1 原生质体的制备 在PDA上活化后的牛樟芝菌种接种至牛樟芝液体培养基中,28℃,120 r/min,黑暗培养14 d后在无菌条件下过滤收集菌丝体,研磨成匀浆状,取1 mL装入50 mL离心管中,用无菌水洗涤后7000 r/min,离心10 min,弃上清;其沉淀用0.6 mol/L甘露醇洗涤,7000 r/min,离心10 min,弃上清,1次重复;沉淀重悬于10 mL(浓度为10 mg/mL)的溶壁酶溶液中[26-27],于30℃,80 r/min酶解,2 h后用血球计数板对酶解程度进行镜检,直至大多数酶解为原生质体,确定最佳酶解时间。
将酶解产物过滤,除去未被酶解的菌丝体,滤液于7000 r/min离心机,离心20 min,弃上清液,沉淀用0.6 mol/L甘露醇和MTC缓冲液各洗涤1次后离心,弃上清;沉淀重悬于2 mL 含7%二甲基亚砜的0.6 mol/L甘露醇中,每管200 μL分装后置于-80℃超低温冰箱保存备用。
1.2.2 原生质体的再生 取上述制备的新鲜原生质悬浮液100 μL,涂布在TB3再生培养基平板上,于28℃恒温培养箱中黑暗倒置培养,14 d后按公式计算再生率:再生率=再生菌落总数/涂板原生质体总数×100%。
1.3 牛樟芝菌丝体及原生质体对潮霉素B的敏感性测定
1.3.1 牛樟芝菌丝体 将牛樟芝菌株分别接种到含潮霉素B浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL和120 μg/mL的固体培养基中央,每个浓度3次重复,以不加潮霉素B的平板作为对照;接种后置于28℃恒温培养箱黑暗培养14 d,观察并记录生长情况,筛选最适合的潮霉素浓度。
1.3.2 牛樟芝原生质体 牛樟芝原生质体悬浮液100 μL分别涂布于含潮霉素B浓度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL和120 μg/mL固体培养基中,每个浓度3次重复,以不加潮霉素B的平板作为对照;接种后在28℃、黑暗条件下培养14 d,观察并记录生长情况,筛选最适合的潮霉素B浓度。
1.4 质粒提取
质粒提取方法按照OMEAG质粒提取试剂盒说明操作。
1.5 PEG-CaCl2介导的原生质体转化
参照李刚[16]、刘莉[18]的方法,略加改进。取2管原生质体(200 μL/管),向其中一管加入50 μg质粒,另外一管加入等体积的0.6 mol/L甘露醇作对照,分别加入100 μL 0.6 mol/L甘露醇,轻微混匀后置冰上预冷5 min;再逐滴加入1 mL 20%、30%、40%、50%和60%的PEG-CaCl2溶液,轻微混匀后于冰上放置60 min,逐滴加入0.5 mL PEG-CaCl2溶液,室温放置30 min,再加入1 mL MTC缓冲液和5 mL牛樟芝液体培养基,28℃,85 r/min振荡培养48 h;取1 mL均匀涂布在含潮霉素B浓度为60 μg/mL的牛樟芝固体培养基平板中,28℃恒温箱中黑暗培养14 d。
1.6 牛樟芝转化子筛选及鉴定
分别进行pCX62和pCT74质粒转化。挑取在含潮霉素B浓度为60 μg/mL的牛樟芝固体培养基上正常生长的转化子视为拟定转化子,转接至含潮霉素B浓度为60 μg/mL的牛樟芝固体培养基上继续培养5代,挑选继续生长的拟定转化子进行液体扩大培养并收集菌丝体,采用CTAB法提取gDNA[28],进行潮霉素基因(hph)PCR扩增。引物序列分别为5′-GCCCTTCCTCCCTTTATT-3′和5′-TCCATCACAGTTTGCCAGT-3′,引物由铂尚生物技术(上海)有限公司合成。PCR反应体系为25 μL,扩增程序为95℃预变性3 min;94℃变性30 s,58.7℃退火30 s,72℃延伸40 s,32个循环;72℃延伸7 min,PCR产物用1%琼脂糖凝胶电泳检测。
1.7 PEG-CaCl2介导的转化体系验证
将含GFP的外源质粒pCT74导入牛樟芝原生质体后筛选拟转化子,并通过荧光显微镜观察其菌丝体形态。
2 结果与分析
2.1 原生质体的制备及再生
不同酶解时间对原生质体得率研究表明,酶解2 h和3 h时,原生质体的获得量分别为2.03×105个/mL和3.13×105个/mL;酶解4 h时,原生质体的获得量最大,达3.55×105个/mL;继续增加酶解时间至5 h,原生质体获得量降至3.08×105个/mL,可能是由于溶壁酶对已生成的原生质体产生毒害作用,影响原生质体的数量及活性,最终影响原生质体再生及转化效率。所制备原生质体大小适中,无变形(图1A),在TB3再生培养基上再生率达4.59%(图1B)。
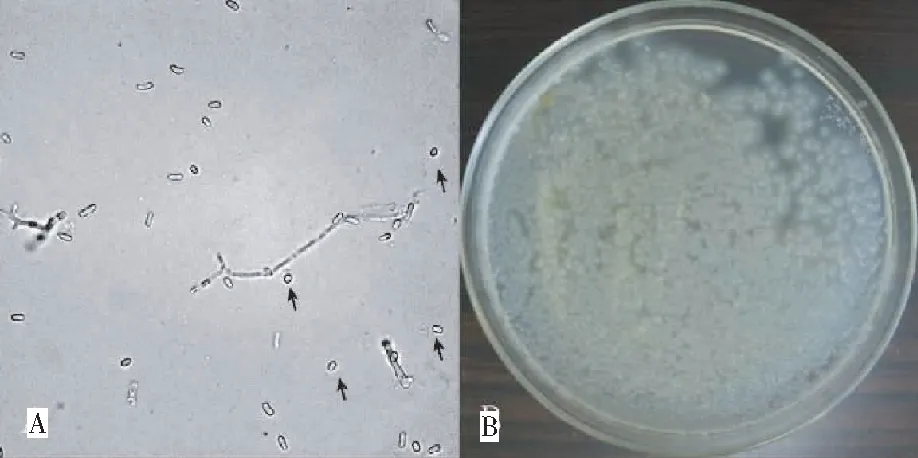
图1 牛樟芝原生质体(A)及其在TB3 培养基上再生情况(B)
Fig.1 Regeneration ofA.cinnamomeaprotoplasts on TB3 medium
2.2 牛樟芝菌丝体对潮霉素B的敏感性
由图2可知,牛樟芝菌株在含不同浓度潮霉素B的牛樟芝固体培养基上生长6~8 d后呈明显不耐受性,牛樟芝菌丝体在潮霉素B浓度为20 μg/mL的培养基上有少量继续生长;当潮霉素B浓度达到40 μg/mL时仅有极少量菌丝可萌发,但第7天后不再生长;当潮霉素B浓度>60 μg/mL时,牛樟芝菌丝体完全不生长。
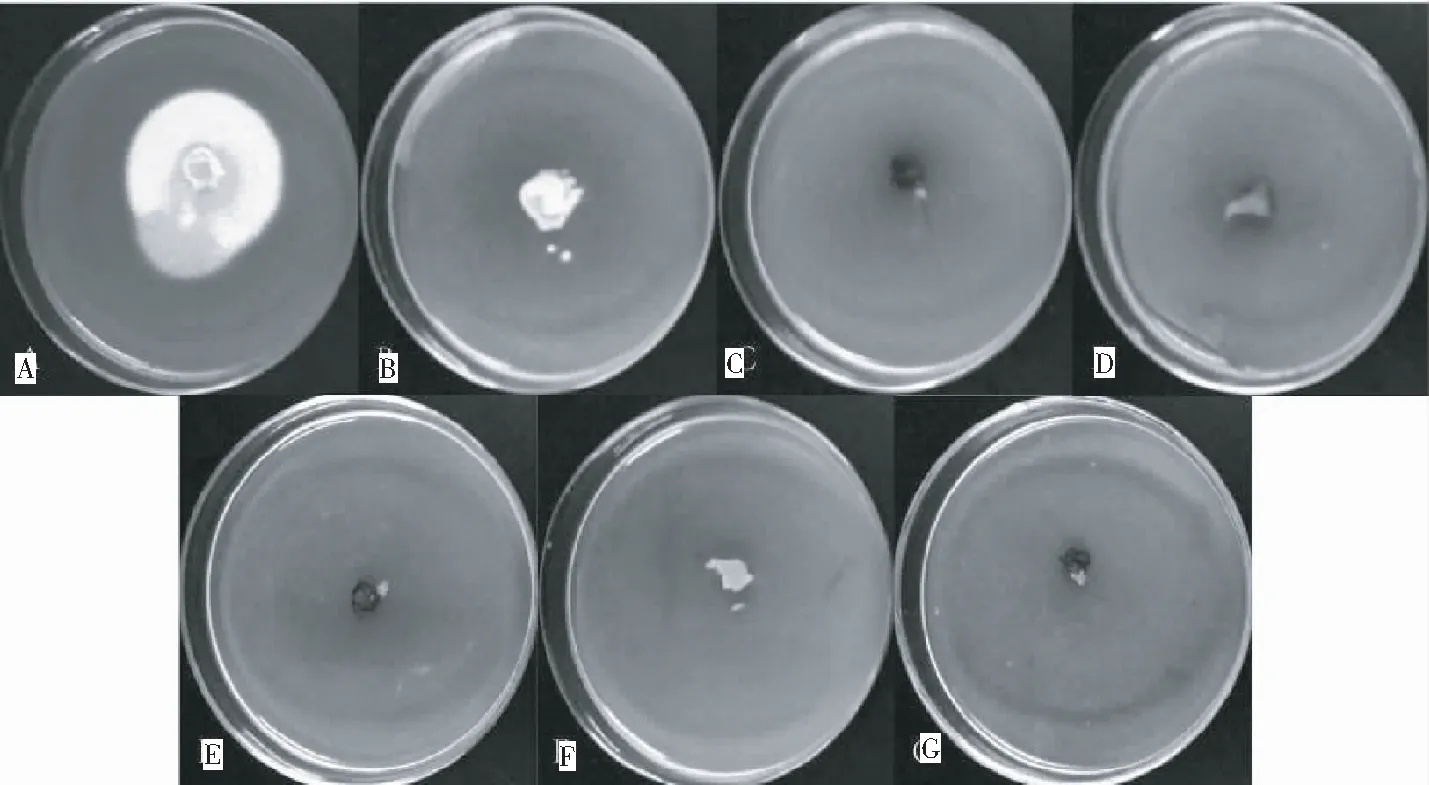
注:A,空白对照;B,潮霉素B浓度20 μg/mL;C,潮霉素B浓度40 μg/mL;D,潮霉素B浓度60 μg/mL;E,潮霉素B浓度80 μg/mL;F,潮霉素B浓度100 μg/mL;G,潮霉素B浓度120 μg/mL(下同)。
Note: A, CK; B, 20 μg/mLhygromycin B; C, 40 μg/mL hygromycin B; D, 60 μg/mL hygromycin B; E, 80 μg/mL hygromycin B; F, 100 μg/mL hygromycin B; G, 120 μg/mL hygromycin B. The same below.
图2 不同浓度潮霉素B 处理牛樟芝菌丝的生长情况
Fig.2 Growth ofA.cinnamomeamycelium treated with different concentration of hygromycin B
2.3 牛樟芝原生质体对潮霉素B的敏感性
由图3可见,牛樟芝原生质体再生培养14 d后,含不同浓度潮霉素B的牛樟芝固体培养基呈明显不耐受性,当固体培养基中潮霉素B浓度为20 μg/mL时牛樟芝原生质体的生长明显受到抑制,仅有少量能生长;当潮霉素B浓度为40 μg/mL时牛樟芝原生质体几乎不能生长;当潮霉素B浓度>60 μg/mL时,牛樟芝原生质体完全不能生长(图3)。因此,将潮霉素B浓度为60 μg/mL作为牛樟芝转化子抗性筛选浓度。

图3 不同浓度潮霉素 B处理牛樟芝原生质体的生长情况
2.4 牛樟芝转化子筛选及鉴定
由图4表明,用20%~40% PEG-CaCl2溶液介导原生质体转化均能获得拟转化子,但转化效率差异较大,其中以40% PEG-CaCl2介导的牛樟芝原生质体转化效率最高。由图5可见,培养5代的牛樟芝 pCX62和pCT74拟转化子中hph片段扩增筛选得到的1~5号拟转化子均可扩增大小约为560 bp的hph片段,6号为原始菌株,能初步确定该转化体系的成功建立。
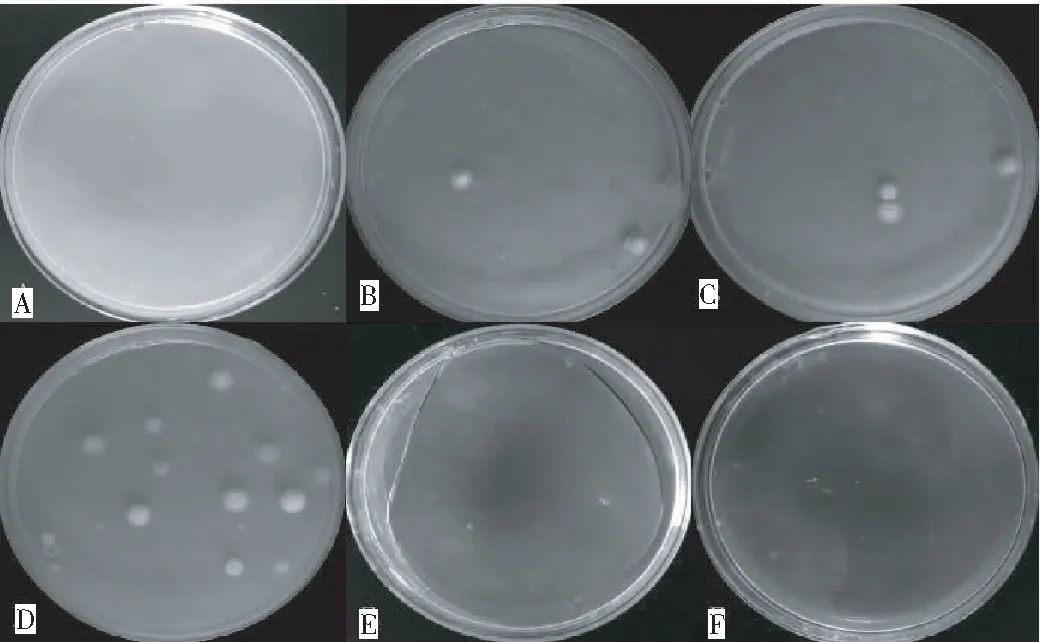
注:A,PEG浓度为0;B,PEG浓度为20%;C,PEG浓度为30%;D,PEG浓度为40%;E,PEG浓度为50%;F,PEG浓度为60%。
Note: A, CK; B, 20% PEG; C, 30% PEG; D, 40% PEG; E, 50% PEG; F, 60% PEG.
图4 不同浓度PEG-CaCl2溶液处理牛樟芝原生质体的转化效率
Fig.4 Transformation efficiency ofA.cinnamomeaprotoplast treated with different concentration of PEG-CaCl2solution
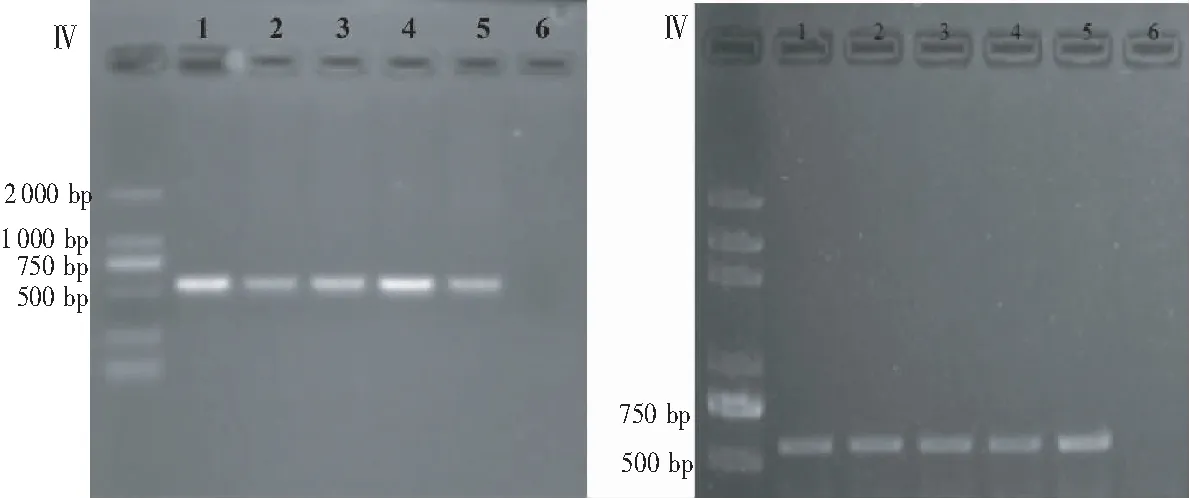
注:样品1~5号为转化菌株,6号为原始菌株。
Note: 1~5, transformant stains; 6, original stain.
图5 牛樟芝 pCX62(左)和pCT74 (右)拟转化子hph片段扩增
Fig.5 hph amplification of pCX62 (left) and pCT74 (right) transformant ofAntrodiacinnamomea

图6 pTC74转化子菌丝体在普通(A)和荧光显微镜(B)及野生菌株(C)在荧光显微镜下菌丝形态
Fig.6 Mycelium of pCT74 transformant under common microscope (A) and fluorescence microscope (B) and hyphal morphology of wild strain (c) under fluorescence microscope
2.5 牛樟芝遗传转化体系的验证
由图6可见,在荧光显微镜下pCT774拟转化子的菌丝体中可观察到大量的绿色荧光,而野生型牛樟芝菌丝体则无该现象,从而进一步证明PEG-CaCl2可成功介导牛樟芝原生质体转化。
3 结论与讨论
与前人研究结果[23-24]相比,本研究利用GFP对所转化体系进行验证,在荧光显微镜下能快速、直接观察到转化情况,缩短转化培养及验证时间,提高了验证效率。张新涛等[24]的结果中灵芝原生质体再生率仅1%,李刚等[23]的研究结果也表明,灵芝再生率也与酶解时间、培养基等有关,本研究牛樟芝原生质体再生率4.59%,而原生质体再生率低也能直接影响转化效率。牛樟芝原生质体再生率和转化效率低可能是因为高等真菌的遗传规律和菌龄限制[24],但也可能是以下原因:
1) 酶解条件的选择。有效去除细胞壁是成功制备原生质的关键。真菌细胞壁主要含有大量的多糖类物质,选择适宜的溶壁酶至关重要。刘莉等[18]对猴头菇遗传转化体系的研究中发现,1%溶壁酶、1%纤维素酶和1%蜗牛酶对原生质体的制备效果最佳(3×106个/mL),其次为1%溶壁酶(2.8×106个/mL)。本研究中用10 mg/mL的溶壁酶制备牛樟芝原生质体可达3.13×105个/mL,说明不同溶壁酶之间对原生质体的形成可能存在差异。
研究中还发现酶解时间能直接影响原生质的数量,酶解2~4 h,原生质体数量不断升高,而酶解5 h后,原生质体数量明显下降,是由于酶解时间过长,溶壁酶对原生质体膜进行酶解,导致原生质体破裂,从而使再生能力下降,这与李刚等[16]研究结果一致。
2) PEG介导浓度的选择。本研究结果表明,不同浓度的PEG-CaCl2溶液对转化获得率影响较大。当PEG-CaCl2溶液浓度为20%~40%时,均能获得不同数量的转化子,而当浓度达50%以上时,均无法获得相应的转化子,在PEG处理过程中,由于细胞质浓度不均匀或细胞体积过小容易使原生质体破碎,因此转化过程中,原生质体的质量、活性以及细胞渗透压环境的稳定是转化成功的关键。过高的PEG浓度会影响细胞稳定性,对细胞产生一定的毒害作用,本研究当PEG浓度>50%时,未获得相应的转化子,可能是因为浓度过高使原生质体破裂从而无法再形成转化子。
利用GFP验证牛樟芝遗传转化体系具有直观、快速、稳定等特点,提高转化验证效率和准确性,可在各领域使用。牛樟芝子实体和菌丝体都含量大量三萜类和多糖类,其药理功能越来越得到认可,建立牛樟芝遗传转化体系,利用分子生物学技术拓展牛樟芝的研究和利用空间,建立稳定、快速的牛樟芝遗传转化体系,通过导入外源基因,提升牛樟芝工业生产价值,从而为牛樟芝的市场化推广应用奠定基础。
[1] Mueller G M,Bills G F,Foster M S.Biodiversity of fungi:inventory and monitoring methods[M].Manhattan:Academic Press,2004.
[2] Chang T T,Chou W N.Antrodiacinnamomeasp. nov.on Cinnamomum kanehirai in Taiwan[J].Mycological Research,1995,99(6):756-758.
[3] Shi L S,Chao C H,Shen D Y,et al.Biologically active constituents from the fruiting body of Taiwanofungus camphoratus[J].Bioorganic & Medicinal Chemistry,2011,19(1):677-683.
[4] Ma T W,Lai Y,Yang F C.Enhanced production of triterpenoid in submerged cultures ofAntrodiacinnamomeawith the addition of citrus peel extract[J].Bioprocess and Biosystems Engineering, 2014,37(11):2251-2261.
[5] Liu C J,Chiang C C,Chiang B H.The elicited two-stage submerged cultivation ofAntrodiacinnamomeafor enhancing triterpenoids production and antitumor activity[J].Biochemical Engineering Journal,2012,64:48-54.
[6] Sheu M J,Teng Y N,Chen Y Y,et al.The Functional Influences of Common ABCB1 Genetic Variants on the Inhibition of P-glycoprotein by Antrodia cinnamomea Extracts[J].PloS one,2014,9:e89622.
[7] Yang F C,Huang H C,Yang M J.The influence of environmental conditions on the mycelial growth ofAntrodiacinnamomeain submerged cultures[J].Enzyme and Microbial Technology,2003,33(4):395-402.
[8] Penttilä,Nevalainen H,Rättö, et al.A versatile transformation system for the cellulolytic filamentous fungus Trichoderma reesei[J].Gene,1987,61(2):155-164.
[9] Van De Rhee M D,Graca P M,Huizing H J,et al.Transformation of the cultivated mushroom,Agaricus bisporus, to hygromycin B resistance[J].Molecular and General Genetics MGG,1996,250(3):252-258.
[10] Royer J,Horgen P.Towards a transformation of the edible basidiomycete Agrocybe aegerita with the URA1 gene characterization of integrative events and of rearranged free plasmids in transformants[J].Current Genetics,1991,22(1):53-59.
[11] Jia J H,Buswell J A,Peberdy J F.Transformation of the edible fungi,Pleurotus ostreatus and Volvariella volvacea[J].Mycological Research,1998,102(7):876-880.
[12] Wang J,Guo L,Zhang K,et al.Highly efficient Agrobacterium-mediated transformation of Volvariella volvacea[J].Bioresource Technology,2008,99(17):8524-8527.
[13] Hirano T,Sato T,Yaegashi K,et al.Efficient transformation of the edible basidiomycete Lentinus edodes with a vector using a glyceraldehyde-3-phosphate dehydrogenase promoter to hygromycin B resistance[J].Molecular and General Genetics MGG,2000,263(6):1047-1052.
[14] Kuo C Y,Huang C T.A reliable transformation meth od and heterologous expression of β-glucuronidase in Lentinula edodes[J].Journal of Microbiological Methods,2008,72(2):111-115.
[15] Sun L,Cai H,Xu W,et al.Efficient transformation of the medicinal mushroom Ganoderma lucidum[J].Plant MolecularBiology Reporter,2001,19(4):383-384.
[16] 李 刚,王 强,刘秋云,等.利用PEG法建立药用真菌灵芝的转化系统[J].菌物学报,2004(2):255-261.
[17] Irie T,Honda Y,Hirano T,et al.Stable transformation of Pleurotus ostreatusto hygromycin B resistance using Lentinus edodesGPD expression signals[J].Applied Microbiology and Biotechnology,2001,56(5-6):707-709.
[18] 刘 莉,肖招燕,郭丽琼,等.PEG介导的猴头菌遗传转化体系的建立[J].菌物学报,2014,33(1):121-128.
[19] Shimomura O,Johnson F H,Saiga Y.Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea[J].Journal of Cellular and Comparative Physiology,1962,59(3):223-239.
[20] Morise H,Shimomura O,Johnson F H,et al.Intermolecular energy transfer in the bioluminescent system of Aequorea[J].Biochemistry,1974,13(12):2656-2662.
[21] Chalfie M,Tu Y,Euskirchen G,et al.Green fluorescent protein as a marker for gene expression[J].Science,1994,263(5148):802-805.
[22] Lu M C,El-Shazly M,Wu T Y,et al.Recent research and development of Antrodia cinnamomea[J].Pharmacology & Therapeutics,2013,139(2):124-156.
[23] 李 刚,李宝健.灵芝原生质体分离与再生研究[J].菌物系统,1999,18(1):79-88.
[24] 张新涛,韩 春,吴立宇,等.灵芝原生质体的分离及其转化[J].遗传,2001,23(5):458-462.
[25] Lorang J M,Tuori R P,Martinez J P,et al.Green fluorescent protein is lighting up fungal biology[J].Applied and Environmental Microbiology,2001,67(5):1987-1994.
[26] 董晓雅.平菇遗传转化体系和转漆酶工程菌株的构建[D].郑州:河南农业大学,2010.
[27] 尹永刚.杏鲍菇遗传转化体系的建立与pyrG基因的克隆[D].保定:河北农业大学,2012.
[28] Saghai-Maroof M A,Soliman K M,Jorgensen R A,et al.Ribosomal DNA spacer-length polymorphisms in barley:mendelian inheritance, chromosomal location, and population dynamics[J].Proceedings of the National Academy of Sciences,1984,81(24):8014-8018.
(责任编辑: 刘忠丽)
Establishment of Genetic Transformation System ofAntrodiacinnamomeaBased on PEG-CaCl2Mediated Method
LI Jing1,2, LIN Xiongjie3, LIN Dongmei1,2, LU Guodong1, LIN Zhanxi1,2*
(1.ChinaNationalJuncaoEngineeringResearchCenter,Fuzhou,Fuzhou350002; 2.JuncaoInstitute,FujianUniversityofAgricultureandForestry,Fuzhou,Fuzhou350002; 3.FruitInstitute,FujianAcademyofAgriculturalScience,Fuzhou,Fuzhou350013,China)
The transformants ofAntrodiacinnamomeamycelium and protoplast were verified by hygromycin B resistance, GFP and PCR to establish the stable genetic transformation system ofAntrodiacinnamomeaand screen the suitable PEG-CaCl2concentration for transformation ofAntrodiacinnamomeaprotoplast. Results: The protoplast yield extracted from freshA.cinnamomeamycelium is 3.55×105/mL under the conditions of 10 mg/mL lyticase, 4 h and 30℃. The mycelium and protoplast ofA.cinnamomeacan not grow on 40 μg/mL or 60 μg/mL hygromycin B medium. The suitable concentration of hygromycin B to screenA.cinnamomeatransformants is 60 μg/mL. 20%~40% PEG can mediate transformation ofA.cinnamomeaprotoplast and the optimal PEG concentration is 40%.
Antrodiacinnamomea; protoplast; polyethylene glycol; hygromycin B; recombinant
2015-09-16; 2016-04-02修回
福建省2011计划“福建省菌草生态产业协同创新中心”(k80nd8002);国家菌草工程技术研究中心组建项目(2011FU125X 12)
李 晶(1985-),女,硕士,从事蔬菜学食用菌研究。E-mail:13959197195@163.com
*通讯作者:林占熺(1943-),男,研究员,从事菌草栽培食药用菌技术研究。E-mail:lzxjuncao@163.com
1001-3601(2016)04-0166-0086-06
S646.9; Q939.5
A
