肝细胞癌Adv—p53、AAV—HGFK1联合转基因治疗的临床疗效和预后分析
2016-02-27张法标方哲平
张法标+方哲平
[摘要] 目的 分析肝细胞癌Adv-p53、AAV-HGFK1联合转基因治疗的临床疗效和预后。 方法 选取我科2009年1月~2012年1月进展期肝癌患者共50例,随机分为重组腺相关病毒-肝细胞生长因子第l螺旋区(recombinant adeno-associated virus-kringle 1 domain of hepatocyte growth factor)AAV-HGFK1+Adv-p53组和AAV-HGFKI组。比较两组患者治疗后肝穿刺活检标本新生微血管和凋亡细胞率、临床疗效、复发率、生存率。 结果 AAV-HGFK1+Adv-p53组治疗后第14天、第21天的新生微血管数量显著低于AAV-HGFK1组,凋亡细胞率显著高于AAV-HGFK1组(P<0.01)。AAV-HGFK1+Adv-p53组的疾病控制率为84.00%,显著高于AAV-HGFK1组48.00%(P<0.05);两组患者的疾病缓解率差异无统计学意义(P>0.05)。AAV-HGFK1+Adv-p53组1年、3年复发率显著低于AAV-HGFK1组,1年、3年生存率显著高于AAV-HGFK1组(P<0.05)。 结论 Adv-p53、AAV-HGFK1联合治疗进展期肝细胞癌疗效优于AAV-HGFK1单独治疗,预后更佳。
[关键词] Adv-p53;AAV-HGFK1;转基因治疗;肝细胞癌;预后
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2015)26-0008-04
Clinical efficacy and prognosis of Adv-p53, AAV-HGFK1 combined gene therapy for HCC
ZHANG Fabiao FANG Zheping
Department of Hepatobiliary Surgery, Taizhou Hospital in Zhejiang Province, Linhai 317000, China
[Abstract] Objective To analyze the clinical efficacy and prognosis of Adv-p53, AAV-HGFK1 combined gene therapy for HCC. Methods Fifty patients with advanced liver cancer in our department from January 2009 to January 2012 were randomly divided into AAV-HGFK1+Adv-p53 group and AAV-HGFK1 group. The liver biopsy specimens microvessel and apoptosis rate, clinical efficacy and relapse rate were compared in two groups of patients. Results The number of microvessels in AAV-HGFK1+Adv-p53 group 14 days and 21 days was significantly lower than AAV-HGFKI group. The apoptosis rate was significantly higher than that of AAV-HGFK1 group(P<0.01). The disease control rate in AAV-HGFK1+Adv-p53 group was 84.00%, which was significantly higher than 48.00% in the AAV-HGFK1 group(P<0.05). The remission of the disease in patients had no significant difference between the two groups(P>0.05). The 1,3-year recurrence rate in the AAV-HGFK1+Adv-p53 group was significantly lower than AAV-HGFK1 group, the 1,3-year survival rate was significantly higher than that of AAV-HGFK1 group(P<0.05). Conclusion Adv-p53, AAV-HGFK1 combination therapy for advanced hepatocellular carcinoma is more effective than AAV-HGFK1 alone treatment, while the prognosis is better.
[Key words] Adv-p53; AAV-HGFK1; Gene therapy; Hepatocellular carcinoma; Prognosis
原发性肝癌为我国特别是农村地区高发恶性消化道肿瘤之一,由于其早期临床主要表现为右下腹隐痛、呕心呕吐以及消化不良等胃肠道非特异性表现,故早期阳性诊断水平较低[1],而以手术为主联合术后放化疗等治疗方式并未取得满意疗效,其术后五年生存率约30%~45%。近年来临床上对于原发性肝癌的基因水平的治疗取得了一定成效,通过转染抑癌基因等基因片段进入癌细胞组织中,通过抑制相关信号通路的激活等方式来抑制肿瘤细胞增值、转移[2,3]。本研究通过对原发性肝癌患者进行AAV-HGFK1+Adv-p53和AAV-HGFK1基因治疗,揭示腺病毒-P53对于治疗肝癌治疗的潜在价值,现报道如下。
1 资料与方法
1.1 一般资料
选取我科2009年1月~2012年1月进展期肝癌患者共50例,均符合第四届全国肝癌会议修订标准(1999年)[1]。纳入标准:①具有完整的肝功能、AFP、CT或MRI检查资料;②预计寿命超过12周,体能状态评分(ECOG)0~2分;③之前未经过手术、放疗、射频消融、栓塞化疗、肝动脉灌注、冷冻消融、经皮乙醇注射等治疗;④无严重的心、肺、肾或造血系统疾病。排除标准:①入组前接受过针对肝癌任何形式的治疗;②预计寿命<12周或ECOG>2分;③合并严重的心、肺、肾或造血系统疾病;④妊娠或哺乳期女性。随机分为AAV-HGFK1+Adv-p53组和AAV-HGFK1组,其中AAV-HGFK1+Adv-p53组25例,男17例,女8例;年龄37~64岁,平均(51.9±3.3)岁;肿瘤直径3.1~10.8 cm,平均(5.4±0.8)cm;肿瘤数目1个7例,2个4例,≥3个14例;伴有肺转移9例,骨转移1例;侵犯门脉主干5例。AAV-HGFK1组25例,男18例,女7例;年龄39~66岁,平均(52.4±3.5)岁;肿瘤直径3.6~10.2 cm,平均(5.7±0.2)cm;肿瘤数目1个8例,2个5例,≥3个12例;伴有肺转移10例,骨转移2例;侵犯门脉主干6例。两组患者性别构成、年龄、肿瘤直径和数目、转移及侵犯血管情况差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
采用OlympusXQ260电子显微镜,在彩色电子显微镜屏幕指示下,通过逆行胆管造影方式,在肝脏原发性肝癌组织进行多点注射,AAV-HGFK1注射剂量为1×1012 VP,Adv-p53注射剂量为2×1012 VP(Adv-p53和AAV-HGFK1注射液均购自南京凯基生物科技有限公司,规格:1×1024 VP/支)。每周1次,每5次为一个疗程,针刺深度应适宜,一般达正常组织交界处即可,不必超越肿瘤组织而进入正常肝细胞组织内。
1.3 评价指标
1.3.1 新生微血管和凋亡细胞率 对两组患者治疗后肝穿刺活检标本进行组织石蜡切片,免疫组化染色。其中兔抗小鼠vWF多克隆抗体和羊抗人HGFK1多克隆抗体购自上海研晶实业科技有限公司。UFX-DX倒置显微镜和荧光显微镜购自日本Olympus公司。阳性细胞为棕色,新生微血管计数首先在低倍镜视野下确定肿瘤内新生微血管最密集区域,之后在高倍镜视野内计数5个视野,取5个视野中的新生微血管平均数。凋亡细胞率检测采用原位细胞凋亡检测试剂盒(购自深圳纽邦生物科技有限公司),检测方法按照试剂盒说明书进行。在高倍镜视野内选取5个区域进行凋亡细胞和总细胞计数,凋亡细胞率为二者比值。
1.3.2 临床疗效 采用mRECIST评价标准,评价两组患者治疗效果。分为完全缓解(CR):至少维持4周无新病灶出现,同时已知病灶消失;部分缓解(PR):至少维持4周无新病灶出现,同时已知病灶最大直径总和缩小>30%;疾病稳定(SD):至少维持4周无新病灶出现,但未达CR、PR或PD标准;疾病进展(PD):出现新病灶或已知病灶最大直径总和增大>20%[2]。其中疾病控制率为CR、PR和SD患者占所有患者的比率,疾病缓解率为CR、PR患者占所有患者的比率。
1.3.3 随访 对于两组患者进行随访,随访内容为:治疗后1年内每3个月检测一次血清甲胎蛋白(AFP)和腹部CT、胸部CT和骨扫描。1年后每半年复查一次。对比两组患者1年、3年的复发率和生存率。
1.4 统计学方法
采用SPSS16.0统计学软件进行分析,计数资料以%表示,采用χ2检验,计量资料以(x±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗后新生微血管和凋亡细胞率比较
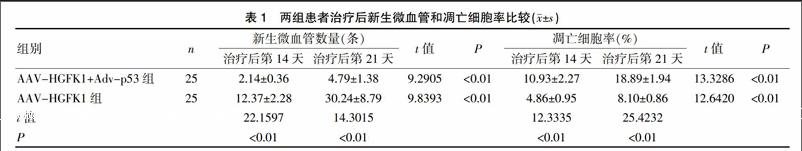
AAV-HGFK1+Adv-p53组治疗后第14天、第21天的新生微血管数量显著低于AAV-HGFK1组,凋亡细胞率显著高于AAV-HGFK1组(P<0.01)。两组患者治疗后第21天的新生微血管数量和凋亡细胞率均显著高于治疗后第14天(P<0.01)。见表1、封三图5、图6。
2.2 两组患者临床疗效比较
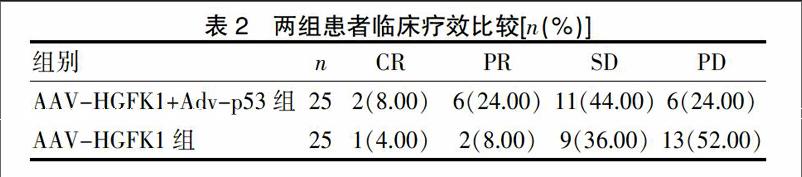
AAV-HGFK1+Adv-p53组的疾病控制率为76.00%,显著高于AAV-HGFK1组的48.00%(χ2=4.1596,P=0.041<0.05);两组患者的疾病缓解率差异无统计学意义(χ2=2.9138,P>0.05)。见表2。
2.3 两组患者复发率和生存率比较
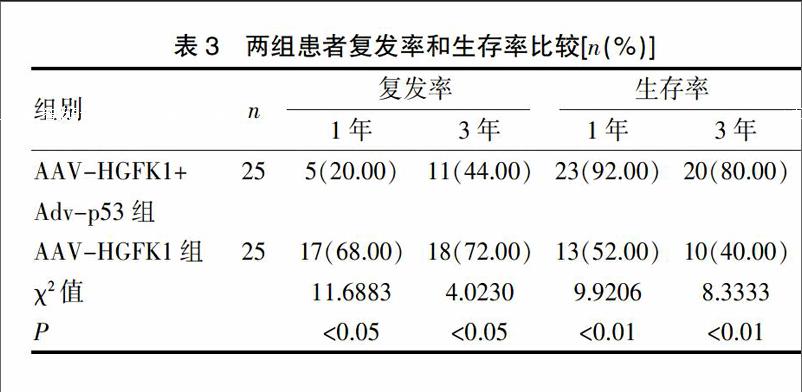
AAV-HGFK1+Adv-p53组的平均随访时间为(37.1±4.4)个月(4~51个月),AAV-HGFK1组的平均随访时间为(18.4±2.7)个月(3~39个月)。AAV-HGFK1+Adv-p53组1年、3年复发率分别为20.00%和44.00%,1年、3年生存率分别为92.00%和80.00%;AAV-HGFK1组1年、3年复发率分别为68.00%和72.00%,1年、3年生存率分别为52.00%和40.00%。AAV-HGFK1+Adv-p53组1年、3年复发率显著低于AAV-HGFK1组,1年、3年生存率显著高于AAV-HGFK1组(P<0.05)。见表3。
表3 两组患者复发率和生存率比较[n(%)]
3 讨论
现阶段对于原发性肝癌的治疗越来越倾向于基因水平的干预治疗,鉴于传统手术切除原发肝癌组织并适度联合术后放疗或者化疗的方式,并未显著改善患者术后5年生存率或者中位生存时间,科研工作者以及一线临床医生越来越倾向于通过转染抑癌基因来干扰肿瘤细胞增殖以及转移[4]。HGFK1为79个氨基酸组成的环形结构,最早被发现能够通过抑制成纤维细胞生长因子而促进牛血管内皮细胞增殖,Jin B等[5]研究发现HGFK1拮抗肝原发性癌细胞增殖以及抗局部微血管形成作用主要通过EGF/EGFR或者VEGF/VEGFR信号通路激活来实现,同时 Jin B等在大鼠肝癌模型中发现,HGFK1能显著降低肝细胞癌局部微血管密度,阻断相应的肺部肿瘤转移的发生;而P53基因主要通过促进受损DNA细胞凋亡、调控细胞周期、修复DNA异常甲基化或者磷酸化等损伤,实现其抗肿瘤效应,而突变型P53不仅难以维持正常细胞周期,还可能加剧相关肿瘤信号通路激活促进肿瘤细胞增殖,而 Cheung PF等[6]学者发现,原发性肝癌患者体内P53基因突变型约占78%~85%,提示肝癌患者体内P53难以发挥其抗肿瘤效应。本研究重在探讨AAV-HGFK1联合Adv-p53治疗原发性肝癌的疗效,以揭示相应的基因治疗对于肝癌治疗的潜在价值。
本研究在分析进展期肝癌患者共50例(包括对照组25例和观察组25例)相应的基因治疗的效果后发现,AAV-HGFK1+Adv-p53组治疗后第14天、第21天的新生微血管数量显著低于AAV-HGFK1组,凋亡细胞率显著高于AAV-HGFK1组,与Wei JC等[7]学者的结论相似。Wei JC等[7]发现P53通过腺病毒成功转染入原发性肝癌细胞内后,通过抑制G0期细胞快速进入G1期并显著降低G2/S期细胞比例抑制肿瘤细胞增殖,同时通过激活CMAP/pka/cmyc信号通路促进肝癌细胞凋亡,同时Wei JC等学者发现,P53成功转染后,肝癌细胞局部微环境显著发生改变,局部血管密度显著降低,肿瘤微环境中肝癌肿瘤干细胞比例以及活性显著降低,并认为P53可能通过fasl/caspase8/BAX来抑制局部微血管增生;对于两组患者临床疗效的对比,本研究发现AAV-HGFK1+Adv-p53组的疾病控制率为76.00%,显著高于AAV-HGFK1组48.00%,但两组患者的疾病缓解率尚无统计学差异,考虑AAV-HGFK1+Adv-p53治疗后,可能通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、降低局部微血管密度改善患者预后[8-14],与Hu S[15]、陆玉敏等[16]学者的研究结果一致,Hu S等[15]学者发现,P53或者单独AAV-HGFK1转染机体肿瘤细胞后,其临床转归明显优于对照组,同时远处转移的发生率由37%显著下降至15%,Hu S等[15]学者通过腺病毒转染P53入145例亚洲原发性晚期肝癌患者局部肿瘤组织细胞内后发现,患者术后中位生存由(78.5±11.3)个月显著上升至(89.5±14.8)个月,但本研究并未发现两组患者疾病缓解率的差异,考虑可能与本研究样本量不足有关,同时观察时间可能不足导致统计学差异无法体现。最后本研究对于两组患者出院后相关临床预后进行分析后发现,AAV-HGFK1+Adv-p53组1年复发率显著低于AAV-HGFK1组,1年生存率显著高于AAV-HGFK1组,进一步确认了AAV-HGFK1联合Adv-p53进行基因治疗的重要临床价值。
在注意到AAV-HGFK1联合Adv-p53进行基因治疗的临床疗效的同时,部分学者认为,AAV-HGFK1联合Adv-p53进行基因治疗的临床有效情况以及相关预后情况的改善主要取决于原发性肝癌患者体内P53或者HGF的突变型比例[17,18],如 Giovannini C等[19]学者注意到,一旦P53或者HGF的突变型比例低于40%,相关的基因治疗对于原发性肝癌特别是晚期患者基本未见有显著差异的疗效,同时相关术后中位生存时间并无改善。史守良[20]、王苗等[21]学者也发现,P53或者HGF的突变型/野生型比例高于2.5时,相关肝癌患者术后五年生存率仅由45%升高至49%,且未见统计学差异,这都提示临床医生在不应盲目采用基因治疗,应在综合衡量后采用合适的治疗方案。
综上所述,Adv-p53、AAV-HGFK1联合治疗进展期肝细胞癌疗效优于AAV-HGFK1,并通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、降低局部微血管密度等途径,提升患者的临床控制率,并有利于改善患者出院后一年内肝癌的复发率以及生存率,但对于相关基因突变导致的临床有效率的问题需进一步大样本研究。
[参考文献]
[1] 陶振超,钱立庭,邱俊,等. rAd-p53对人肝癌细胞生长作用的影响[J]. 安徽医科大学学报,2013,32(4):353-356.
[2] 邓飞鸿,聂飚,左俊华,等. AAV-HGFK1抑制EGFR磷酸化拮抗大肠癌细胞生长[J]. 重庆医学,2014,43(33):4447-4449.
[3] 顾春荣,郭跃武,赵晖,等. 腺相关病毒介导的HGFK1对大鼠肝细胞癌的治疗作用研究[J]. 中国癌症杂志,2009,43(6):416-422.
[4] 郭成,段建峰,刘青光,等. 野生型-p53与JunB融合基因对裸鼠肝细胞肝癌移植瘤生长抑制作用的实验研究[J].中华肝脏外科手术学电子杂志,2013,32(3):180-185.
[5] Jin B,Wang W,Du G,et al. Identifying hub genes and dysregulated pathways in hepatocellular carcinoma[J]. Eur Rev Med Pharmacol Sci,2015,19(4):592-601.
[6] Cheung PF,Yip CW,Ng LW,et al. Establishment and characterization of a novel primary hepatocellular carcinoma cell line with metastatic ability in vivo[J]. Cancer Cell Int,2014,14(1):103-112.
[7] Wei JC,Meng FD,Qu K,et al. Sorafenib inhibits proliferation and invasion of human hepatocellular carcinoma cells via up-regulation of p53 and suppressing FoxM1[J]. Acta Pharmacol Sin,2015,36(2):241-251.
[8] 李玉梅,汪蕊,欧玉荣,等. PTEN和p53在肝细胞癌中的表达及其相关性[J]. 蚌埠医学院学报,2013,24(12):1551-1554.
[9] 杨哲,朱勇,赵瑞. 靶向p21基因saRNA抑制肝癌细胞生长实验研究[J]. 中华实用诊断与治疗杂志,2015,21(2):132-135.
[10] 张继宏,莱智勇,张甜甜,等. 顺铂联合HSV-tk自杀基因对肝癌细胞HepG2的生长抑制作用[J]. 中国药物与临床,2015,32(2):154-156.
[11] 牟楠楠,张乐. p53基因Arg72Pro单核苷酸多态性与山东人群乙型肝炎相关肝细胞癌高发风险研究[J]. 肝胆胰外科杂志,2013,21(5):381-384.
[12] 李薇,曹骥,周玲丽,等. RNAi沉默CDC25a基因对人肝癌细胞HepG2裸鼠移植瘤的影响[J]. 实用医学杂志,2015,23(3):348-352.
[13] 上官辉,谭淑燕,张积仁. 肝癌易感性相关基因的文献计量学与生物信息学分析[J]. 中华肿瘤防治杂志,2015,22(4):305-311.
[14] 王灵巧,陈济安,舒为群. 原癌基因Gankyrin及其在肿瘤发生中的作用研究进展[J]. 癌变·畸变·突变,2015, 25(1):71-74.
[15] Hu S,Zhao L,Yang J,et al. The association between polymorphism of P53 codon 72 Arg/Pro and hepatocellular carcinoma susceptibility:Evidence from a meta-analysis of 15 studies with 3704 cases[J]. Meta Gene,2013,14(4):126-137.
[16] 陆玉敏,吴英宁,李振宇,等. 肝细胞癌CT表现、肝外转移与病理分级和P53蛋白表达的关系[J]. 临床放射学杂志,2014,34(11):1680-1683.
[17] 尹帆,陈剑,丁云川,等. 靶向超声介导VEGF165基因治疗左向右分流肺动脉高压兔模型的实验性研究[J]. 昆明医科大学学报,2013,32(2):20-22.
[18] 阮继刚,杨力,张飞雄,等. 内镜下rAd-p53注射治疗中晚期胃癌和食管癌的临床效果研究[J]. 宁夏医科大学学报,2012,31(11):1136-1139.
[19] Giovannini C,Minguzzi M,Baglioni M,et al. Suppression of p53 by Notch3 is mediated by Cyclin G1 and sustained by MDM2 and miR-221 axis in hepatocellular carcinoma[J]. Oncotarget,2014,5(21):10607-10620.
[20] 史守良,董秀敏,胡万宁,等. P53基因治疗原发性肝癌的临床研究[J]. 现代中西医结合杂志,2012,16(10):1036-1037.
[21] 王苗,赵一鸣,张绿,等. AGO1调节p53表达与肝细胞癌根治性切除患者预后的相关性[J]. 中华实验外科杂志,2014,31(10):2094-2097.
(收稿日期:2015-05-06)
