MicroRNA在阿尔茨海默病中的作用及机制
2016-01-28田金鑫,邵水金,国海东
MicroRNA在阿尔茨海默病中的作用及机制
田金鑫邵水金国海东
(上海中医药大学基础医学院解剖教研室,上海201203)
关键词〔〕阿尔茨海默病;微RNA;β淀粉样蛋白
第一作者:田金鑫(1989-),女,硕士,主要从事电针治疗阿尔茨海默病的研究。
微RNA(miRNA)是真核生物中广泛存在的非编码RNA,长约21到23个核苷酸,预测转录后调节至少一半的人类转录组〔1〕。近年来发现,miRNA可能在阿尔茨海默病(AD)等神经退行性疾病的发生发展中发挥重要的调控作用。了解和探讨miRNA在AD中的作用及其机制可为临床寻找特异性的治疗靶点提供基础。
1miRNA的生物学基础
miRNA的生物合成途径是高度保守的,每个miRNA的调控靶点大约200个,而一个 mRNA的转录可能受多个miRNA调节。许多miRNAs通过转录因子或表观遗传机制,包括DNA甲基化和组蛋白修饰,受到高度时间和空间上的调节〔2〕。
1.1miRNA的生物合成大部分miRNAs是通过经典的miRNA生物合成途径产生的。首先,miRNA基因由RNA聚合酶(pol)Ⅱ转录,产生长约几千个碱基的初级转录产物(pri-miRNA)。pri miRNAs具有5'端帽和3'端多聚腺苷酸。他们可能编码一个单一的miRNA,独特的miRNA簇,或者蛋白质,因此也可以作为前体miRNA〔3〕。下一步,也发生在细胞核内,由微处理器复合物的精密调控。此复合物的主要成分是RNA聚合酶Ⅲ(Drosha)和其结合配偶体DiGeorge氏综合征关键区基因8 (DGCR8),双链RNA结合蛋白〔4〕。Drosha剪切pri-miRNAs释放60~70个核苷酸长度的发夹结构,称为前体miRNAs(pre-miRNA)。Exportin-5介导pre-miRNA将其从核内运输到胞质中。在胞质中,第二个核糖核酸酶Ⅲ(Dicer),切割pre-miRNA生成22个核苷酸的双链miRNA。miRNA双链与结合Argonaute(Ago)蛋白结合而迅速解链,一股成为成熟的miRNA,并结合到RNA诱导的沉默复合物(RISC)上,通过降解靶mRNAs或阻遏转录参与mRNA表达的调控,见图1。而互补链在细胞内的浓度较低,被认为不具有功能,并且可被迅速降解。然而,最近的研究表明,一些互补链序列与不同的Ago蛋白复合物结合后也具有活性〔5〕。
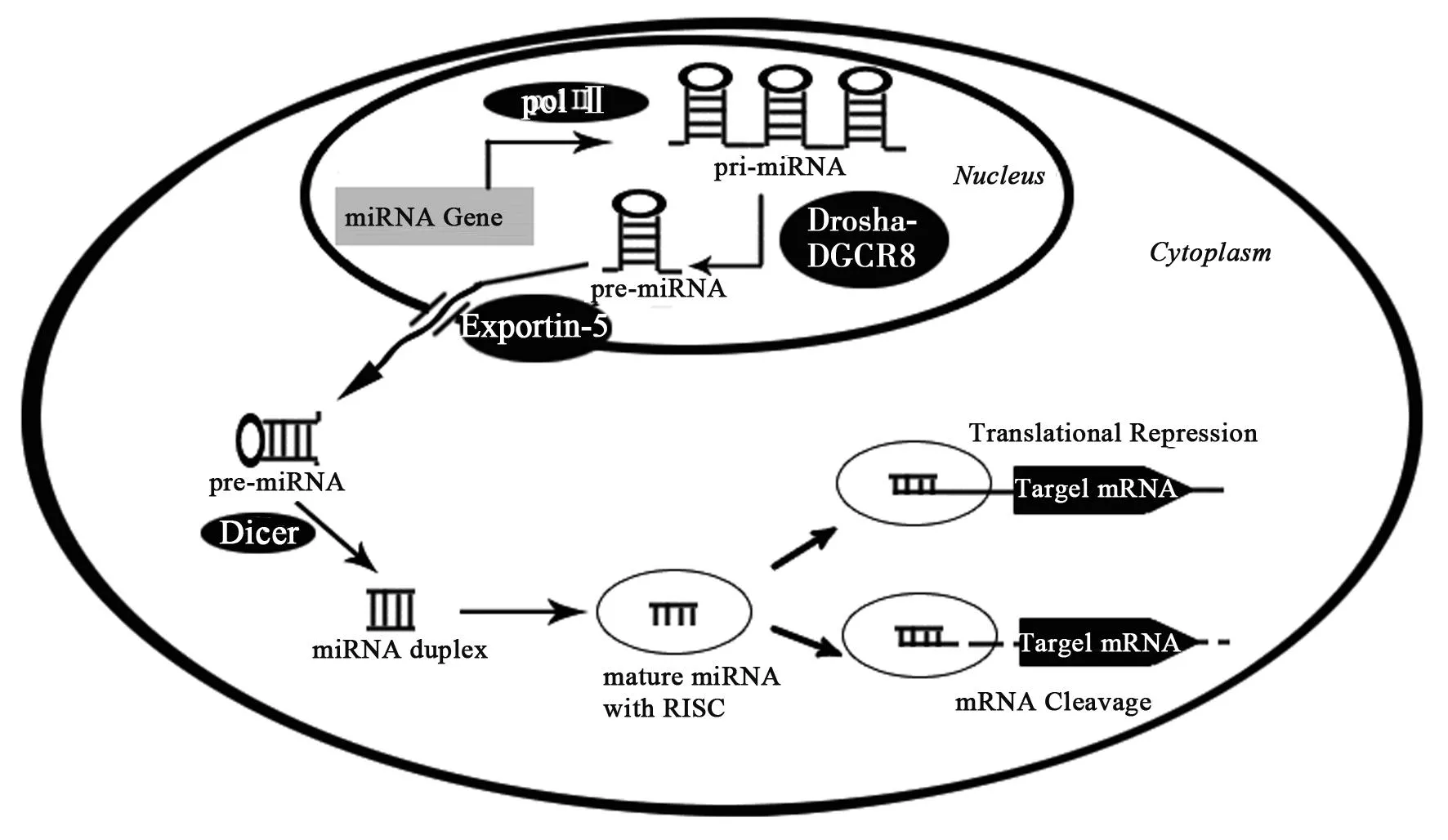
图1 经典的miRNA生物合成途径
miRNA的产生还包括其他非经典的途径,在哺乳动物已被确定有四条不依赖于Drosha的途径,包括mirtron途径、小核仁RNA、tRNA和短发夹RNA来源途径〔6〕。在这些途径中,pri-miRNAs被剪接形成短发夹状内含子,被称为mirtrons,然后再被Exportin-5转运和Dicer剪切〔7〕。mirtrons在灵长类动物的神经系统中发挥重要作用〔8〕。此外,还有两条不依赖于Dicer的miRNA合成途径〔9〕。
1.2miRNA的再循环一般认为,miRNA半衰期长,是一种高度稳定的分子〔10〕。核酸外切酶在miRNA降解和再循环中可能发挥重要作用。研究表明,在动物体内,核酸外切酶(XRN)2可调控miRNA的衰退〔11〕。最近的研究证实,对于不同的miRNA和不同的类型细胞,miRNA的再循环差异很大,对神经元来说,其miRNA具有快速衰退的特征〔12〕。miRNA再循环可能有助于解释其调节大量的翻译的能力〔13〕。成熟的miRNA通过结合到Ago从而受到保护,而mRNA靶序列的存在被认为是在防止miRNA从RISC复合物释放以及随后降解的重要保护因素。因此,当mRNA靶序列不存在时,miRNA可被特异性释放,使RISC可结合新的miRNA。
1.3miRNA的作用机制目前认为,miRNAs通过抑制mRNA翻译或降解mRNA来调节基因表达。一旦掺入到RISC后,成熟miRNA通常在3'UTR区,通过碱基配对与靶mRNA转录识别。miRNA的2~6个核苷酸是目标识别的关键。miRNA及其靶mRNA序列之间互补的程度影响下游调控机制,精确的匹配可导致降解,而错配将导致翻译抑制。关于翻译抑制的确切机制仍不清楚,目前有一些相关的假说模型,包括抑制翻译起始、促进靶mRNA脱腺苷化、将miRNA及其靶点封存到P小体或应激颗粒或翻译后RISC介导的蛋白降解〔14〕。miRNA与靶点相互作用可使蛋白水平降低1/2〔15〕。虽然miRNA被认为主要是负性调控基因表达,但在细胞应激等情况下miRNA也可以激活其作用靶点。
2与AD相关的miRNA
AD是一种复杂的神经退行性疾病,是老年痴呆症的的最常见形式〔16〕。它起病隐匿,表现为缓慢的,渐进性的,并且不可逆的认知和记忆功能丧失,由于神经元和突触的破坏,最终将导致痴呆和死亡。AD的主要病理特征包括淀粉样蛋白-β(Aβ)沉积形成的老年斑、神经纤维缠结及胆碱能神经元及其突触的丧失。关于AD的发病机制中,以Aβ级联学说占主导地位。Aβ主要是一种40~42个 氨基酸片段,由其淀粉样前体蛋白(APP)经APPβ位点裂解酶(BACE1)和γ-分泌酶依次裂解后生成。除了Aβ级联学说外,还包括基因突变学说、胆碱能学说、免疫与炎症学说和氧化应激学说等。
miRNA在神经系统中表达十分丰富,在轴突生长,树突棘形成,神经元分化和突触可塑性等过程中发挥关键调节作用。最近的研究表明,miRNAs网络的改变将影响疾病的进程。AD患者脑组织中存在miRNA失调〔17〕。这些疾病相关miRNA的变化主要位于灰质区〔18〕。目前,已发现多种miRNA与AD关键基因调控变化有关,包括miR-106、miR-107、miR-132、miR-146、miR-153、miR-29和miR-9等。
2.1miR-106APP是miRNA调控的靶点之一。miR-106a和miR-106b可直接和APP mRNA结合,它们在AD患者前颞叶皮层表达下调〔19〕。有趣的是,miR-106能够调节ATP-结合转运体A1(ABCA1),一种与ApoE脂化和生产Aβ的脂质转运体,这表明miR-106的可以不止通过一条途径影响Aβ的生成〔20〕。
2.2miR-107在AD的早期阶段,颞叶皮层miR-107下调,并与BACE1上调有关,这可能影响Aβ的产生〔21〕。而miR-107的减少将进一步伴随着神经炎斑块密度的升高〔22〕。有趣的是,miR-107和miR-124a除了BACE1之外还能调节APP代谢的其他方面,从而表明单一miRNA可影响同一条通路上多个靶点的能力,并可产生累加效应的潜力。MiR-107可直接靶向加工APP的另一个分泌酶整合素和金属蛋白酶10(ADAM10),miR-124a通过直接靶向聚嘧啶结合蛋白1(PTBP1)参与APP mRNA选择性剪接。
2.3miR-132研究表明,AD患者中miR-132表达异常。miR-132可介导Akt生存信号通路、抗炎通路和乙酰胆碱代谢〔23〕。在细胞培养模型,下调miR-132的水平可导致神经元死亡〔24〕,并且AD和亨廷顿病(HD)的患者组织中miR-132的表达减少〔25〕。
2.4miR-146miR-146a是AD与炎症有关的一种miRNA,它可以调控先天免疫。在受AD病理影响的大脑区域,包括海马和颞叶皮层,miR-146a表达上调;而在未受影响的区域miR-146a水平保持不变〔26〕。研究表明,miR-146a的作用靶点包括补体因子(CF)H,白细胞介素(IL)-1受体相关激酶1(IRAK1)和肿瘤坏死因子受体相关因子(TRAF)6,这些都与AD失调的先天免疫和炎症通路有关〔27〕。miR-146a还可作用于跨膜四旋(TSPAN)12,TSPAN12是ADAM10的关键调节因子,因此miR-146a可能会影响Aβ的代谢〔28〕。这些发现进一步证明miRNA能够影响多种通路并介导发病机制之间的串话。
2.5miR-153在APPswe/PSΔE9双突变小鼠模型疾病的早期和晚期miR-153水平显著下降。与缺少新皮层神经元纤维缠结的标本相比(对照和Braak Ⅰ/Ⅱ期标本),尸检后发现有新皮层神经元纤维缠结(Braak Ⅲ~Ⅳ期)的大脑标本中miR-153的水平明显降低。miR-153可影响APP和β淀粉样蛋白前体样蛋白(APLP)2的mRNA转录〔29〕。此外,在人额叶皮层,miR-153和APP在蛋白水平发生逆向共调控〔30〕。因此,miR-153可在转录后水平调控APP/APLP2的表达,但这种潜在的相互作用需要进一步的验证。
2.6miR-29miR-29家族可与BACE1 mRNA靶向结合,在散发AD患者中与BACE1的表达呈负相关。这种相关具有AD特异性,并在HEK293和SH-SY5Y细胞培养模型中得到验证。除了调节BACE1,在老年大脑中miR-29a/b升高,并可调控小胶质细胞活化〔31〕。miR-29簇已在散发性和家族性患者中确定序列,并且发现与AD密切相关的簇中存在变异〔32〕。然而,这一发现需要在大样本中进一步验证,并深入阐明这些变异的具体作用。
2.7miR-9miR-9是一种高度保守的大脑富集的miRNA,也是迄今为止AD中最常见的失调miRNA,miR-9可能存在上调或下调两种可能〔16〕。向体外原代培养神经元中添加Aβ可导致miR-9快速下降,表明miR-9下调可能与斑块形成相关〔33〕。miR-9的作用靶点包括神经原纤维缠结中的一种蛋白质神经丝重链(NFH)和去乙酰化酶SIRT1,SIRT1与tau蛋白相互作用,并增加过磷酸化tau蛋白的积累〔34〕。其他三个抑制SIRT1的miRNAs,即miR-181c,miR-34,和miR-132,在AD大脑显示一致的表达改变〔35〕。此外,miR-132有几个与AD发病机制直接相关的靶点,包括张力蛋白同源物(PTEN),叉头蛋白O3A(FOXO)3A,和E1A结合蛋白P300,它们在神经细胞凋亡和乙酰胆碱酯酶(AChE)中都发挥重要作用。抑制AChE与胆碱能抗炎通路有关,是目前治疗AD的常规药物〔36〕。
2.8miR-34miR-34作为AD的另一个指标,他在体内有三种存在方式miR-34a,miR-34b。miR-34c,其中miR-34a,miR-34c被证实跟AD关系最密切。miR-34c在AD患者外周单核细胞和血浆中都有明显的升高,与同年龄的正常组对照。并指出miR-34c通过抑制参与细胞的存活和氧化防御途径的几个选定的基因的表达,如Bcl2,SIRT1等,实现神经细胞的凋亡进而导致AD的发生发展〔37〕。
3miRNA治疗AD的临床应用
目前已有多个miRNA治疗其他疾病的临床试验,如癌症和慢性丙型肝炎病毒感染〔38〕。并且预期在未来几年将有更多类似的临床试验及应用产生。miRNA的治疗应用主要通过两个策略:利用miRNA模拟物进行RNA干扰(RNAi)和通过miRNA拮抗剂抑制miRNA。已有大量的研究表明,应用RNAi技术靶向疾病相关基因,如BACE1和APP,在动物模型中表现出有益的作用〔39〕。但RNAi技术和传统的药物开发一样面临着同样的挑战,包括药代动力学、靶向特异性、疗效和毒性等〔37〕。而miRNA可以模仿自然发生的RNAi机制,因此可能毒性较低,并有证据表明治疗神经退行性疾病时,与其他的短发夹RNA(shRNA)相比,miRNA免疫激活明显降低。
miRNA作为治疗剂的一个优点是它可以影响多个靶基因和通路。然而,这也可能是不利的,因为这可能导致脱靶效应。每个miRNA可以靶向几百个mRNA,因此,了解miRNA与内源性RNA之间不期望的相互作用是显得十分重要。另外一个值得考虑的是,人工合成的miRNA可能抑制体内生物合成机制,从而削弱内源性miRNA的作用。因此,非经典合成途径的mirtron人工合成物有望成为未来miRNA治疗理想来源。
4结论
由于AD的发病机制涉及多条途径,目前临床上尚无根治AD的有效药物,只能对症治疗,无法缓解AD的病理进程。miRNA通过作用多个靶点和途径,显然将成为AD治疗的一个极具前景的有效策略。
参考文献5
1Friedman RC,Farh KK,Burge CB,etal.Most mammalian mRNAs are conserved targets of microRNAs〔J〕.Genome Res,2009;19(1):92-105.
2Chuang JC,Jones PA.Epigenetics and microRNAs〔J〕.Pediatr Res,2007;61(5 Pt 2):24R-29R.
3Khan AA,Betel D,Miller ML,etal.Transfection of small RNAs globally perturbs gene regulation by endogenous microRNAs〔J〕.Nat Biotechnol,2009;27(2):549-55.
4Denli AM,Tops BB,Plasterk RH,etal.Processingofprimary microRNAsby the Microprocessor complex〔J〕.Nature,2004;432(7014):231-5.
5Czech B,Hannon GJ.Small RNA sorting:matchmaking for Argonautes〔J〕.Nat Rev Genet,2011;12(1):19-31.
6Miyoshi K,Miyoshi T,Siomi H.Many ways togenerate microRNA-like smallRNAs:noncanonical pathways for microRNA production〔J〕.Mol Genet Genomics,2010;284(1):95-103.
7Ruby JG,Jan CH,Bartel DP.Intronic microRNA precursors that bypass Droshapro-cessing〔J〕.Nature,2007;448(1):83-6.
8Berezikov E,Guryev V,van de Belt J,etal.Phylogenetic shadowing and computational identification of human microRNA genes〔J〕.Cell,2005;120(1):21-4.
9Cheloufi S,DosSantos CO,Chong MM,etal.A dicer-independent miRNA biogenesis pathway that requires Ago catalysis〔J〕.Nature,2010;465(7298):584-9.
10Krol J,Loedige I,Filipowicz W.The widespread regulation of microRNA biogenesis,function and decay〔J〕.Nat Rev Genet,2010;11(9):597-610.
11Chatterjee S,Grosshans H.Active turnover modulates mature microRNA activity in Caenorhabditis elegans〔J〕.Nature,2009;461(7263):546-9.
12Krol J,Busskamp V,Markiewicz I,etal.Characterizing light-regulated retinal microRNAs reveals rapid turn over as a common property of neuronal microRNAs〔J〕.Cell,2010;141(7263):618-31.
13Baccarini A,Chauhan H,Gardner TJ,etal.Kinetic analysis reveals the fate of a microRNA following target regulationin mammalian cells〔J〕.Curr Biol,2011;21(5):369-76.
14Tang G,Tang X,Mendu V,etal.The art of microRNA:various strategies leading to gene silencing via an ancient path-way〔J〕.Biochim Biophys Acta,2008;1779(11):655-62.
15Ebert MS,Sharp PA.Roles for microRNAs in conferring robustness to biological processes〔J〕.Cell,2012;149(3):515-24.
16Schonrock N,Humphreys DT,Preiss T,etal.Target gene repression mediated by miRNAs miR-181c and miR-9 both of which are down-regulated by amyloid-beta〔J〕.J Mol Neurosci,2012;46(2):324-35.
17Schonrock N,Ke YD,Humphreys D,etal.Ne-uronal microRNA deregulation in response to Alzheimer's disease amyloidbeta〔J〕.PLoS One,2010;5:e11070.
18Wang WX,Huang Q,Hu Y,etal.Patterns of microRNA expression in normal and early Alzheimer's disease human temporal cortex:white matter versus gray matter〔J〕.Acta Neuropathol,2011;121(2):193-205.
19Hebert SS,Horre K,Nicolai L,etal.Loss of microRNA cluster miR-29a/b-1 in sporadic Alzheimer's disease correlates with increased BACE1/beta-secretase expression〔J〕.Proc Natl Acad Sci USA,2008;105(7):6415-20.
20Kim J,Yoon H,Ramirez CM,etal.MiR-106b impairs cholesterol efflux and increases Abeta levels by repressing ABCA1 expression〔J〕.Exp Neurol,2012;235(2):476-83.
21Nelson PT,Wang WX.MiR-107isreducedinAlzheimer's disease brainneocortex:validation study〔J〕.J Alzheimers Dis,2010;21(1):75-9.
22Wang WX,Rajeev BW,Stromberg AJ,etal.The expression of microRNA miR-107 decreases early in Alzheimer's disease and may accelerate disease progression through regulation of beta-site amyloid precursor protein-cleaving enzyme 1〔J〕.J Neurosci,2008;28(5):1213-23.
23Cogswell JP,Ward J,Taylor IA,etal.Identification of miRNA changes in Alzheimer's disease brain and CSF yields putative biomarkers and insights into disease pathways〔J〕.J Alzheimers Dis,2008;14(1):27-41.
24Johnson R,Zuccato C,Belyaev ND,etal.A microRNA-based gene dysregulation pathway in Huntington's disease〔J〕.Neurobiol Dis,2008;29(3):438-45.
25Shaked I,Meerson A,Wolf Y,etal.MicroRNA-132 potentiates cholinergic antiinflammatory signaling by targeting acetylcholinesterase〔J〕.Immunity,2009;31(6):965-73.
26Sethi P,Lukiw WJ.Micro-RNA abundance and stability in human brain:specific alterations in Alzheimer's disease temporal lobe neocortex〔J〕.Neurosci Lett,2009;459(1):100-4.
27Wang LL,Huang Y,Wang G,etal.The potential role of microRNA-146 in Alzheimer's disease:biomarker or therapeutic target〔J〕.Med Hypotheses,2012;78(3):398-401.
28Li YY,Cui JG,Dua P,etal.Differential expression of miRNA-146a-regulated inflammatory genes in human primary neural,astroglial and microglial cells〔J〕.Neurosci Lett,2011;499(1):109-13.
29Liang C,Zhu H,Xu Y,etal.MicroRNA-153negativelyregulates the expressionofamyloidprecursor proteinandamyloidprecursor-like protein 2〔J〕.Brain Res,2012;1455(1):103-13.
30Long JM,Ray B,Lahiri DK.MicroRNA-153 physiologically inhibits expression of amyloid-beta precursor protein in cultured human fetal brain cells and is dysregulated in a subset of Alzheimer disease patients〔J〕.J Biol Chem,2012;287(37):31298-310.
31Fenn AM,Smith KM,Lovett Racke AE,etal.Increased micro-RNA 29b in the aged brain correlates with the reduction of insulin-like growth factor-1 and fractalkine ligand〔J〕.Neurobiol Aging,2013;34(12):2748-58.
32Bettens K,Brouwers N,Engelborghs S,etal.APP and BACE1 miRNA genetic variability has no major role in risk for Alzheimer disease〔J〕.Hum Mutat,2009;30(8):1207-13.
33Schonrock N,Ke YD,Humphreys D,etal.Neuronal microRNA deregulation in response to Alzheimer's disease amyloidbeta〔J〕.PLoS One,2010;5:e11070.
34Haramati S,Chapnik E,Sztainberg Y,etal.miRNA malfunction causes spinal motor neuron disease〔J〕.Proc Natl Acad Sci USA,2010;107(29):13111-6.
35Schonrock N,Gotz J.Decoding the non-coding RNAs in Alzheimer's disease〔J〕.Cell Mol Life Sci,2012;69(21):3543-59.
36Wong HK,Veremeyko T,Patel N,etal.De-repression of FOXO3a death axis by microRNA-132 and-212 causes neuronal apoptosis in Alzheimer's disease〔J〕.Hum Mol Genet,2013;22(15):3077-92.
37Shephali B,Howard C,Hyman MS,etal.Increased microRNA-34c abundance in Alzheimer's disease circulating blood plasma〔J〕.Front Mol Neurosci,2014;7(1):2.
38Nana-Sinkam SP,Croce CM.Clinical applications for microRNAs in cancer〔J〕.Clin Pharmacol Ther,2013;93(1):98-104.
39Ling S,Zhou J,Rudd JA,etal.The recent updates of therapeutic approaches against abeta for the treatment of Alzheimer's disease〔J〕.Anat Rec(Hoboken),2011;294(8):1307-18.
〔2015-01-22修回〕
(编辑李相军)
通讯作者:国海东(1981-),男,博士,副研究员,硕士生导师,主要从事中医药防治心脑血管疾病研究。
基金项目:国家自然科学基金资助课题(81102670,31400838,81373754)
中图分类号〔〕R741.02〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6271-04;doi:10.3969/j.issn.1005-9202.2015.21.129
