青蒿琥酯对白血病细胞增殖和凋亡的影响
2016-01-28孙艳美赵良中
孙艳美 赵良中 李 强 钟 越 李 妍
(吉林医药学院检验学院,吉林 吉林 132013)
青蒿琥酯对白血病细胞增殖和凋亡的影响
孙艳美赵良中李强钟越李妍
(吉林医药学院检验学院,吉林吉林132013)
摘要〔〕目的研究青蒿琥酯对髓系白血病细胞株K562的增殖抑制和凋亡作用,分析其抗肿瘤机制。方法体外培养K562细胞,应用不同浓度的青蒿琥酯处理细胞,台盼蓝染色分析细胞活力,WST-1还原法检测细胞增殖,流式细胞术分析细胞凋亡和周期,采用免疫印迹技术分析Bax和Bcl-2表达。结果K562细胞活力随着药物浓度的增加而下降,而FTY720对细胞增殖的抑制作用随药物浓度增加而增加。药物作用72 h,K562细胞的IC50值为95 μmol/L;与对照组比较,50 μmol/L和100 μmol/L青蒿琥酯处理48 h导致S期细胞减少,G2M期细胞增加;当浓度达到200 μmol/L后,G2M期细胞减少,但死亡细胞增加到39.65%。双染和流式细胞术分析发现,100 μmol/L青蒿琥酯作用24 h后,早期凋亡细胞百分率增加;与对照组比较,青蒿琥酯导致细胞内Bax表达增加。结论青蒿琥酯可通过诱导细胞凋亡和抑制细胞增殖而发挥抗肿瘤作用,其线粒体途径可能参与细胞凋亡过程。
关键词〔〕青蒿琥酯;白血病;凋亡
第一作者:孙艳美(1978-),女,讲师,硕士,主要从事中草药免疫作用研究。
青蒿素(artemisinin)是中草药黄花蒿中的抗疟成分,青蒿琥酯(artesunate)为其酯化学修饰的水溶性衍生物〔1〕,对体外培养的肝癌细胞、乳腺癌细胞和肺癌细胞均有不同程度的抑制作用〔2〕。青蒿琥酯抗肿瘤机制涉及诱导活性氧(ROS)产生及ROS依赖的DNA损伤、抑制血管生成、诱导凋亡和细胞周期阻滞〔3〕,但对白血病细胞增殖和凋亡研究较少。本实验将探索青蒿琥酯对白血病K562细胞活力、增殖、周期和凋亡的影响。
1材料与方法
1.1材料RPMI1640培养液(北京迈晨科技有限公司);青蒿琥酯、台盼蓝(百灵威生物科技有限公司);WST-1、PI(碧云天生物科技有限公司);Annexin-V-FITC/PI双染凋亡试剂盒(购自美国eBiocience公司)。
1.2方法
1.2.1细胞培养实验前1 w,自液氮中复苏K562细胞,在含有10%血清的1640培养液中培养,每周传代3次,取对数生长期的细胞用于实验。
1.2.2细胞活力检测接种K562细胞于6孔细胞培养板,实验组加入青蒿琥酯至终浓度分别为12.5,25,50,100,200和400 μmol/L,继续培养至24 h。吹打混匀细胞,取细胞悬液50 μl,加入等量0.4%的台盼蓝染液,染色2 min后,加入血细胞计数板,计数四角大方格细胞总数和蓝色细胞数。细胞活力(%)=活细胞数/细胞总数×100%。
1.2.3细胞凋亡检测收集不同浓度青蒿琥酯处理24 h的K562细胞,每组取1×106个细胞,双染凋亡缓冲液洗涤1次,200 μl缓冲液悬起细胞,加入5 μl的Annexin-V FITC,室温避光孵育30 min。缓冲液洗涤2次,400 μl的缓冲液重悬细胞,加入5 μl PI染液后用流式细胞仪检测分析。
1.2.4细胞增殖检测接种细胞于96孔细胞培养板,分别加青蒿琥酯至0,12.5,25,50,100,200和400 μmol/L,培养至68 h;对照组和实验组每孔加入WST-1溶液20 μl,空白组加入20 μl PBS,继续培养至72 h。用多功能酶联检测分析仪检测450 nm各孔吸光度值(A450),取3次实验的均值代表最终浓度。按公式计算细胞增殖抑制率(IR)。IR(%)=〔1-(实验组A450-空白组A450)/(对照组A450-空白组A450)〕×100%。
1.2.5细胞周期分析收集不同浓度青蒿琥酯处理至48 h的K562细胞,PBS洗涤2次后用80%甲醇溶液固定细胞,置于-20℃保存。检测前,离心弃上清,PBS洗涤细胞,用400 μl的PI染色液重悬细胞,室温染色30 min后流式细胞术分析。
1.3统计学分析计量资料组间比较行t检验。
2结果
2.1不同浓度青蒿琥酯对K562细胞活力的影响随着青蒿琥酯(0,12.5,25,50,100,200和400 μmol/L)药物浓度的增加,细胞活力下降,依次为(98.9±2.3)%,(94.0±6.5)%(94.4±4.5)%,(88.2±5.2)%,(75.4±6.4)%,(67.0±4.8)%,(37.9±6.2)%。
2.2青蒿琥酯对K562细胞凋亡的影响100 μmol/L青蒿琥酯作用24 h后,早期凋亡(2.48±0.9)%、晚期凋亡(9.96±1.5)%和坏死细胞(3.25±0.5)%均比对照组(1.46±0.7)%、(2.79±0.6)%、(1.68±0.4)%增加。
2.3青蒿琥酯对K562细胞Bcl-2家族分子表达的影响100 μmol/L青蒿琥酯作用24 h后,细胞内Bax表达增加,Bcl-2表达无明显变化。见图1。

图1 青蒿琥酯对Bax和Bcl-2表达的影响
2.4青蒿琥酯对K562细胞周期的影响与对照组比较,50 μmol/L青蒿琥酯导致K562细胞S期细胞百分率减少,而G2M期细胞百分率略增加;当浓度达到100 μmol/L和200 μmol/L后,细胞发生明显凋亡,G2M期细胞增加;较高浓度的青蒿琥酯(200 μmol/L)处理后,细胞凋亡可达39.65%,同时发现S和G2M期细胞均减少。见表1。
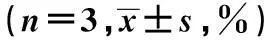
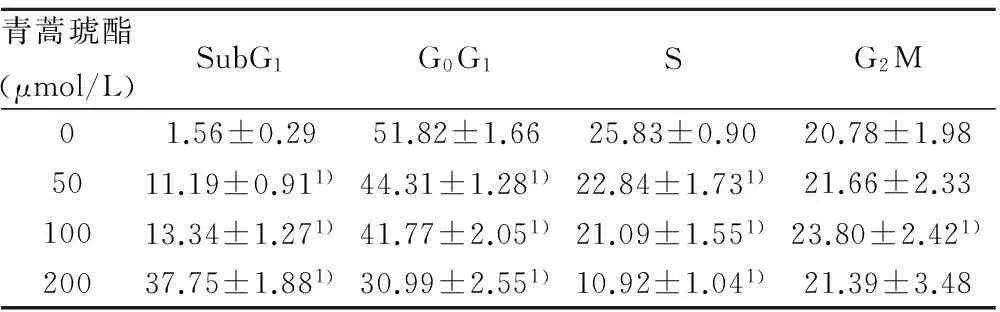
青蒿琥酯(μmol/L)SubG1G0G1SG2M01.56±0.2951.82±1.6625.83±0.9020.78±1.985011.19±0.911)44.31±1.281)22.84±1.731)21.66±2.3310013.34±1.271)41.77±2.051)21.09±1.551)23.80±2.421)20037.75±1.881)30.99±2.551)10.92±1.041)21.39±3.48
与0 μmol/L组比较:1)P<0.05
2.5不同浓度青蒿琥酯对K562细胞增殖的影响随着药物浓度增加,细胞增殖受到明显抑制,加入12.5、25、50、100、200、400 μmol/L青蒿琥酯后,细胞增殖抑制率分别为(6.90±3.3)%,(17.8±5.5)%,(38.4±5.8)%,(52.8±6.1)%,(64.0±5.8)%,(69.9±7.2)%。50%增殖抑制浓度(IC50值)约为95.0 μmol/L。
3讨论
本研究发现,青蒿琥酯处理细胞24 h,低浓度组(≤50 μmol/L)对细胞活力无明显影响,但随着浓度增加,细胞活力明显下降。PI和Annexin-V双染分析证实100 μmol/L青蒿琥酯诱导24 h,细胞以发生早期凋亡为主。
正常生长细胞若凋亡减少、分化能力异常或增殖过于旺盛,往往导致细胞转化和癌变〔4〕。分析药物对肿瘤细胞是否具有诱导凋亡或促进分化作用,是筛选抗肿瘤药物的重要观察指标。有研究报道,青蒿琥脂可导致肺腺癌细胞内ROS增加,并诱导细胞凋亡〔5〕。线粒体是细胞内氧化呼吸,产生能量的细胞器。虽然代谢过程中线粒体产生ROS,但过量的ROS将导致线粒体膜内外电位差下降,线粒体功能损伤〔6〕。Bcl-2家族成员在调控凋亡中发挥重要作用,分为抗凋亡和促凋亡两类,前者包括Bcl-2、Bcl-XL,后者有Bid,Bax,Bad和Bim等〔7〕。抗凋亡和促凋亡分子在线粒体膜的分布,尤其是Bax与Bcl-2的比例和分布是调节线粒体膜通透性和稳定性的关键因素〔8,9〕。ROS与Bcl-2家族成员间具有复杂的关系,例如,ROS耦联的转录因子可促进抗凋亡分子Bax和Bim的表达。本研究结果显示,青蒿琥酯可导致细胞周期变化和诱导凋亡而发挥抗肿瘤效应,通过线粒体途径诱导细胞凋亡。本研究阐明了青蒿琥酯抗肿瘤的机制,对开发利用其新用途提供了理论依据。
参考文献4
1王崇功,吴菁,周永华,等.青蒿素治疗弓形虫病的研究和临床治疗效果的初步观察〔J〕.中国人兽共患病杂志,1997;13(1):79-80.
2冯德宏.青蒿琥酯抗肿瘤作用实验研究〔J〕.实用中医药杂志,2013;29(9):706-7.
3张东,王满元,杨岚.青蒿素类药物新制剂研究进展〔J〕.中国药学杂志,2015;50(3):189-93.
4Steelman LS,Franklin RA,Abrams SL,etal.Roles of the Ras/Raf/MEK/ERK pathway in leukemia therapy〔J〕.Leukemia,2011;25(7):1080-94.
5周陈娟,潘文良,陈同生.青蒿琥酯诱导活性氧依赖性的细胞凋亡〔J〕.中国激光,2011;31(2):1-5.
6Liemburg-Apers DC,Willems PH,Koopman WJ,etal.Interactions between mitochondrial reactive oxygen species and cellular glucose metabolism〔J〕.Arch Toxicol,2015;89(8):1209-26.
7Solaini G,Sgarbi G,Baracca A.Oxidative phosphorylation in cancer cells〔J〕.Biochim Biophys Acta,2011;1807(6):534-42.
8Feng Y,Tian Z,Wan M.Bioeffects of low-intensity ultrasound in vitro:apoptosis,protein profile alteration,and potential molecular mechanism〔J〕.J Ultrasound Med,2010;29(6):963-74.
9Mao H,Gu H,Qu X,etal.Involvement of the mitochondrial pathway and Bim/Bcl-2 balance in dihydroartemisinin-induced apoptosis in human breast cancer in vitro〔J〕.Int J Mol Med,2013;31(1):213-8.
〔2015-01-17修回〕
(编辑徐杰)
The effects of cell proliferation and apoptosis induced by Artesunate on leukemia cell
SUN Yan-Mei, ZHAO Liang-Zhong, LI Qiang,etal.
Academy of Laboratory,Jilin Medical University,Jilin 132013,Jilin,China
【Abstract】ObjectiveTo study the effect of artesunate on inhibition of proliferation and apoptosis of myeloid leukemia cell line K562, and analyze its mechanism of antitumor.MethodsIn vitro, K562 cells were cultivated and applicated by different concentrations of artesunate. The cell vitality was analyzed by trypan blue staining. Proliferation was analyzed by WST-1 reduction method.Apoptosis and cycle of cells were analyzed by flow cytometry, Bax and Bcl-2 expressions were tested by Western blotting.ResultsK562 cell vitality decreased with the increase of drug concentration, and inhibition of cell proliferation was increased with the increase of FTY720 drug concentration. After 72 h of drug effect, K562 IC50 was 95 μmol/L.Compared with those of control group, 50 and 100 μmol/L artesunate for 48 h caused a decline of K562 cells in the S phase, and slightly increased in the G2M phase. Artesunate (200 μmol/L) induced reduction of K562 cells obviously in G2M phase,and the death rate was 39.65%. At 24 h, early apoptotic cells rate was increased in the concentration of 100 μmol/L artesunate by double staining analysis and flow cytometry. Compared with that of control group, Bax expression was higher by artesunate.ConclusionsArtesunate plays a role on anti-tumor by inducing cell apoptosis and inhibiting cell proliferation. The mitochondrial pathway may be involved in the process of cell apoptosis.
【Key words】Artesunate;Leukemia; Apoptosis
通讯作者:李妍(1972-),女,教授,博士,硕士生导师,主要从事基础免疫学研究。
基金项目:国家自然科学基金项目(82102953);吉林省科技厅重大科技攻关项目(20140203012YY);吉林省科技厅中青年科技创新领军人才及团队项目(20130521018JH);吉林省卫生厅项目(2012Z076)
中图分类号〔〕R285.6〔
文献标识码〕A〔
文章编号〕1005-9202(2015)23-6647-02;doi:10.3969/j.issn.1005-9202.2015.23.003
