7-溴-4-二氢色原酮的合成新方法*
2016-01-17齐风佩王姣亮彭晓赟湖南城市学院化学与环境工程学院湖南益阳413000
齐风佩,刘 蓉,王姣亮,彭晓赟,谢 丹(湖南城市学院化学与环境工程学院,湖南益阳 413000)
7-溴-4-二氢色原酮的合成新方法*
齐风佩,刘蓉,王姣亮,彭晓赟,谢丹
(湖南城市学院化学与环境工程学院,湖南益阳413000)
摘要:以3-溴苯酚为起始原料,经酰基化、Frise重排及关环反应合成了7-溴苯并吡喃酮(5); 5在威尔金森催化剂氯化三(三苯基膦)合铑(Ⅰ)[Rh(PPh3)3Cl]催化下与氢气经加成反应合成了7-溴-4-二氢色原酮(6),其结构经1H NMR和MS确证。合成6的最佳反应条件为:5 0.329 mol,乙醇为溶剂,c(5)=0.4 mol·L-1,4 mol% Rh(PPh3)3Cl为催化剂,在0.3 MPa氢气压力下,于70℃反应20 h,收率79.8%。
关键词:Frise重排;色原酮;威尔金森催化剂;氢化;合成
6353033,E-mail:qifp312@163.com
4-二氢色原酮是一类具有优良生物活性的天然化合物,具有优良的抗癌[1]、抗菌[2]、抗炎和抗变态反应活性[3]以及抗血小板凝聚[4]等活性。7-溴-4-二氢色原酮(6)是一类重要中间体,其合成收率低,难度大,销售价格是同类产品6-溴-4-二氢色原酮价格的二十多倍。有关6的合成报道较少,目前较经典的有三种方法:一是3-溴苯酚(1)与β-卤代丙酸在碱性条件下经回流反应制得芳氧丙酸钠,再用盐酸酸化得芳氧丙酸,继而在室温下通过浓硫酸脱水[5-10]或微波辐射条件下用多聚磷酸脱水环合制得色原酮[11],或者将芳氧丙酸经草酰氯转化为酰氯后在无水AlCl3作用下经傅-克酰基化制得6[12];二是以合成的7-溴-4-四氢色原酮为原料,利用二异丁基氢化铝(DIBAL-H)于-80℃还原得6[13];三是以1与丙烯腈在碱性条件下制得芳氧丙腈,再在三氟甲磺酸(TfOH)条件下水解直接环合制得6[14-15]。方法一反应时间长、收率低,且微波条件下的反应底物用量不能过大,有一定局限性;方法二要求低温,一旦温度偏高,则收率降低,甚至得不到产物,该反应温度难以控制,操作困难;方法三所用丙烯腈有剧毒,不利于环保,且关环反应后生成两种异构体,极性相近,分离较困难。
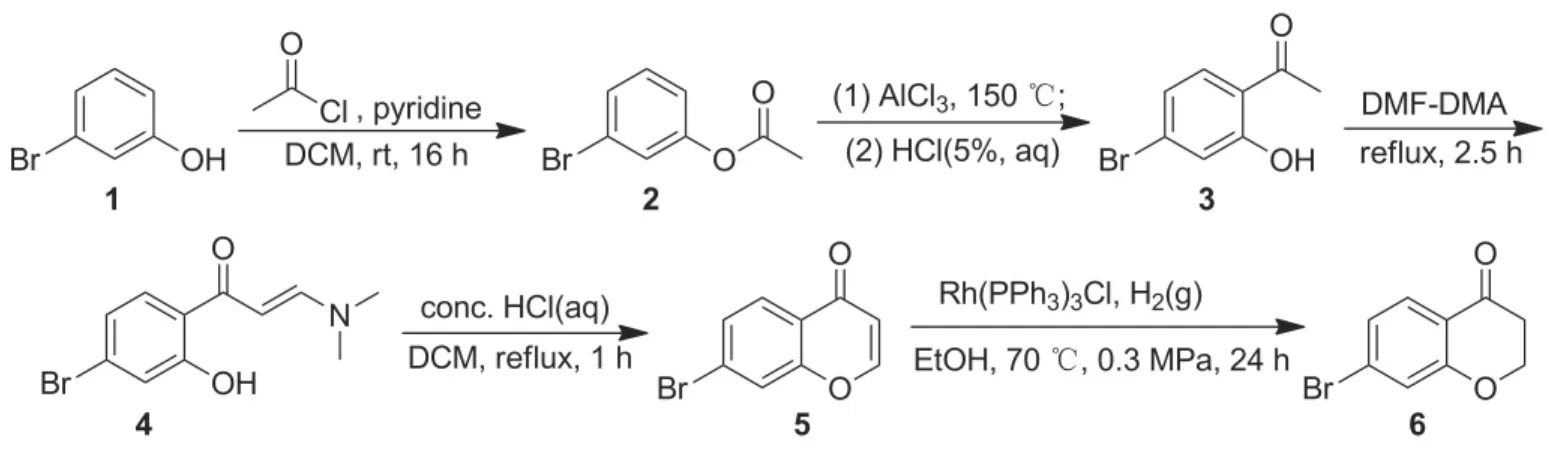
Scheme 1
本文以1为起始原料,经酰基化、Frise重排及关环反应合成了7-溴苯并吡喃酮(5); 5在威尔金森催化剂氯化三(三苯基膦)合铑(Ⅰ)[Rh(PPh3)3Cl]催化下与氢气经加成反应合成了6(Scheme 1),收率79.8%,其结构经1H NMR和MS确证。并对6的合成条件进行优化。
1 实验部分
1.1仪器与试剂
Varian 400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);安捷伦1200型液相色谱质谱联用仪。
所用试剂均为分析纯。
1.2合成
(1)乙酸间溴苯酚酯(2)的合成
在反应瓶中依次加入1 100 g(0.581 mol),吡啶48 g和二氯甲烷1.2 L,搅拌使其溶解;于0℃缓慢滴加乙酰氯47.6 g(0.622 mol),滴毕,于室温反应过夜(TLC跟踪)。用二氯甲烷(3×300 mL)萃取,合并萃取液,用无水硫酸钠干燥,减压浓缩得淡黄色油状液体2 116 g,收率93.3%;1H NMR δ:7.28~7.30(dd,J=0.8 Hz,0.8 Hz,1H),7.14~7.21(m,2H),6.95~6.98(m,1H),2.21(s,3H)。
(2)2-羟基-4-溴苯乙酮(3)的合成
在反应瓶中加入无水三氯化铝98.6 g(0.741 mol)和2 106 g(0.498 mol),快速混合均匀,于140℃反应至呈凝固状态;继续反应0.5 h。冷却至室温,加入5%盐酸800 mL,加热使固体溶解;冷却至室温,用二氯甲烷(3×300 mL)萃取,合并萃取液,有机层分别用水和饱和食盐水洗涤,无水硫酸钠干燥,旋蒸除溶得黄色油状液体3 106 g,收率100%;1H NMR δ:12.34(s,1H),7.58(d,J=8.4 Hz,1H),7.17(d,J=2.0 Hz,1H),7.05~7.03(m,1H),2.61(s,3H)。
(3)1-(2-羟基-4-溴苯基)-3-二甲氨基丙酮(4)的合成
在反应瓶中依次加入3 106 g(0.498 mol)和N,N-二甲基甲酰胺二甲基缩醛(DMF-DMA)400 mL(3 mol),搅拌使其溶解;回流反应2.5 h。冷却至室温,旋蒸除溶后经硅胶柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=1∶1]纯化得黄色固体4 116 g,收率87.1%;1H NMR(DMSO-d6)δ:15.00(s,1H),7.94~7.86(m,2H),7.02~6.97(m,2H),5.95(d,J=11.6 Hz,1H),3.21(s,3H),2.99(s,3H)。
(4)5的合成
在反应瓶中依次加入4 116 g(0.430 mol)和二氯甲烷1.5 L,搅拌使其溶解;加入浓盐酸360 mL,回流反应1 h(TLC跟踪)。静置冷却至室温,分液,水相用二氯甲烷(3×200 mL)萃取,合并萃取液和有机相,依次用水和饱和食盐水洗涤,无水硫酸钠干燥,旋蒸除溶得白色固体5 90.5 g,收率93.6%;1H NMR δ:8.07(d,J=8.4 Hz,1H),7.82(d,J=6.0 Hz,1H),7.66(d,J=1.6 Hz,1H),7.54~7.52(m,1H),6.34(d,J=6.4 Hz,1H)。
(5)6的合成
在反应瓶中依次加入5 74 g(0.329 mol),Rh(PPh3)3Cl 12 g(13.2 mmol)和乙醇820 mL,搅拌使其均匀;在0.3 MPa氢气压力下于70℃反应20 h(TLC跟踪)。冷却至室温,旋蒸脱溶后经硅胶柱层析(洗脱剂:A=20∶1)纯化得白色固体6 58.5 g,收率79.8%;1H NMR δ:7.75(d,J=8.0 Hz,1H),7.19~7.15(m,2H),4.55(t,J=6.4 Hz,2H),2.81(t,J=6.4 Hz,2H); MS m/z:228.8{[M + H]+}。
2 结果与讨论
2.1反应条件优化
在由1合成5的过程中,每一步反应收率均很高,但在由5经还原反应合成6的过程中,反应条件对收率影响较大。为了寻找最佳反应条件,分别考察了溶剂、氢气压力、催化剂种类及其用量和反应时间对反应的影响。
(1)溶剂
催化氢化还原反应最常用的溶剂是甲醇、乙醇、四氢呋喃和乙酸乙酯等,本文选择无毒的乙醇为溶剂,反应物浓度约为0.4 mol·L-1。
(2)氢气压力
5 0.329 mol,其余反应条件同1.2(5),考察氢气压力对反应的影响。实验发现,压力过小会延长反应时间;压力过大,会产生安全隐患。采用0.3 MPa氢气压力较佳。
(3)催化剂及其用量
实验发现,利用还原剂NiCl/NaBH4,LiAlH4和DIBAL-H(-65℃)还原5时,反应不能进行或收率低;利用Pd/C和Raney Ni与H2催化加成时,反应不完全且大部分产物为4-二氢色原酮。
由于威尔金森催化剂只还原烯烃而对羰基无影响,且能很好地控制副反应的发生,是该反应的较佳选择。本文选择威尔金森催化剂催化还原5。并考察其用量对反应的影响。结果表明,催化剂用量为4 mol%时,反应效果最好,收率79%,增加或减少催化剂用量均会导致副产物的生成。
(4)反应时间
反应时间的影响结果见表1。由表1可以看出,当反应时间为20 h,反应处于最佳状态,收率80%;缩短反应时间反应不完全,延长反应时间则会产生副产物。
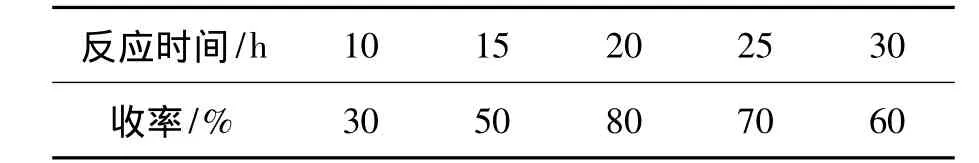
表1 反应时间对氢化反应的影响*Table 1 Effects of reaction time on hydrogenation reaction
综上所述,6的最佳合成条件为:5 0.329 mol,乙醇为溶剂,4%mol Rh(PPh3)3Cl为催化剂,在0.3 MPa氢气压力下于70℃反应20 h,收率79.8%。
该方法具有收率高、反应条件温和、操作简便等优点,适合规模化生产。
参考文献
[1]Jack Bikker,Ellen Myra Dobrusin,Annette Marian Doherty,et al.Bicyclic inhibitors of protein farnesyl transferase[P].US 6 528 535,2003.
[2]Nakib Al T,Bezjak V,Meegan M J,et al.Synthesis and antifungal activity of some 3-benzylidenechroman-4-ones,3-benzylidenethiochroamn-4-ones and 2-benzylidene-1-tetralones[J].Eur J Med Chem,1990,25(5):455-462.
[3]胡春.4-色满酮类衍生物的合成及其生物活性研究[D].沈阳:沈阳药科大学,1998.
[4]Della Loggia R,Negro P D,Tubaro A.Homoisoflavanones as antiinflammatory principles of muscari comosum[J].Planta Med,1989,55(6):587-590.
[5]Canalini G,Degari I,Fochi R,et al.Heteroaromatic cations X hydrolysis of some chromylium,perchlorate derivatives[J].Ann Chim(Rome),1967,57(10):1045-1072.
[6]攀能廷.有机合成事典[M].北京:北京理工大学出版社,1995.
[7]Krollpfeiffer F,Schultze H.Thiochromanones and transformation products[J].Ber,1923,56B:1919-1923.
[8]Fravolni A,Rodriguez S C.Fluoro-2,3-dihydro-1-benzothiopyran-4-ones[J].Ann Chim(Rome),1968,58(10):1155-1160.
[9]William H,Perkin J R,Robert R.Synthesis of chromanones and derivates[J].Proc Chem Soc,1912,28(395):7-8.
[10]Krollpfeiffer F,Schultze H.Ring closures from βphenoxy propionic acids to chromanones[J].Ber,1924,57B:206-207.
[11]李红亚,刘卉闵,吴国江,等.微波辐射下β-芳氧丙酸和色满酮的合成[J].河北大学学报(自然科学版),2008,4(28):399-402.
[12]张磊,谢普会.间溴苯氧丙酸与7-溴苯并二氢吡喃-4-酮的合成[J].精细化工中间体,2011,41(3):29-31.
[13]Elizabeth M Bacon,Jeromy J Cottell,Ashley Anne Katana,et al.Antiviral compounds[P].US 2 012 068 234,2012.
[14]Tamas Patonay,Attila Vasas,Attila Kiss-Szikszai,et al.Efficient synthesis of chromones with alkenyl functionalities by the heck reaction[J].Aust J Chem,2010,63(11):1582-1593.
[15]Zhong Y L,David T Boruta,Donald R Gauthier Jr.An efficient synthesis of 4-chromanones[J].Tetrahedron Letters,2011,52(38):4824-4826.
·研究简报·
A New Method for Synthesis of 7-Bromochroman-4-one
QI Feng-pei,LIU Rong,WANG Jiao-liang,PENG Xiao-yun,XIE Dan
(College of Chemistry and Environmental Engineering,Hunan City University,Yiyang 413000,China)
Abstract:7-Bromo-benzopyrone(5)was synthesized by acylation,Frise rearrangement and ring closing reaction using 3-bromophenol as the starting material.7-Bromochroman-4-one(6)was synthesized by hydrogenation addition of 5 catalyzed by Wilkinson’s catalyst Rhodium(Ⅰ)tris(triphenylphosphine)chloride[Rh(PPh3)3Cl].The structure was confirmed by1H NMR and MS.The optimum reaction conditions for synthesizing 6 were as follows:5 0.329 mol,ethanol as the solvent,c(5)=0.4 mol·L-1,4% mol Rh(PPh3)3Cl as the catalyst,under 0.3 MPa of hydrogen pressure,at 70 ℃for 20 h,the yield was 79.8%.
Keywords:Frise rearrangement; chromone; Wilkinson’s catalyst; hydrogenation; synthesis
作者简介:齐风佩(1983-),女,汉族,河南南阳人,硕士,讲师,主要从事有机合成和树脂改性合成及其应用研究。Tel.0731-
基金项目:益阳市科技计划资助项目(2013JZ06)
收稿日期:2014-06-27;
修订日期:2015-04-01
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.05.0435 *
文献标识码:A
中图分类号:O626
