异氟烷麻醉后老年大鼠学习/记忆功能改变与脑海马CA1区谷氨酸水平变化的关系
2015-12-29徐诚实,曲向东,吴安石等
异氟烷麻醉后老年大鼠学习/记忆功能改变与脑海马CA1区谷氨酸水平变化的关系
徐诚实曲向东吴安石1岳云1王庚
(北京积水潭医院麻醉科,北京100035)
摘要〔〕目的观察异氟烷麻醉后老年大鼠学习/记忆功能障碍模型中海马CA1区谷氨酸浓度的动态变化,探讨术后认知功能障碍(POCD)的可能机制。方法将38只老年大鼠(≥18月龄)随机分为3组:对照组(n=6;不接受迷宫训练和麻醉)、空气吸入组(n=7,接受迷宫训练但不接受麻醉)、异氟烷麻醉组(n=25,接受迷宫训练和麻醉)。应用Morris水迷宫对大鼠进行学习/记忆功能测试,根据迷宫测试成绩将异氟烷麻醉组大鼠进一步分为学习/记忆功能明显受损亚组(MIS组)和学习/记忆功能无明显受损亚组(NMIS组)。应用活体脑微透析系统收集不同时间点大鼠脑海马CA1区的脑脊液并应用高效液相色谱法(HPLC)测定脑脊液样本中的谷氨酸浓度。结果接受异氟烷麻醉的大鼠学习/记忆功能明显受损的发生率为12.0%(3/25)。异氟烷麻醉组大鼠麻醉过程中的谷氨酸浓度均明显低于对照组和空气吸入组(P<0.05)。异氟烷麻醉组大鼠麻醉结束后1 h时脑脊液谷氨酸浓度明显低于空气吸入组(P<0.01),但与对照组比较无统计学差异(P>0.05)。对照组和空气吸入组大鼠在各时间点脑脊液谷氨酸浓度均无统计学差异(P>0.05)。 异氟烷麻醉过程中,对照组和空气吸入组脑脊液谷氨酸浓度均明显高于NMIS 亚组(P<0.05)和MIS亚组(P<0.05)。麻醉1 h后,空气吸入组谷氨酸水平明显高于NMIS和MIS两亚组(P<0.01),而MIS亚组谷氨酸水平明显低于对照组(P<0.05)。麻醉后24 h时,MIS亚组谷氨酸水平明显高于对照组和NMIS亚组(P<0.05和<0.01)。麻醉后首次水迷宫训练时,MIS组谷氨酸浓度明显高于NMIS组(P<0.05)。麻醉48 h以后各个时间点,MIS亚组谷氨酸水平均明显高于其余3组。 结论异氟烷麻醉学习/记忆功能障碍大鼠模型中海马CA1区谷氨酸水平呈持久性升高,提示麻醉后脑内高谷氨酸水平可能与麻醉药引发的学习/记忆功能障碍的病理生理过程有关。
关键词〔〕谷氨酸;异氟烷;学习/记忆功能受损;Morris水迷宫
中图分类号〔〕R749〔文献标识码〕A〔
基金项目:国家自然科学基金(No.30872435)
通讯作者:王庚(1970-),男,主任医师,副教授,主要从事神经阻滞、脑功能、血液保护研究。
1首都医科大学附属北京朝阳医院麻醉科
第一作者:徐诚实(1981-),男,住院医师,主要从事神经阻滞、脑功能、血液保护研究。
作为脑内最丰富且最重要的兴奋性神经递质,谷氨酸参与了脑内大部分功能。然而,谷氨酸浓度过高会导致细胞肿胀或神经细胞坏死等细胞结构或功能的损伤〔1~4〕,即兴奋毒性效应。有学者认为兴奋毒性效应是神经细胞死亡以及认知功能障碍的最终共同通路,是多种神经系统疾病的基础〔5~9〕。虽然在多种原因导致的认知功能障碍中都伴有脑内或血液谷氨酸水平的变化〔10,11〕,但是否在术后认知功能障碍(POCD)发病过程中也伴有谷氨酸浓度水平的变化及其变化趋势至今仍不清楚。本文拟分析异氟烷引发的认知功能受损与谷氨酸浓度变化之间的关系。
1材料和方法
1.1实验动物在得到医院实验动物伦理委员会批准后,从四川省医学科学院实验动物中心订购老年大鼠50只(年龄>18月,体重400~550 g)。将大鼠在标准饲养箱中喂养,饲养室和实验室温度(22±2)℃,湿度(55±5)%;安静环境,避免强光、噪音等刺激;12∶12 h的生活节律下自由进食进饮。所有大鼠均常规熟悉实验室环境和实验人员2 w。
1.2海马微透析模型的建立及分组经大鼠尾静脉按照15 mg/kg的速度注入异丙酚,待大鼠体动反应消失后按照10 mg·kg-1·h-1的速度持续泵注异丙酚维持麻醉。用16G套管针对大鼠进行气管插管,插管成功后将大鼠固定在小动物立体定位仪(ASI公司,美国)上并调整螺丝使大鼠颅顶呈水平位。应用小动物呼吸机进行机控呼吸(潮气量7~9 ml/min,呼吸频率65~70次/min,吸呼比1∶2),将儿童脉搏氧饱和度探头固定于大鼠脚趾,监测SpO2;根据SpO2调节呼吸参数,使SpO2≥95%。将小动物体温自动控制器温度探头置入大鼠直肠并将温度设为38℃以维持大鼠正常体温。切皮前备皮并用强力碘将备皮区域消毒后酒精脱碘,常规铺高压灭菌消毒洞巾,操作过程严格执行无菌操作。在小动物立体定位仪引导下将微透析探针(CMA/12 14/02,CMA/Microdialysis)准确置入大鼠海马CA1区(前囟向后4.5 mm,旁开2 mm,深度为颅骨下2 mm),然后用消毒过的铜丝和牙粉将导管固定在大鼠颅骨上。所有大鼠均常规喂养1 w,如伤口愈合良好、无渗血渗液、活动状态佳、无神经损害症状等即进行水迷宫测试和微透析实验。
最终有38只大鼠纳入实验,随机分为3组:对照组(n=6;不接受迷宫训练和麻醉)、空气吸入组(n=7,接受迷宫训练但不接受麻醉)和异氟烷麻醉组(n=25,接受迷宫训练和麻醉)。在特定的时间点收集微透析组大鼠海马CA1区脑脊液。
1.3行为学测试应用Morris水迷宫对大鼠进行学习/记忆能力测试,分为定向航行实验和空间探索实验两个部分。
定位航行试验用于测量大鼠获取空间学习记忆的能力。将水迷宫分为4个象限,试验开始前至少2 h将大鼠放入池中自由游泳90 s,不放置平台,让其熟悉迷宫环境。正式进行水迷宫测试时,将平台置于某一象限中部,将大鼠分别从4个象限不同入水点面向池壁放入水池,直至找到隐藏在水面下的平台为止。找到平台后允许动物在平台上滞留60 s;如果动物在90 s内没有找到平台,则实验者帮助动物找到平台(潜伏期记为120 s),在平台上休息60 s,再进行下次实验。通过自动录像系统记录大鼠找到平台的时间(逃避潜伏期,ELP)、路线图、游泳速度等。吸入空气或异氟烷麻醉前后的行为学测试分别历时5 d,每天上、下午各进行1次。
空间探索试验用于评测大鼠保持对平台空间位置记忆的能力。在第5天的最后一次定位巡航试验后去除平台,然后任选一个入水点将大鼠放入水池中,记录大鼠在90 s内搜索平台的路线图和在目标区域的滞留时间。
Morris水迷宫检测结束后,水池内换成清水,使水面略低于平台进行大鼠视力测试,以检测大鼠视力是否正常。
1.4异氟烷麻醉将大鼠置入特制的麻醉箱内进行异氟烷麻醉,异氟烷浓度为1.2%,历时2 h。麻醉过程中将小动物体温自动控制器体温探头置入大鼠直肠,并将温度设定为38℃。麻醉过程中常规监测血氧饱和度并应用无创小动物血压计(ZH-HX-Z,安徽省)测量尾静脉血压。
1.5海马脑脊液微透析样本的获取除异氟烷麻醉过程外,所有活体微透析实验均在大鼠清醒、自由活动条件下完成。将大鼠移至自由活动大鼠微透析系统内,在大鼠合作的情况下将探针置入导管抵达大鼠海马,连接自由活动系统。微透析系统内应用人工脑脊液(内含NaCl 147 mmol/L,KCl 2.7 mmol/L,CaCl21.2 mmol/L,MgCl20.85 mmol/L)灌注,微量泵(CMA/102 microdialysis pump,CMA/Microdialysis AB,Stockholm,Sweden)泵速为2.5 μl/min并预充1 h以确保微透析系统内人工脑脊液灌注完全。未进行行为学测试前进行一次微透析,此后分别在麻醉前行为学测试结束后、麻醉过程中、麻醉后1、12、24和48 h以及麻醉后每次行为学测试后均进行微透析操作。微透析样本均在0℃条件下收集且收集时间设定为15 min,收集完毕后将微透析样本立即转移到-80℃冰箱保存备测。
1.6质量控制接受异氟烷麻醉的大鼠在麻醉过程中均进行动脉血气分析(见表1),麻醉过程中发生低氧血症的大鼠均不纳入研究。实验结束后,用水合氯醛麻醉大鼠并用磷酸盐缓冲液(PBS)+10%甲醛溶液进行灌注,待组织固定后取脑并将脑组织沿冠状面切成40 μm厚的薄片进行苏木素-伊红(HE)染色以确定微透析探针位置,位置不当者予以排除。
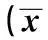
表1 异氟烷麻醉中生理指标和动脉血气分析结果 ± s)
1.7谷氨酸浓度的测定应用高效液相色谱法(HPLC,Agilent 1200)测定微透析样本中的谷氨酸浓度。HPLC系统由四元泵(Agilent G 1311A)、荧光探测仪(G 1321 A)、柱温箱(Agilent G 1316A)以及安捷伦化学工作站组成。(1)柱前自动衍生化:取5 mg邻苯二甲醛(OPA)溶于120 μl甲醇中,充分溶解后加入10 μl β-巯基乙醇和1 ml 0.2 mol硼酸缓冲液(pH 9.2) 摇匀避光4℃冷藏备用。(2)色谱条件:色谱柱ZORBAX Eclipse AAA(4.6×150 mm,5 μm);流动相,A为缓冲液,甲醇:四氢呋喃=400∶95∶5;B为缓冲液,甲醇=120∶380,缓冲液为20 mmol/L乙酸钠溶液(pH 7.2)。梯度洗脱程序:0~10 min,B%为0%~65%;10~12 min,B%为63%~63%;12.00~12.01 min,B%为63%~100%;12.01~17.00 min,B%为100% ~100%;17.00~18.00 min,B%为100%~0%;18.00~22.00 min,B%为0%~0%。流速:0.8 ml/min;检测波长:激发光波长λex=340 nm,发射光波长λem = 450 nm。柱温40℃,进样量15 μl。(3)自动程序进样:25 μl氨基酸样品溶液,加入7.5 μl衍生化试剂,自动混匀6次,反应0.5 min后立即进样。
1.8统计学方法应用SPSS11.5软件行方差分析和双变量相关分析。
2结果
2.1水迷宫测试成绩若异氟烷麻醉组麻醉后水迷宫训练的逃避潜伏期较同一时间点空气吸入组的平均逃避潜伏期延长超过1.96倍SD则认为该大鼠学习/记忆功能明显受损。依此标准,将异氟烷麻醉组大鼠分为学习/记忆功能明显受损亚组(MIS组)和学习/记忆功能无明显受损亚组(NMIS组)〔12〕。依此标准,接受异氟烷麻醉的大鼠学习/记忆明显受损的发生率为12%(3/25)。
2.1.1定位航行实验(学习能力)见图1。
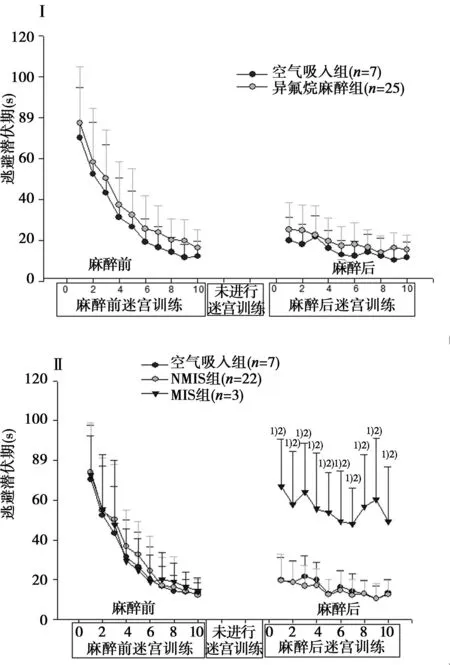
2.1.2空间探索试验(记忆能力)麻醉前后定位航行实验测试完毕2 d后均进行空间探索实验以测试大鼠对平台空间位置的记忆能力。撤去平台后观察90 s内大鼠在目标区域的滞留时间,结果见图2。
2.1.3行为学测试(游泳速度)接受行为学测试的各组大鼠在麻醉前后游泳速度均无统计学差异,说明微透析探针置入和异氟烷麻醉均未对大鼠的运动能力造成明显损害,见图3。
2.2谷氨酸浓度
2.2.1对照组、空气吸入组和异氟烷麻醉组大鼠不同时间点谷氨酸浓度变化见图4Ⅰ,麻醉过程中接受异氟烷麻醉的大鼠谷氨酸浓度明显低于对照组和空气吸入组(P=0.015,0.011);在麻醉后1 h时间点上接受异氟烷麻醉的大鼠谷氨酸浓度明显低于空气吸入组(P<0.01),而与对照组相比较无明显统计学差异(P=0.79)。而在其他时间点上接受异氟烷麻醉的大鼠谷氨酸浓度与对照组和空气吸入组相比较均无明显统计学差异。
与空气吸入组比较:1)P<0.01;与MIS亚组比较:2)P<0.01 图1 麻醉前后行为学测试成绩
2.2.2对照组、空气吸入组、NMIS组和MIS组大鼠不同时间点谷氨酸浓度变化见图4Ⅱ对照组和空气吸入组大鼠谷氨酸浓度在各个时间点上均无明显统计学差异。麻醉过程中NMIS组和MIS组大鼠谷氨酸浓度均明显低于对照组和空气吸入组(P<0.05)。麻醉后1 h时间点上空气吸入组大鼠谷氨酸浓度明显高于NMIS组和MIS组 (P<0.01),MIS组的谷氨酸浓度明显低于对照组(P=0.03),而与空气吸入组相比较无明显统计学差异。在麻醉后24 h时间点上MIS组谷氨酸浓度较对照组和NMIS组明显升高(P=0.029),而与空气吸入组比较无明显统计学差异。MIS组谷氨酸浓度在麻醉后84 h时间点上明显高于其余三组(P=0.03,0.019和0.01)。麻醉后第一次行为学测试后MIS组的谷氨酸浓度明显高于NMIS组(P=0.032),而在麻醉后行为学测试的其他时间点上MIS组的谷氨酸浓度均明显高于其余3组(P<0.01)。
与空气吸入组比较:1)P<0.05;与MIS比较:2)P<0.05 图2 大鼠定位航行试验在目标区域滞留时间
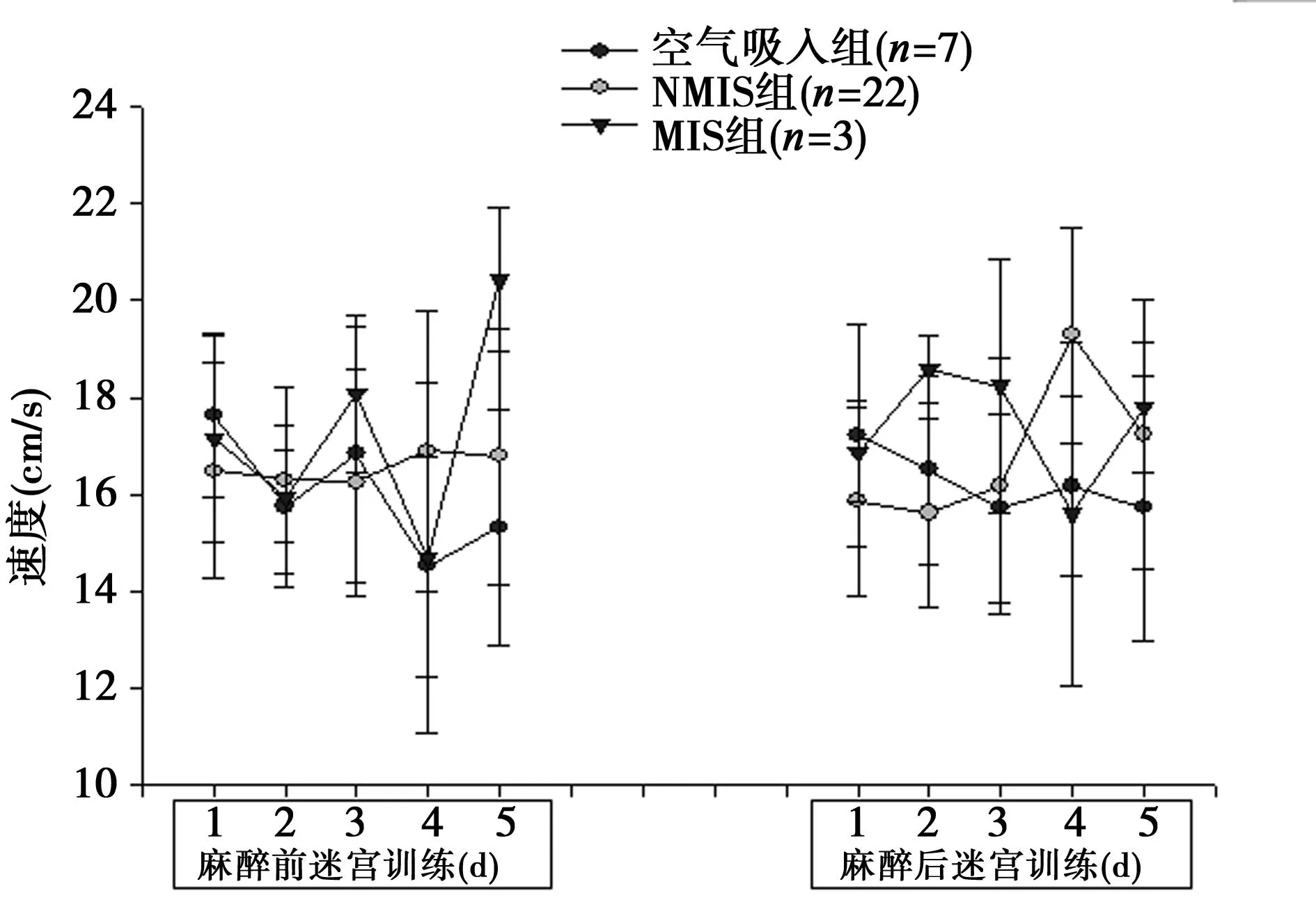
图3 麻醉前后平均游泳速度
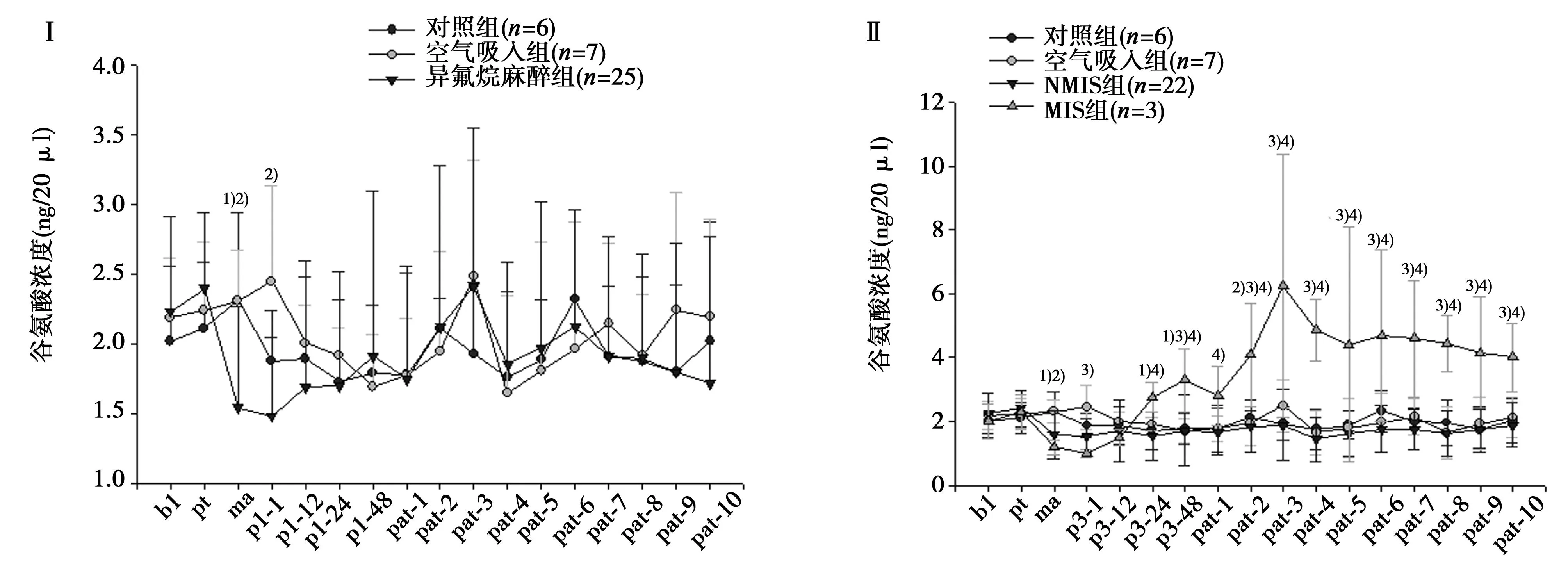
与空气吸入组比较:1)P<0.05,2)P<0.01;与对照组比较:3)P<0.05;与MIS组比较:4)P<0.05;bl= 基础状态; pt=麻醉前行为学测试后浓度; ma=麻醉中浓度; pa-1=麻醉后1 h浓度; pa-12=麻醉后12 h浓度; pa-24=麻醉后24 h浓度; pa-48=麻醉后48 h浓度;pat-1~pat-10分别为麻醉后第一~十次行为学测试浓度 图4 麻醉前行为学测试、麻醉中和麻醉后各个时间点各组谷氨酸浓度变化趋势图
2.3麻醉后各个时间点行为学测试成绩与谷氨酸相关性除麻醉后NMIS组第5次和第10次行为学测试外,各组海马内谷氨酸浓度的水平与大鼠的行为学测试成绩之间均有明显相关性(P<0.05)(表2)。
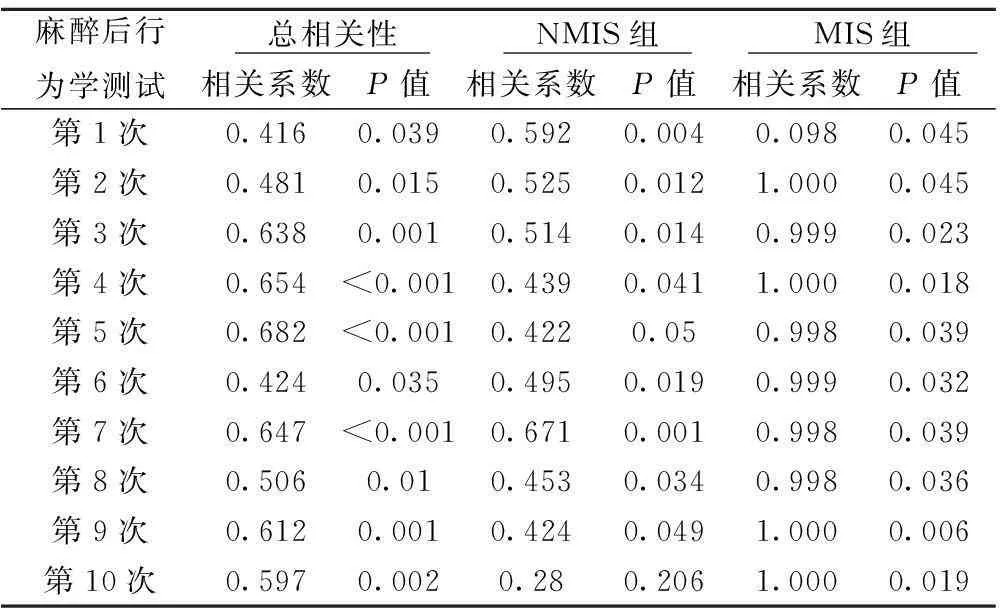
表2 麻醉后各个时间点行为学测试成绩与谷氨酸浓度相关性
3讨论
由于POCD的患者临床表现与早期阿尔茨海默病(AD)类似而且POCD可能进一步发展为AD,因此有人认为POCD是AD的一种前期病变〔1〕,且POCD与AD的病理机制类似〔1,10,11〕。近年来麻醉也被认为是除了年龄之外的另一个潜在的危险因素〔13~17〕。到目前为止虽然有许多有关麻醉药引发认知功能障碍的临床和动物实验报道,但是确切机制仍不清楚〔18~21〕。谷氨酸被视为哺乳动物中枢神经系统中最重要的兴奋性经递质〔22〕,正常情况下谷氨酸在长时程增强(LTP)有重要作用,而LTP被认为是学习和记忆过程的基础,大脑海马LTP是记忆形成和巩固过程中神经元活动的客观指标〔23〕。然而,谷氨酸是一把双刃剑,在特定情况下可以从一种正常的神经递质转变为一种神经毒性物质〔24〕,对脑产生兴奋性毒性作用〔2~4〕。有学者认为兴奋毒性效应是神经细胞死亡以及认知功能障碍的最终共同通路,是多种神经系统疾病的基础〔5~9〕,与脑缺血缺氧性疾病、创伤性脑损伤、AD、帕金森病和亨廷顿病等多种神经系统疾病中神经细胞死亡有关〔25〕。虽然关于谷氨酸兴奋毒性效应在认知功能受损中的始因性作用已有诸多报道,但是有关异氟烷导致的认知功能受损与谷氨酸系统之间相关性的直观动态性的证据极少。
蔡桂兰等〔26〕发现遗忘型轻度认知障碍(aMCI)及AD的患者血清谷氨酸浓度较正常对照者明显升高。疏树华等〔27〕也发现患有POCD的老年患者颅内静脉血内谷氨酸浓度明显高于未患有POCD的老年患者。虽然他们的研究成果显示谷氨酸浓度升高与认知功能减退有关,且静脉血中谷氨酸浓度与脑内谷氨酸浓度有良好相关性,但是静脉内谷氨酸浓度升高只是脑内谷氨酸浓度的一个反映而并非脑脊液中谷氨酸的真实浓度。而且这些研究都是位相性而非连续性的,因此不能反映在POCD发生发展过程中脑脊液谷氨酸浓度的真实水平和变化趋势。本研究结果与以上研究不同。更为重要的是,麻醉后谷氨酸浓度升高与异氟烷麻醉后大鼠的迷宫成绩之间有明显相关。也就是说,谷氨酸浓度越高,学习记忆能力越差,这与Temple等〔28〕的研究结果相符合。且Lipton等〔29〕也认为,谷氨酸的兴奋性毒性作用是以持续、轻度、慢性、紧张性的方式而非位相性的方式起作用的。
虽然有文献报道称学习过程也会导致谷氨酸浓度轻微升高〔30〕,但是笔者认为麻醉后发生认知功能受损大鼠脑脊液中谷氨酸浓度升高并非由迷宫学习过程引起,因为麻醉前接受行为学测试后大鼠脑脊液谷氨酸浓度并未表现出明显升高而且在认知功能无明显受损大鼠的脑脊液中也无谷氨酸浓度明显升高。同样,虽然有众多文献报道脑损伤也会导致谷氨酸浓度升高〔31,32〕,但是笔者认为此持续性谷氨酸浓度升高并非与海马区微透析导管植入引起的脑损伤有关。据文献报道〔31〕,如果此谷氨酸浓度升高来源于脑组织损伤,那么谷氨酸浓度会比该实验中的谷氨酸浓度高很多,因此,笔者将此谷氨酸浓度升高归因于众多文献报道过的异氟烷麻醉诱发的神经元受损〔33~36〕。正因为神经元受损,因此细胞内的谷氨酸外流至细胞外间隙进而引发脑脊液中谷氨酸浓度升高。而此持续缓慢的谷氨酸浓度轻度升高可能是异氟烷引发的认知功能受损的早期表现。
综上,异氟烷引起的认知功能受损伴有脑海马CA1区谷氨酸浓度的持续性升高,提示其可能参与异氟烷引发的认知功能受损的病理生理过程。
4参考文献
1Grape S,Ravussin P,Rossi A,etal.Postoperative cognitive dysfunction〔J〕.Trends in Anaesthesia and Critical Care,2012;2(2):98-103.
2Tan W,Cao X,Wang J,etal.Tau hyperphosphorylation is associated with memory impairment after exposure to 1.5% isoflurane without temperature maintenance in rats〔J〕.Eur J Anaesthesiol,2010;27:835-41.
3Run X,Liang Z,Zhang L,etal.Anesthesia induces phosphorylation of tau〔J〕.J Alzheimers Dis,2009;16:619-26.
4Holscher C,van Aalten L,Sutherland C.Anaesthesia generates neuronal insulin resistance by inducing hypothermia〔J〕.BMC Neurosci,2008;9:100.
5Robert S.Biology and Human Behavior:The Neurological Origins of Individuality〔M〕.2nd edition.Chantilly:The Teaching Company,2005:21-47.
6Rothstein JD,Dykes-Hoberg M,Pardo CA,etal.Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate〔J〕.Neuron,1996;16(6):675-86.
7Maragakis NJ,Rothstein JD.Glutamate transporters in neurologic disease〔J〕.Arch Neurol,2001;58(3):365-70.
8Rao VL,Dogan A,Bowen KK,etal.Antisense knockdown of the glial glutamate transporter GLT-1 exacerbates hippocampal neuronal damage following traumatic injury to rat brain〔J〕.Eur J Neurosci,2001;13(1):119-28.
9Choi DW,Rothman SM.The role of glutamate neurotoxicity in hypoxic-ischemic neuronal death〔J〕.Annu Rev Neurosci,1990;13(1):171-82.
10Xie Z,Tanzi RE.Alzheimer’s disease and postoperative cognitive dysfunction〔J〕.Exp Gerontol,2006;41(3):346-59.
11Fodale V,Santamaria LB,Schifilliti D,etal.Anaesthetics and postoperative cognitive dysfunction:a pathological mechanism mimicking Alzheimer's disease〔J〕.Anaesthesia,2010;65(4):388-95.
12Liu W,Xu J,Wang H,etal.Isoflurane-induced spatial memory impairment by a mechanism independent of amyloid-beta levels and tau protein phosphorylation changes in aged rats〔J〕.Neurol Res,2001;34(1):3-10.
13Ancelin ML,de Roquefeuil G,Ledesert B,etal.Exposure to anaesthetic agents,cognitive functioning and depressive symptomatology in the elderly〔J〕.Br J Psychiatry,2001;178(3):360-6.
14Seymour DG,Severn AM.Cognitive dysfunction after surgery and anaesthesia:What can we tell the grandparents〔J〕?Age Ageing,2009;38(1):147-50.
15Cooper JK,Mungas D.Risk factor and behavioral differences between vascular and Alzheimer's dementias:the pathway to end stage disease〔J〕.J Geriatr Psychiatry Neurol,1993;6(1):29-33.
16Fodale V,Ritchie K,Rasmussen LS,etal.Anesthetics and Alzheimer's disease:background and research〔J〕.J Alzheimer's Dis Suppl,2010;3(1):1-3.
17Bohnen N,Warner MA,Kokmen E,etal.Early and midlife exposure to anesthesia and age of onset of Alzheimer's disease〔J〕.Int J Neurosci,1994;77(2):181-5.
18Culley DJ,Baxter M,Yukhananov R,etal.The memory effects of general anesthesia persist for weeks in young and aged rats〔J〕.Anesth Analg,2003;96(10):1004-9.
19Culley DJ,Baxter MG,Yukhananov R,etal.Long-term impairment of acquisition of a spatial memory task following isoflurane-nitrous oxide anesthesia in rats〔J〕.Anesthesiology,2004;100(3):309-14.
20Culley DJ,Baxter MG,Crosby CA,etal.Impaired acquisition of spatial memory 2 weeks after isoflurane and isoflurane-nitrous oxide anesthesia in aged rats〔J〕.Anesth Analg,2004;99(13):1393-7.
21Xie Z,Dong Y,Maeda U,etal.The inhalation anesthetic isoflurane induces a vicious cycle of apoptosis and amyloid beta-protein accumulation〔J〕.J Neurosci,2007;27(12):1247-54.
22Xie Z,Culley DJ,Dong Y,etal.The common inhalation anesthetic isoflurane induces caspase activation and increases amyloid beta protein level in vivo〔J〕.Ann Neurol,2008;64(6):618-27.
23Planel E,Richter KE,Nolan CE,etal.Anesthesia leads to tau hyperphosphorylation through inhibition of phosphatase activity by hypothermia〔J〕.J Neurosci,2007;27:3090-7.
24Sattler R,Tymianski M.Molecular mechanisms of glutamate receptor-mediated excitotoxic neuronal cell death〔J〕.Mol Neurobiol,2001;24(1):107-29.
25Obrenovitch TP,Urenjak J.Altered glutamatergic transmission in neurological disorders:from high extracellular glutamate to excessive synaptic efficacy〔J〕.Prog Neurobiol,1997;51(1):39-87.
26蔡桂兰,贾建平.轻度认知障碍和阿尔茨海默病患者血清中兴奋性氨基酸的含量〔J〕.中华神经科杂志,2007;8:544-8.
27疏树华,方才,潘建辉,等 .老年病人全麻术后颅内兴奋性氨基酸水平与术后认知功能障碍的关系〔J〕.中华麻醉学杂志,2010;30(3):290-3.
28Temple MD,O'Leary DM,Faden AI.The role of glutamate receptors in the pathophysiology of traumatic CNS injury.In:Head Trauma:Basic,Preclinical,and Clinical Directions〔M〕.4th ed.New York:Wiley,2008;87-113.
29Lipton SA,Rosenberg PA.Excitatory amino acids as a final common pathway for neurologic disorders〔J〕.N Engl J Med,1994;330(5):613-22.
30Seo S,Liu P,Leitch B.Spatial learning-induced accumulation of agmatine and glutamate at hippocampal CA1 synaptic terminals〔J〕.Neuroscience 2011;192(1):28-36.
31Bullock R,Zauner A,Woodward JJ,etal.Factors affecting excitatory amino acid release following severe human head injury〔J〕.J Neurosurg,1998;89(4):507-18.
32Robertson CL,Bell MJ,Kochanek PM,etal.Increased adenosine in cerebrospinal fluid after severe traumatic brain injury in infants and children:association with severity of injury and excitotoxicity〔J〕.Crit Care Med,2001;29:2287-93.
33Yon JH,Carter LB,Reiter RJ,etal.Melatonin reduces the severity of anesthesia-induced apoptotic neurodegeneration in the developing rat brain〔J〕.Neurobiol Dis,2006;21(5):522-30.
34Ma D,Williamson P,Januszewski A,etal.Xenon mitigates isoflurane-induced neuronal apoptosis in the developing rodent brain〔J〕.Anesthesiology,2007;106(7):746-53.
35Lunardi N,Ori C,Erisir A,etal.General anesthesia causes long-lasting disturbances in the ultrastructural properties of developing synapses in young rats〔J〕.Neurotox Res,2010;17(2):179-88.
36Jevtovic-Todorovic V.Anesthesia and the developing brain:are we getting closer to understanding the truth〔J〕?Curr Opin Anaesthesiol,2011;24(3):395-9.
〔2015-09-03修回〕
(编辑曲莉)
