靶向沉默转化生长因子β1表达的短发夹RNA的筛选*
2015-12-04李新强付琳琳唐小燕付素珍
李 敏,李新强,付琳琳,吴 余,王 虹,唐小燕,付素珍#
1)新乡医学院第一附属医院儿内科 卫辉453100 2)新乡医学院病理学教研室 新乡453003
肾脏纤维化是所有慢性肾脏疾病发展至肾功能衰竭的共同通路,其中肾小管-肾间质纤维化以细胞外基质(extracellular matrix,ECM)的过度沉积为主要病理特征[1]。肾小管上皮细胞-间充质转分化(epithelial to mesenchymal transition,EMT)与肾小管-肾间质纤维化密切相关。转化生长因子β1(transforming growth factor β1,TGF-β1)在肾小管上皮细胞EMT 过程中发挥重要作用,是目前公认的有效的促纤维化因子[2]。因此,抑制TGF-β1 的表达对于防治肾小管-肾间质纤维化具有重要意义。作者拟覆盖TGF-β1 基因cDNA 全长,设计和筛选靶向沉默TGF-β1 表达的短发夹RNA(short hairpin RNA,shRNA),以期为进一步研究参与TGF-β1 诱导肾小管-肾间质纤维化的下游分子奠定基础。
1 材料与方法
1.1 材料 人肾小管上皮细胞株HKC 购自中国医学科学院细胞库,p-Genesil-1 空载质粒和E.coli DH 5α 大肠杆菌为新乡医学院病理学教研室保存,BamHⅠ限制性内切酶、HindⅢ限制性内切酶、SalⅠ限制性内切酶、T4 DNA 连接酶均为大连TaKaRa 公司产品,D-葡萄糖为美国Aladdin 公司产品,兔抗TGF-β1 多克隆抗体为美国Abcam 公司产品,鼠抗人β-actin 单克隆抗体、辣根酶标记的山羊抗兔和辣根酶标记的兔抗鼠二抗为美国Santa Cruz 公司产品,增强化学发光试剂盒为武汉博士德公司产品。
1.2 靶向沉默TGF-β1 表达的shRNA 的设计和制备 按照siRNA 设计原则,覆盖TGF-β1 基因cDNA全长,设计靶向沉默TGF-β1 的shRNA 5 条(表1),并进行同源性分析。shRNA 的DNA 序列送大连TaKaRa 公司合成并退火。
1.3 靶向沉默TGF-β1 表达的shRNA 真核重组表达质粒的构建及鉴定 构建含沉默TGF-β1 shRNA的p-Genesil-shRNA 真核表达重组质粒及含无关shRNA 的p-Genesil-1-shRNA-vect 重组质粒。将目的片段shRNA 和质粒载体p-Genesil-1 在T4 DNA连接酶作用下16℃连接过夜,将连接产物转化入DH5α 感受态细胞中,37℃培养箱培养18 h 后挑取单克隆,37℃摇床过夜振摇扩增,取1 mL 菌液送大连TaKaRa 公司测序鉴定;菌液中提取质粒行SalⅠ酶切鉴定,质粒p-Genesil-1 的多克隆位点如下:-XbaⅠ-SalⅠ-EcoRⅠ-U6 Promotor-BamHⅠ-shRNA-HindⅢ-;在插入的shRNA 的3'端设计了一个SalⅠ的酶切位点GTCGAC(表1),若插入正确,SalⅠ单酶切时可切出一条约400 bp 的DNA 条带。
1.4 质粒的转染 以肾小管上皮细胞HKC 为研究对象,常规培养高糖(0.5 mol/L)或Ang Ⅱ(10-3mol/L)刺激的HKC 至对数生长期时,按Invitrogen公司Lipofectamine 2000 说明书进行质粒转染,转染8 h 后,去除含有转染混合物的培养基,换成新鲜的细胞生长培养基,48 h 后用G418 进行筛选,筛选后扩增细胞并进行后续实验。转入p-Genesil-shRNA 1~5重组质粒及p-Genesil-1-shRNA-vect 质粒的细胞分别命名为p-Genesil-shRNA1~5 细胞和p-Genesil-1-vect 细胞。
1.5 高糖刺激后各组细胞中TGF-β1 表达的Western blot 检测 收集HKC 细胞及高糖或AngⅡ刺激的HKC 细胞、p-Genesil-1-vect 细胞和各组p-Genesil-shRNA 细胞,提取细胞总蛋白,并按Bradford方法进行定量,变性处理后进行SDS-PAGE 电泳和转膜,50 g/L 脱脂牛奶封闭,室温2 h,一抗室温摇育2 h,二抗室温摇育2 h,按照增强化学发光试剂盒操作步骤进行显色、曝光,最后显影、定影、扫描。以β-actin 为内参照,蛋白上样量均为150 μg,鼠抗人β-actin 单克隆抗体、兔抗TGF-β1 多克隆抗体、辣根酶标记的山羊抗兔和辣根酶标记的兔抗鼠二抗的稀释度分别为1 ∶1 000、1 ∶300、1 ∶5 000 和1∶5 000。通过Quantity one 软件分析Western blot目的条带与内参照条带的灰度比值。每组均设5个平行对照组。

表1 靶向沉默TGF-β1 表达的shRNA 序列
1.6 统计学处理 采用SPSS 16.0 进行分析。应用单因素方差分析和LSD-t 检验比较高糖刺激或Ang Ⅱ刺激后各组细胞中TGF-β1 表达的差异,检验水准α=0.05。
2 结果
2.1 靶向沉默TGF-β1 表达的shRNA 真核表达重组质粒的鉴定 见图1。构建的p-Genesil-shRNA1、2、3、4 和5 真核表达重组质粒通过SalⅠ酶切鉴定结果显示5个shRNA 重组质粒均可切出与预计相符的400 bp 的片段。测序结果也显示所有重组质粒中,目的片段插入位点和方向正确,无碱基突变、插入、丢失,与实验设计相一致。

图1 靶向沉默TGF-β1 表达的shRNA 真核表达重组质粒酶切鉴定结果
2.2 靶向沉默TGF-β1 表达的shRNA 的筛选 见图2、3 和表2、3。Western blot 结果显示:与HKC 细胞相比,高糖或Ang Ⅱ刺激的HKC 细胞和p-Genesil-1-vect 细胞中TGF-β1 表达均增高,高糖或AngⅡ刺激的HKC 细胞和p-Genesil-1-vect 细胞中TGFβ1 表达差异无统计学意义。与高糖或Ang Ⅱ刺激的p-Genesil-1-vect 细胞相比,高糖或Ang Ⅱ刺激的各组p-Genesil-shRNA 细胞中TGF-β1 表达均降低。
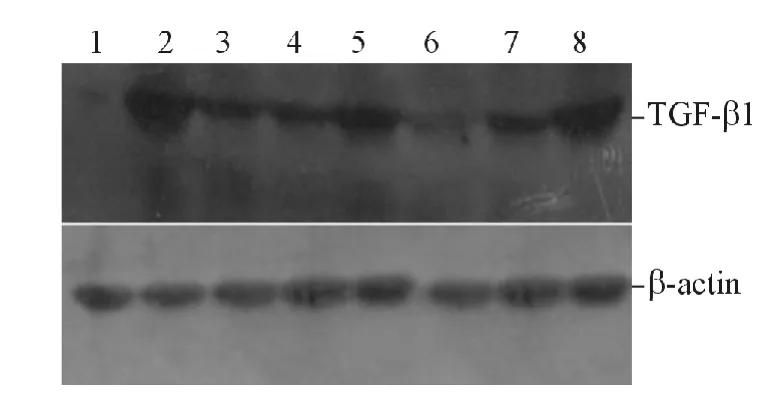
图2 高糖刺激时各组细胞中TGF-β1 表达的Western blot 检测
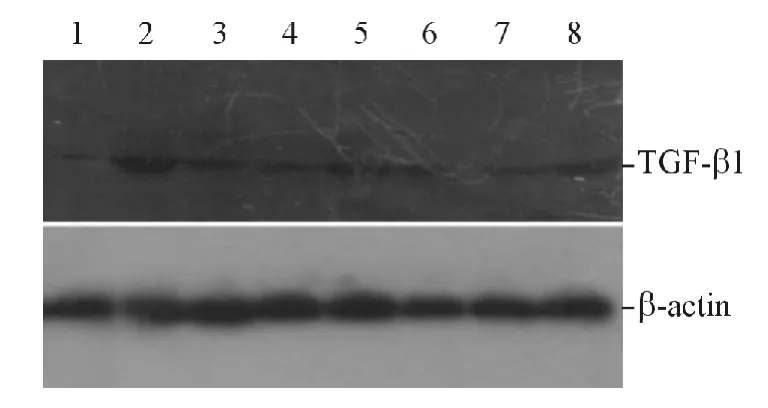
图3 Ang Ⅱ刺激时各组细胞中TGF-β1 表达的Western blot 检测
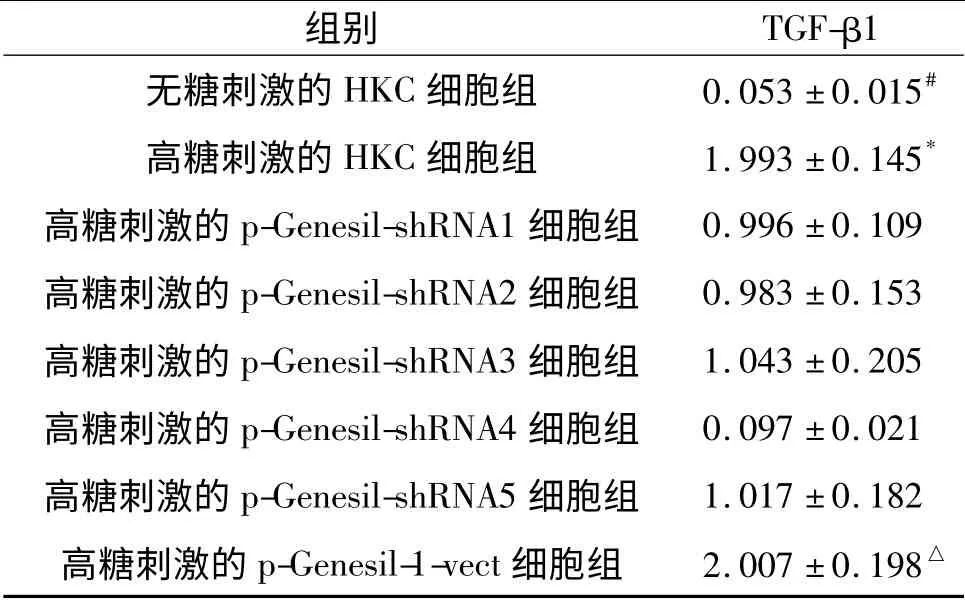
表2 高糖刺激时各组细胞中TGF-β1 表达的Western blot 检测结果(n=5)
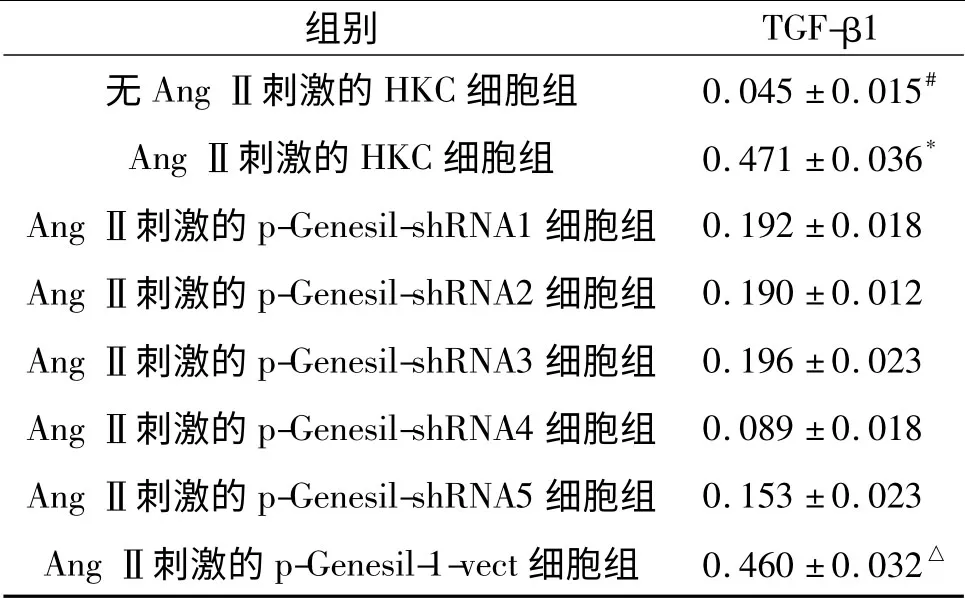
表3 Ang Ⅱ刺激时各组细胞中TGF-β1 表达的Western blot 检测结果(n=5)
3 讨论
EMT 在肾小管-肾间质纤维化中发挥重要作用,其发生发展受TGF-β/Smad 多条信号传导途径的调控;TGF-β1 是最为关键的促纤维化生长因子,有研究[3]报道TGF-β1 在肾脏纤维化进展过程中发挥了重要作用。TGF-β1 主要在肾脏中表达,由肾小管上皮细胞和肾小球系膜细胞等多种细胞合成和分泌,它不仅可以诱导多种ECM 成分的表达,而且可以通过减少蛋白酶及其激活物的表达,如基质金属蛋白酶,增加蛋白酶抑制剂以及金属蛋白酶组织抑制剂来抑制ECM 的降解。另外,TGF-β1 还是强大的免疫调节因子,对巨噬细胞等有强大的趋化作用。因此,TGF-β1 不仅对肾脏纤维化形成过程有重要作用,而且对慢性炎症的发生发展也可能产生潜在性的影响。因此,沉默TGF-β1 的表达有可能阻断、逆转或至少延缓肾脏纤维化的发生[4-7],有利于对肾脏纤维化发病机制和治疗策略进行深入的研究。因此,为了研究参与TGF-β1 诱导肾小管-肾间质纤维化的下游分子,该研究对靶向沉默TGF-β1 表达的方法进行了探索。
随着RNA 干扰(RNA interference,RNAi)技术在基因功能、肿瘤等研究中的广泛应用[8-9],以DNA为模板胞内合成shRNA 表达载体的RNAi 技术为研究提供了更为简便和实用的方法。shRNA 表达载体导入细胞中后,经过细胞内酶切机制形成siRNA,从而使靶基因沉默数周甚至数月。到目前为止,仅有学者[10]通过siRNA 沉默TGF-β1,观察了其对大鼠系膜细胞纤维连接蛋白和Ⅳ型胶原的影响,未见以肾小管上皮细胞为研究对象的siRNA 沉默TGFβ1 的相关报道。因此,该研究覆盖TGF-β1 基因cDNA 全长,设计和制备了靶向沉默TGF-β1 的5 条shRNA,并构建和鉴定了含TGF-β1 shRNA 的p-Genesil-shRNA 真核表达重组质粒。
该研究进结果显示,与HKC 细胞相比,高糖或AngⅡ刺激的HKC 细胞和p-Genesil-1-vect 细胞中TGF-β1 表达均增高,而后二者之间TGF-β1 表达差异无统计学意义;与高糖或AngⅡ刺激的p-Genesil-1-vect 细胞相比,高糖或AngⅡ刺激的各组p-Genesil-shRNA 细胞中TGF-β1 表达均降低。
综上所述,作者筛选出1 条可靶向沉默TGF-β1表达的shRNA,为进一步研究参与TGF-β1 诱导肾小管-肾间质纤维化的下游分子奠定了基础。
[1]Zeisberg M,Neilson EG.Mechanisms of tubulointerstitial fibrosis[J].J Am Soc Nephrol,2010,21(11):1819
[2]López-Hernández FJ,López-Novoa JM.Role of TGF-β in chronic kidney disease:an integration of tubular,glomerular and vascular effects[J].Cell Tissue Res,2012,347(1):141
[3]Lee HS.Mechanisms and consequences of TGF-β overexpression by podocytes in progressive podocyte disease[J].Cell Tissue Res,2012,347(1):129
[4]Kasuga H,Ito Y,Sakamoto S,et al.Effects of anti-TGF-beta type Ⅱreceptor antibody on experimental glomerulonephritis[J].Kidney Int,2001,60(5):1745
[5]Fukasawa H,Yamamoto T,Suzuki H,et al.Treatment with anti-TGF-beta antibody ameliorates chronic progressive ne-phritis by inhibiting Smad/TGF-beta signaling[J].Kidney Int,2004,65(1):63
[6]Petersen M,Thorikay M,Deckers M,et al.Oral administration of GW788388,an inhibitor of TGF-beta type ⅠandⅡreceptor kinases,decreases renal fibrosis[J].Kidney Int,2008,73(6):705
[7]Wang B,Koh P,Winbanks C,et al.miR-200a prevents renal fibrogenesis through repression of TGF-β2 expression[J].Diabetes,2011,60(1):280
[8]Ozpolat B,Sood AK,Lopez-Berestein G.Liposomal siRNA nanocarriers for cancer therapy[J].Adv Drug Deliv Rev,2014,66:110
[9]Davies JA,Unbekandt M.siRNA-mediated RNA interference in embryonic kidney organ culture[J].Methods Mol Biol,2012,886:295
[10]毛华雄.siRNA 沉默TGF-β1 对大鼠肾系膜细胞纤维连接蛋白和Ⅳ型胶原的影响[D].长沙:中南大学,2006.
