miR-375靶向调控人矮小同源盒基因2基因在人食管鳞状细胞癌中的表达
2015-12-02何贞月宋海珠
金 立,易 俊,何贞月,宋海珠
0 引 言
食管癌是八大常见肿瘤之一[1],其发病率居我国恶性肿瘤的第4位,病死率居全部恶性肿瘤的第6位[2],有2种病理类型:鳞状细胞癌(简称鳞癌)和腺癌[3-4]。在东南亚地区,超过90%的食管癌为鳞状细胞癌,食管鳞癌也是东亚地区最致命的肿瘤之一[5-6]。
人矮小同源盒基因2(short stature homobox 2,SHOX2)是同源异型家族的一个组成成员,约10000bp左右,位于人3号染色体长臂上,共包含10个CpG岛[7]。SHOX2基因在胚胎时期表达于中胚层和外胚层,对骨骼、心脏和神经系统的发育起着重要作用[8]。近年来一些学者发现SHOX2基因的表达变化与肿瘤的发生关系密切。在非小细胞肺癌和乳腺癌中,SHOX2高表达可能预示患者预后不良[9-10]。而在胃癌中,SHOX2高表达可能是由于STAT3激活所致[11]。随着研究的深入,SHOX2在多种肿瘤中的致癌作用机制已逐渐阐明,但在食管鳞癌方面,SHOX2的作用仍不清楚。
本研究采用软件预测,荧光素酶活性分析,通过转染mimics和inhibitor于食管鳞癌细胞,实时定量PCR检测等方法证实miR-375在食管鳞癌细胞EC9706中靶向调控SHOX2基因的表达,为进一步研究SHOX2基因在食管鳞癌中的作用奠定了基础。
1 材料与方法
1.1 实验材料 人食管鳞癌细胞EC9706,人正常食管上皮细胞购自上海复旦细胞库;人食管鳞癌组织,为我院心胸外科手术后病理保存标本。感受态大肠埃希菌 DH5α,Lipofectamine 2000转染试剂,miR-375 mimics购自上海吉凯公司;质粒 pmiR,pSHOX2-375-WT,pSHOX2-375-mut由上海吉玛公司合成;双荧光报告基因检测试剂盒购自Promega公司;XhoⅠ酶、NotⅠ酶购自Fermentas公司;凝胶回收试剂盒购自BioFlux公司;DNA ligation kit购自TOYOBO公司;PCR试剂盒购于 abm公司;用于Western blot的抗体均购于abcam公司。
1.2 预测miR-375和SHOX2基因的可能作用位点 运用生物信息学预测软件TargetScan、miRanda、PicTar、miRTarget2和PITA按照软件操作流程预测miR-375和SHOX2基因可能的作用位点。
1.3 体外实验验证SHOX2基因表达的靶向调控
1.3.1 SHOX2基因3'UTR区克隆及报告基因系统质粒构建 取对数生长期细胞,Trizol法提取总RNA,紫外分光光度仪检测所提取的总RNA浓度。取总RNA,用RT-PCR试剂盒(abm)逆转录为cDNA。qPCR引物由上海吉玛公司设计并合成:SHOX2 F(SacⅠ):ATGAGCTCATTTCCCCCTCTCTATC;SHOX2 R(HindⅢ):ATAAGCTTCAAAGCTCAACCGCATAC。运用 2×Taq PCR MasterMix(abm)20 μL体系进行PCR扩增,优化后的反应条件为:2×MasterMix 12μL ,cDNA 2μL,上游引物0.6 μL ,下游引物0.6 μL,ddH2O 4.8 μL,95 ℃ 变性 5 min,开始1个循环,95℃变性30 s,60℃退火30 s,72℃延伸1 min,共35个循环。将PCR产物回收,分别用XhoⅠ、NotⅠ双酶切处理,然后与经双酶切处理后的载体连接,构建成突变Vector 2个重组质粒载体,分别转化感受态大肠埃希菌DH5α,挑取单个菌落培养,提取质粒,测序鉴定。
1.3.2 细胞转染与Luciferase实验步骤 共有3个质粒,分别是:pmiR,pSHOX2-375-WT,pSHOX2-375-mut;2个micro-RNA,分别是miR-375,miR-NC。分为7组:pmiR组,pSHOX2-375-WT组,pSHOX2-375-WT+miR-375组,pSHOX2-375-WT+miR-NC组,pSHOX2-375-mut组,pSHOX2-375-mut+miR-375组,pSHOX2-375-mut+miR-NC组。
将Roche X-treme GENE HP DNA Transfection Reagent,质粒,miR-375 和 serum-free DMEM medium放置于室温中,于平行的7个EP管中分别加入300μL的serum-free DMEM medium,分别加入每组质粒和miR,混匀。在7个EP管中分别加入18 μL DNA:Transfection Reagent(1∶2),混匀。用掌上离心机瞬时离心,静置20min。将1mL 0.25%Trypsin 0.05%EDTA细胞消化液均匀滴加在EC9706细胞表面。37℃放置1 min后,加入5 mL含有10%FBS的DMEM终止消化。离心,取出上清,加入8 mL含有20%FBS的DMEM,计数。
轻轻加入300 μL细胞悬液于7个EP管中,每孔加入100 μL细胞和转染复合物的混合液。培养箱中培养24 h。用检测试剂盒Dual-Glo Luciferase Assay System(Promega cat.no.E2920)。将 1 瓶Dual-Glo Luciferase Buffer加入到装有Dual-Glo Luciferase Substrate的瓶子中,每孔加入75 μL Dual-Glo Luciferase Reagent,震荡混匀,静置15min,读板。重复读板3次。加入2.4 mL Dual-Glo Stop&Glo Buffer,然后加入24 μL的 Dual-Glo Stop & Glo Substrate(Dual-Glo Stop&Glo Substrate:Dual-Glo Stop&Glo Buffer=1:100)得到Dual-Glo Stop&Glo Reagent,混匀。取 96孔板,每孔加入 75 μL Dual-Glo Stop & Glo Reagent,震荡混匀,静置 15 min,重复读板3次,导出实验结果。
1.3.3 RNA提取和qPCR分析 总RNA通过Trizol试剂提取,提取过程遵循试剂说明书进行。提取后的总RNA使用逆转录试剂盒逆转录成cDNA保存于-20℃,用于后续qPCR。SHOX2和miR-375的相对表达量通过STEP ONE RT-PCR仪器以SYBR Green法,以GAPDH为内参进行荧光采集分析。
1.3.4 Western blot检测 总蛋白通过 RIPA裂解液获得,并保存于-20℃温度下。凝胶电泳使用10%的SDS电泳液、湿转液将蛋白转移到PVDF膜上。然后经过5%的脱脂牛奶室温下封闭2 h,加SHOX2抗体 4℃孵育过夜,荧光兔抗标记,以GAPDH为内参进行曝光分析。
1.3.5 细胞免疫组化染色 将9706细胞接种于培养皿中进行细胞爬片,5 d后4%多聚甲醛固定,空气干燥,0.5%Triton X-100 孵育 20 min,3%H2O2孵育15 min,封闭血清孵育20 min。一抗孵育4℃过夜,二抗37℃孵育30 min。DAB避光显色,苏木精复染,树胶封固。
1.4 统计学分析 应用SPSS 19.0软件进行统计分析,定量资料采用均数±标准差(±s)表示,组间比较采用单因素方差(One-Way ANOVA)分析,组间两两比较方差齐同采用LSD-t检验进行分析,方差不齐时采用Tamhane's T2检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 生物信息学预测 生物信息学预测软件TargetScan、miRanda、PicTar、miRTarget2 和 PITA 预测结果显示:miRNA-375在SHOX2 3'UTR1156-1170 bp间有且仅有1个保守结合位点。见图1。
2.2 质粒测序 pSHOX2-375-WT Vector,pSHOX2-375-mut Vector重组质粒测序显示:克隆到pmiR载体上的序列与目标序列完全一致,不存在点突变。见图2。
2.3 荧光素酶活性分析 Luciferase测定结果显示:pSHOX2-375-WT+miR-375组荧光素酶活性(0.261±0.036)显著低于其余 6组[pmiR 组(1.818 ± 0.061)、pSHOX2-375-WT 组(1.820 ±0.086)、pSHOX2-375-WT+miR-NC 组(1.851 ±0.094)、pSHOX2-375-mut组 (1.861 ± 0.059)、pSHOX2-375-mut+miR-375 组(1.896 ±0.048)和pSHOX2-375-mut+miR-NC 组(1.760 ±0.062)],差异均有统计学意义(P<0.01);而其余6组间差异无统计学意义(P>0.05)。
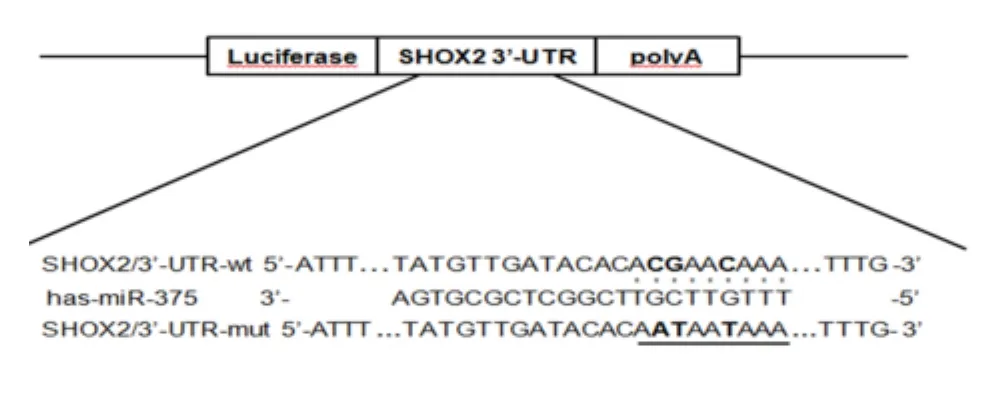
图1 预测靶点及miR-375结合SHOX2 3'UTR位点Figure 1 Target of prediction and miR-375 in combination with the SHOX2 3'UTR site
图2 重组质粒测序结果Figure 2 Sequence of the recombinant plasmid
2.4 qPCR分析与Western blot检测 转染miR-375于食管鳞癌细胞EC9706后,SHOX2 mRNA和蛋白表达量低于转染miR-NC的细胞(P<0.05)。见图3。

图3 过表达miR-375后SHOX2 mRNA和蛋白表达Figure 3 Expressions of SHOX2 mRNA and protein when miR-375 was overexpressed in the EC9706 cells
2.5 细胞免疫组化染色 转染miR-375于EC9706细胞后行细胞免疫组化染色分析。过表达miR-375组SHOX2表达呈阴性;而转染 miR-NC细胞的SHOX2表达呈阳性。见图4。
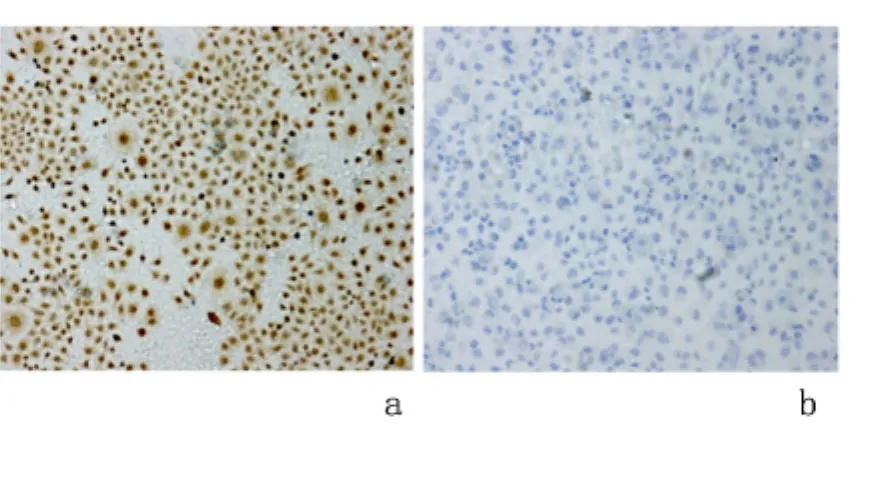
图4 镜下观察EC9706细胞内过表达miR-375后SHOX2细胞染色结果(免疫组化染色 ×200)Figure 4 Microscopic observation of SHOX2 when miR-375 was overexpressed in the EC9706 cells(IHC×200)
2.6 组织病理标本检测 分析2例人体食管鳞癌术后病理标本的miR-375与SHOX2检测。食管鳞癌组织中的miR-375较癌旁组织相比表达降低,而SHOX2表达较癌旁组织表达增强(P<0.05)。见图5。
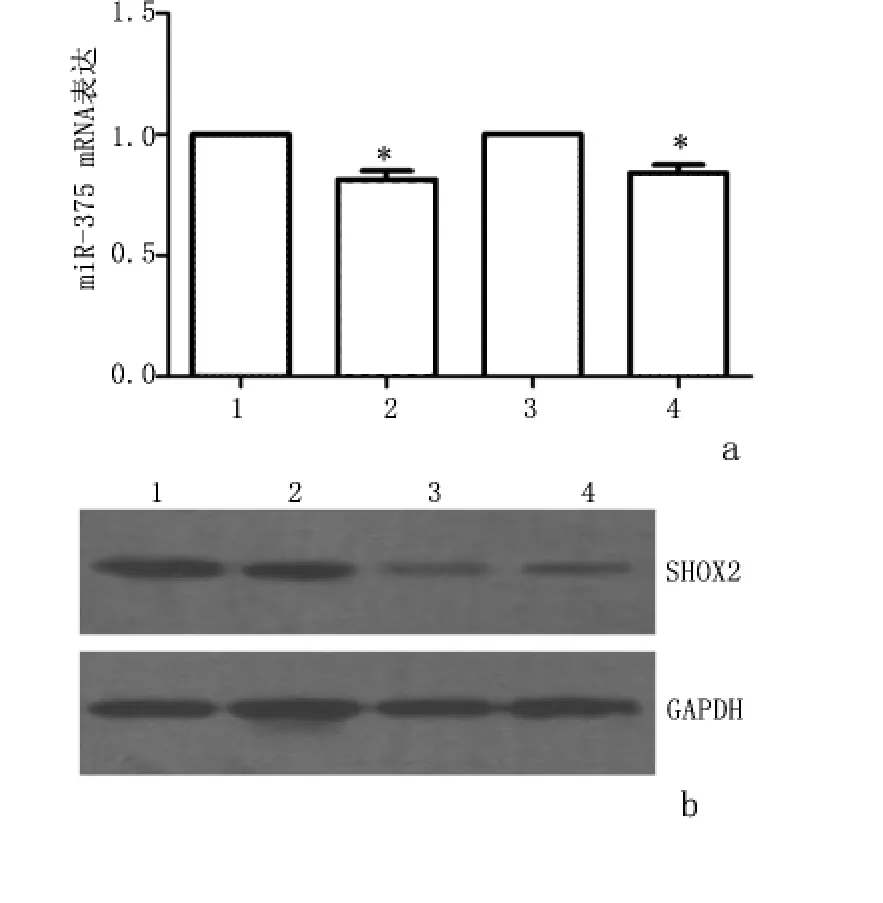
图5 食管鳞癌组织和癌旁组织标本中的mRNA和蛋白表达情况Figure 5 SHOX2 mRNA and protein expressions in the esophageal squamous carcinoma tissues and normal esophageal tissues
3 讨 论
食管癌根治主要依靠外科手术[6,12],但其早期诊断率不高,往往直到肿瘤进展到晚期阶段才被确诊[13-14],从而失去手术机会,而食管鳞癌对于化疗的敏感性不高,因此积极寻找食管鳞癌的早期诊断方法,对于提高食管鳞癌的整体治愈率具有特殊的重要性和紧迫性[15-20]。
最近的研究显示,miR-375表达下调与非小细胞肺癌的增殖和活跃程度相关[19],而高表达miR-375的小细胞肺癌患者则提示可能预后较差和生存期较短[21]。在妇科肿瘤方面,miR-375在宫颈癌、子宫内膜癌和乳腺癌中表达水平的降低,被视为预后不良的标志[22]。另有研究发现miR-375可抑制胃癌细胞的体外侵袭和转移能力,miR-375同样可抑制原发性肝癌的复发和转移[23]。之前有文献报道miR-375在食管腺癌的患者中表达水平降低[24],但是miR-375能否对下游SHOX2基因表达进行靶向调节,以及其在食管鳞癌中的作用及分子机制未见报道。
SHOX2是SHOX的同源基因,是同源异型家族的一个成员,位于人3号染色体长臂上,约10000 bp[7],有SHOX2a、SHOX2b、SHOX2c 3个亚型。主要功能为在脊椎动物的胚胎形成时期进行转录调节。大量研究报道SHOX2的表达改变会影响早期的骨骼和神经系统的发育,而SHOX2甲基化则在多种肿瘤发生早期可以起到预测作用[25]。在肝癌发生过程中,SHOX2的高表达将增强体外肝癌细胞的侵袭和增殖能力,过表达的SHOX2会促进肝癌细胞的生长,抑制SHOX2表达后,肿瘤细胞生长也相应收到抑制[26]。在一些未被确诊为肺癌,却早期出现的胸膜渗出的病例,SHOX2出现高表达的情况下,随后都被确诊为肺癌。这提示SHOX2的高表达或许能作为肺癌胸膜腔渗出的指示性标志物[27]。虽然大量的研究证实SHOX2可视为多种肿瘤的致癌基因,但是其在食管鳞癌的具体调控机制仍不明确。
我们运用5个生物信息学预测软件TargetScan、miRanda、PicTar、miRTarget2 和 PITA 对 miR-375 在SHOX2上可能的作用靶点进行预测,结果显示:miRNA-375在SHOX2 3'UTR1156-1170 bp间有且仅有1个保守结合位点。我们将此位点进行基因突变处理,体外细胞荧光素酶报告基因实验检测miRNA-375对突变前后SHOX2基因表达的影响。结果显示:SHOX2野生型与miR-375结合后萤光素酶活性显著低于其他处理组和对照组,提示miRNA-375对SHOX2基因有抑制作用。随后我们转染miR-375的mimics于EC9706并分别测定SHOX的mRNA和蛋白表达。结果显示miR-375过表达后EC9706的SHOX2 mRNA和蛋白表达水平都受到抑制,这可能预示食管鳞癌细胞中,SHOX2为受miR-375调控的下游靶基因,miR-375可以靶向负调控SHOX2基因的表达;随后细胞免疫组化染色过表达 miR-375,EC9706细胞SHOX2表达呈阴性提示:SHOX2表达可能与miR-375表达相关。提示食管鳞癌组织中SHOX2的表达增强可能与miR-375的表达改变相关。最后,人体食管鳞癌术后病理标本的miR-375与SHOX2检测分析发现:高表达的miR-375癌旁组织中,SHOX2表达要显著低于食管鳞癌组织中的SHOX2表达。上述结果提示:SHOX2的表达受miR-375调控,并且食管鳞癌的发生发展可能是由于miR-375以及SHOX2表达水平改变参与调控等一系列结果所致。
本研究采用生物学预测及体内外实验证实的方法,初步证实了在食管鳞癌,miRNA-375可以靶向负调控SHOX2基因的表达。
[1] 万岱维,何宋兵,汪 良.微小RNA在结肠癌中的研究进展[J].医学研究生学报,2013,26(4):421-424.
[2] Enzinger PC,Mayer RJ.Esophageal cancer[J].New Engl J Med,2003,349(23):2241-2252.
[3] Zhang C,Wang C,Chen X,et al.Expression profile of microRNAs in serum:a fingerprint for esophageal squamous cell carcinoma[J].Clin Chem,2010,56(12):1871-1879.
[4] Hu A,Huang JJ,Xu WH,et al.miR-21 and miR-375 microRNAs as candidate diagnostic biomarkers in squamous cell carcinoma of the larynx:association with patient survival[J].Am J Transl Res,2014,6(5):604-613.
[5] He XX,Kuang SZ,Liao JZ,et al.The regulation of microRNA expression by DNA methylation in hepatocellular carcinoma[J].Mol Biosyst,2014,26:26.
[6] Kimura S,Naganuma S,Susuki D,et al.Expression of microRNAs in squamous cell carcinoma of human head and neck and the esophagus:miR-205 and miR-21 are specific markers for HNSCC and ESCC[J].Oncol Rep,2010,23(6):1625-1633.
[7] Liu H,Chen CH,Ye W,et al.Phosphorylation of Shox2 is required for its function to control sinoatrial node formation[J].J Am Heart Assoc,2014,3(3):e000796.
[8] Sun C,Yu D,Ye W,et al.The short stature homeobox 2(Shox2)-bone morphogenetic protein(BMP)pathway regulates dorsal mesenchymal protrusion development and its temporary function as a pacemaker during cardiogenesis[J].J Biol Chem,2015,290(4):2007-2023.
[9] Song L,Yu H,Li Y.Diagnosis of lung cancer by SHOX2 gene methylation assay[J].Mol Diagn Ther,2015,19(3):159-167.
[10] Hong S,Noh H,Teng Y,et al.SHOX2 is a direct miR-375 target and a novel epithelial-to-mesenchymal transition inducer in breast cancer cells[J].Neoplasia,2014,16(4):279-290.
[11] Zhao J,Dong Y,Kang W,et al.Helicobacter pylori-induced STAT3 activation and signalling network in gastric cancer[J].Oncoscience,2014,1(6):468-475.
[12] Feber A,Xi L,Pennathur A,et al.MicroRNA prognostic signature for nodal metastases and survival in esophageal adenocarcinoma[J].Ann Thorac Surg,2011,91(5):1523-1530.
[13] Bin H,Bangliang Y,Baoxiang W.MicroRNAs in esophageal cancer[J].Mol Med Rep,2012,6(3):459-465.
[14] 蒋 平,宋 丹,房振羽,等.食管癌术后局部复发再次治疗的疗效观察[J].医学研究生学报,2013,26(12):1275-1278.
[15] 张 雷,强 勇,易 俊,等.微卫星序列不稳定性与食管癌发病风险的相关性研究[J].医学研究生学报,2013,26(10):1056-1060.
[16] 董国华,许 飚,姚 圣,等.食管癌放疗后手术切除116例临床分析[J].医学研究生学报,2013,26(9):948-951.
[17] Bier H.Current research in head and neck cancer:molecular pathways,novel therapeutic targets,and prognostic factors[M].New York:S Karger AG,2005:0065-3071.
[18] 陈 静,周 园,郑 磊,等.慢病毒载体构建稳定的maspin表达敲减食管癌细胞株[J].医学研究生学报,2014,27(2):138-142.
[19] Li H,Shang H,Shu D,et al.gga-miR-375 plays a key role in tumorigenesis post subgroup J avian leukosis virus infection[J].PLoS One,2014,9(4):e90878.
[20] Isozaki Y,Hoshino I,Akutsu Y,et al.Screening of alternative drugs to the tumor suppressor miR-375 in esophageal squamous cell carcinoma using the connectivity map[J].Oncology,2014,87:351-363.
[21] Yoda S,Soejima K,Hamamoto J,et al.Claudin-1 is a novel target of miR-375 in non-small-cell lung cancer[J].Lung Cancer,2014,85(3):366-372.
[22] Li H,Ji J,Xie Q,et al.Aberrant expression of liver microRNA in chickens infected with subgroup J avian leukosis virus[J].Virus Res,2012,169:268-271.
[23] Shen ZY,Zhang ZZ,Liu H,et al.miR-375 inhibits the proliferation of gastric cancer cells by repressing ERBB2 expression[J].Exp Ther Med,2014,7(6):1757-1761.
[24] Luo J,Wu J,Li Z,et al.miR-375 suppresses IGF1R expression and contributes to inhibition of cell progression in laryngeal squamous cell carcinoma[J].Biomed Res Int,2014,374598(10):1471-2407.
[25] Ilse P,Biesterfeld S,Pomjanski N,et al.Analysis of SHOX2 methylation as an aid to cytology in lung cancer diagnosis[J].Cancer Genom Proteom,2014,11(5):251-258.
[26] Yang T,Zhang H,Cai SY,et al.Elevated SHOX2 expression is associated with tumor recurrence of hepatocellular carcinoma[J].Ann Surg Oncol,2013,20(3):013-3132.
[27] Dietrich D,Jung M,Puetzer S,et al.Diagnostic and prognostic value of SHOX2 and SEPT9 DNA methylation and cytology in benign,paramalignant and malignant pleural effusions[J].PLoS One,2013,8(12):e84225.
